
1
1
Materiały internetowe
• http://www.angelo.edu/faculty/kboudrea/inde
x/Notes_Chapter_08.pdf
• http://cwx.prenhall.com/petrucci/medialib/po
wer_point/Ch24.ppt
• http://web.mit.edu/2.813/www/Class
%20Slides/Lecture%207%20Mat.Prod.pdf
• http://www.google.pl/search?
hl=pl&lr=&client=firefox-
a&channel=s&rls=org.mozilla:pl:official&q=uk
lad+okresowy+pierwiastkow
%2BPower+Point&start=20&sa=N
•
/~chem1/Lecture%20Notes%20pdfs/Series%20
• http://zchoin.fct.put.poznan.pl
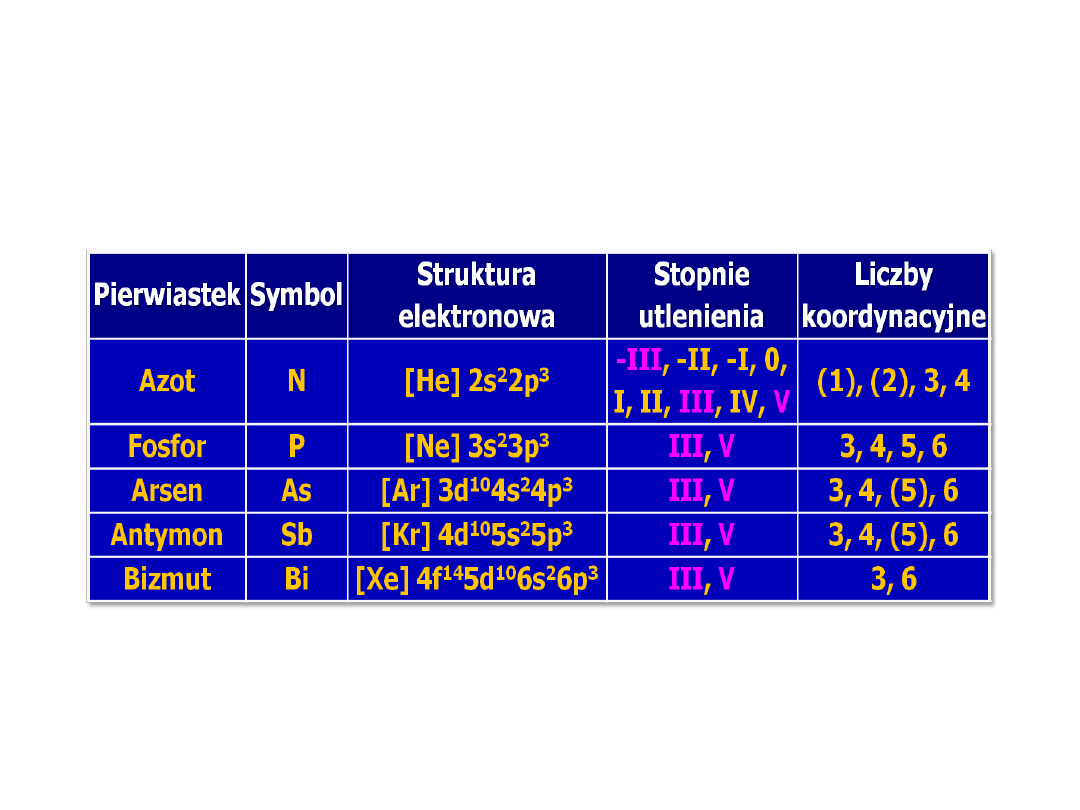
2
2
Struktura elektronowa
azotowców

3
3
Stopnie utlenienia azotowców
Stopnie utlenienia:
Przykłady:
-3 st.utl.
NH
3
, PH
3
+1 st.utl.
N
2
O
+3 st.utl.
N
2
O
3
, HNO
2
, H
3
PO
3
, Bi
2
(SO
4
)
3
+5 st.utl.
N
2
O
5
, HNO
3
, H
3
PO
4
, H
3
AsO
4
Ponadto -2, -1, +2 i +4 st. utlenienia (np.: N
2
H
4
, NH
2
OH, NO, NO
2
)
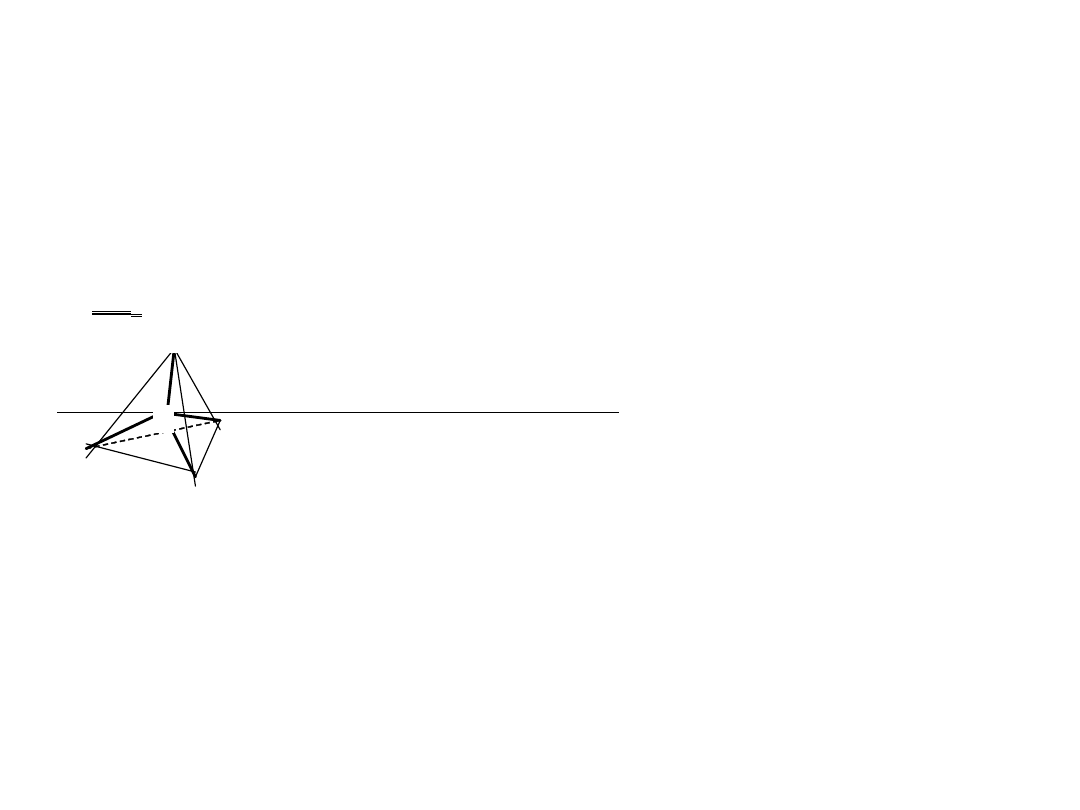
4
4
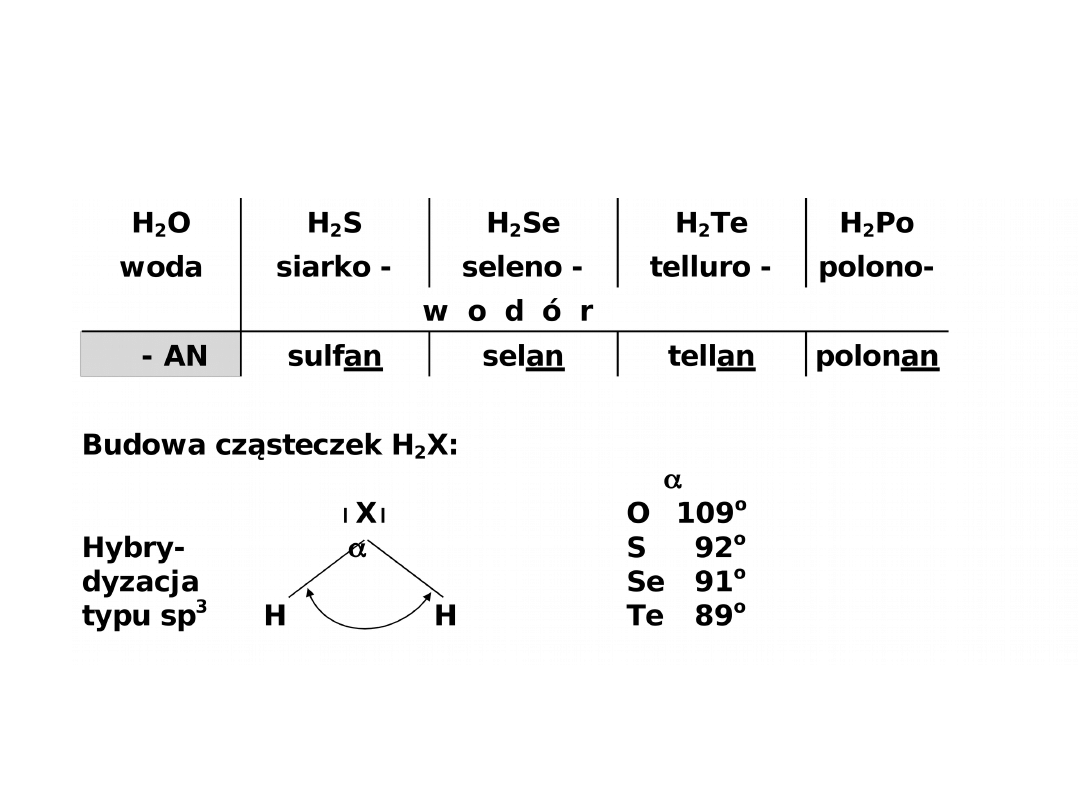
Połączenia z wodorem - wodorki
N
P As
Sb
Bi
XH
3
x
x
x
x
x
X
2
H
4
x x
HX
3
x
a) XH
3
NH
3
amoniak
PH
3
fosfan (fosforowodór)
AsH
3
arsan (arsenowodór)
SbH
3
styban (antymonowodór)
H
BiH
3
bizmutan (bizmutowodór)
H
H
X
..
Hybrydyzacja typu sp
3
cząsteczki w kształcie piramidy
kąty od 106
o
(dla NH
3
) do 91o (dla SbH
3
i BiH
3
).
NH
3
cząsteczka polarna = 1,48 D
wiązanie atomowe spolaryzowane asocjacja cząsteczek
NH
3
w stanie ciekłym:
N - H - - - N (wiązania wodorowe)
Pozostałe wodorki są niepolarne mała różnica
elektroujemności pomiędzy wodorem i azotowcem.
Hybrydyzacja typu sp
3
cząsteczki w kształcie piramidy
kąty od 106
o
(dla NH
3
) do 91o (dla SbH
3
i BiH
3
).
NH
3
cząsteczka polarna = 1,48 D
wiązanie atomowe spolaryzowane asocjacja cząsteczek
NH
3
w stanie ciekłym:
N - H - - - N (wiązania wodorowe)
Pozostałe wodorki są niepolarne mała różnica
elektroujemności pomiędzy wodorem i azotowcem.
5
5
Połączenia z wodorem - wodorki
Amoniak
N
2
+ 3H
2
= 2NH
3
H
o
= - 92 kJ / mol
szybkość
wydajność
temperatura
ciśnienie
katalizator
+
+
+
-
+
0
Warunki optymalne syntezy:
30 - 35 MPa, 770 - 780 K,
katalizator – np. Fe
Metoda laboratoryjna: z soli amonowych
NH
4
+
+ OH
-
= NH
3
H
2
O NH
3
+ H
2
O
Amoniak rozpuszczony w wodzie
NH
3
jest dobrze rozpuszczalny w wodzie i tworzy słaby
wodorotlenek:
NH
3
+ H
2
O NH
3
H
2
O
ogrzewanie
6
6
Połączenia z wodorem - wodorki
Amoniak
NH
3
H
2
O NH
4
+
+ OH
-
K
b
= 1,8 10
-5
Sole amonowe:
NH
4
Cl, (NH
4
)
2
SO
4
, NH
4
HSO
4
.
Spalanie amoniaku w tlenie: 4NH
3
+ 3O
2
= 2N
2
+ 6H
2
O
W obecności katalizatora (Pt):
4NH
3
+ 5O
2
= 4NO + 6H
2
O metoda Ostwalda
Ciekły (bezwodny) NH
3
jest dobrym rozpuszczalnikiem dla
substancji polarnych. Ulega autodysocjacji:
2NH
3
= NH
4
+
+ NH
2
-
słaby kwas mocna zasada
Pochodne amoniaku:
Amidki
np. NaNH
2
, Ca(NH
2
)
2
I midki
np. Li
2
NH, MgNH
Azotki
np. Na
3
N, Mg
3
N
2
, AlN
Hydroksylamina NH
2
OH
7
7
Połączenia z wodorem - wodorki
Amoniak
Aminy
R
1
-R
1
, -R
2
, -R
3
lub -H
N R
2
R
3
Typy amin:
1) 1-szo rzędowa R
1
= R
2
= H, R
3
H,
np. (CH
3
)NH
2
2) 2-go rzędowa R
1
= H,
R
2
, R
3
H, np. (C
2
H
5
)
2
NH
3) 3-cio rzędowa R
1
, R
2
, R
3
H,
np. (C
8
H
17
)
3
N
4) czwartorzedowe sole amonowe
R
1
+
R
2
N R
4
X
-
X
-
to np.: Cl
-
, Br
-
R
3
I nne związki azotu z wodorem:
H
H
hybrydyzacja obu
Hydrazyna N
2
H
4
N N
atomów azotu
H
H
typu sp
2

8
8
Połączenia z wodorem - wodorki
I nne związki azotu z wodorem:
H
H
hybrydyzacja obu
Hydrazyna N
2
H
4
N N
atomów azotu
H
H
typu sp
2
W roztworze wodnym posiada właściwości słabo zasadowe:
N
2
H
4
H
2
O hydrat hydrazyny czyli (NH
2
NH
3
+
)OH
-
Hydrazyna i jej pochodne są silnymi środkami redukującymi -
wydzielają złoto, platynę i srebro z ich soli.
Stosowana jest paliwo rakietowe (+ substancje silnie
utleniające, np. ciekły tlen, H
2
O
2
, st. HNO
3
).

9
9
Połączenia z wodorem -
wodorki
Azydek wodoru HN
3
kwas azotowodorowy
umiarkowanie mocny kwas:
Sole kwasu azotowodorowego to azydki:
NaN
3
azydek sodu,
Ca(N
3
)
2
azydek wapnia
Azydek sodu jest używany w samochodowych poduszkach
powietrznych.
Wodorki pozostałych azotowców :
PH
3
- fosfan (fosforowodór)
toksyczne gazy
AsH
3
- arsan
nie posiadają wł.
SbH
3
- styban
zasadowych
BiH
3
- bizmutan
z wyj. PH
3
P
2
H
4
- dwufosfan
HN
3
= H
+
+ N
3
-
10
10
Tlenowe połączenia
azotowców
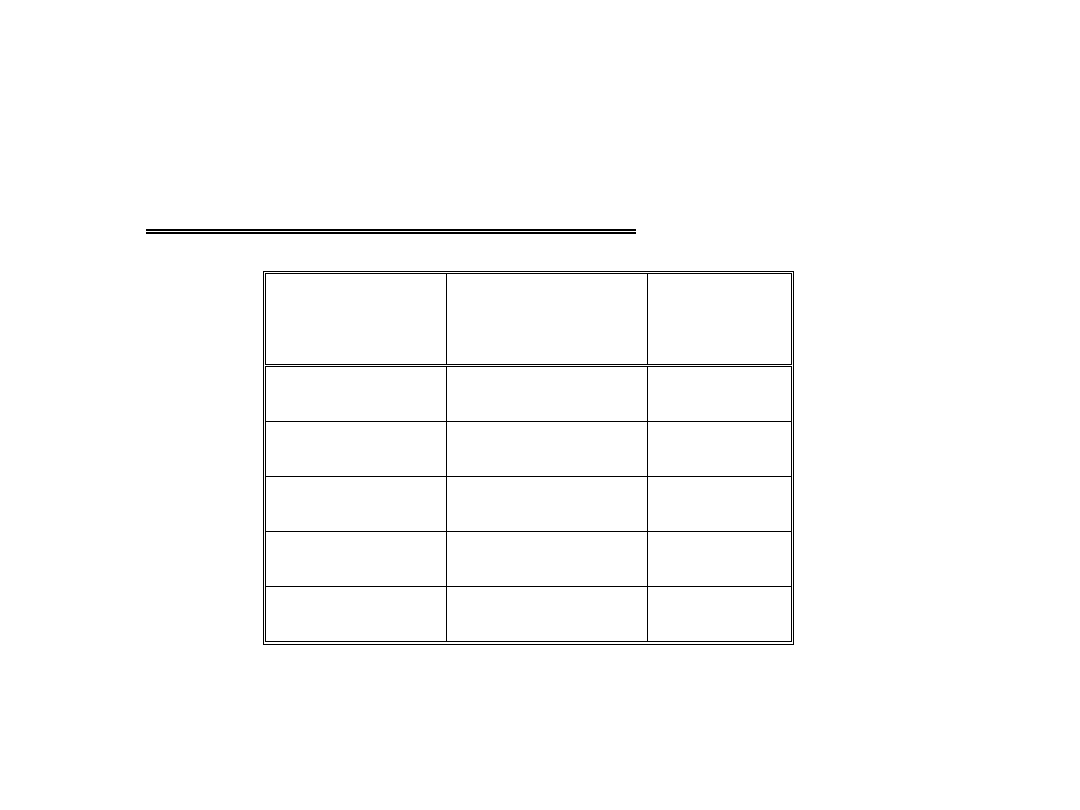
Tlenki i kwasy tlenowe azotu:
Stopień
utlenienia
Tlenki
Kwasy
+1
N
2
O
H
2
N
2
O
2
+2
NO
+3
N
2
O
3
HNO
2
+4
NO
2
, N
2
O
4
+5
N
2
O
5
HNO
3
11
11
Tlenowe połączenia
azotowców
Tlenek azotu (NO)
Otrzymywanie:
1
o
N
2
+ O
2
2NO
2
o
3Cu + 8H
+
+ 2NO
3
-
= 3Cu
2+
+ 2NO + 4H
2
O
3
o
NH
3
NO
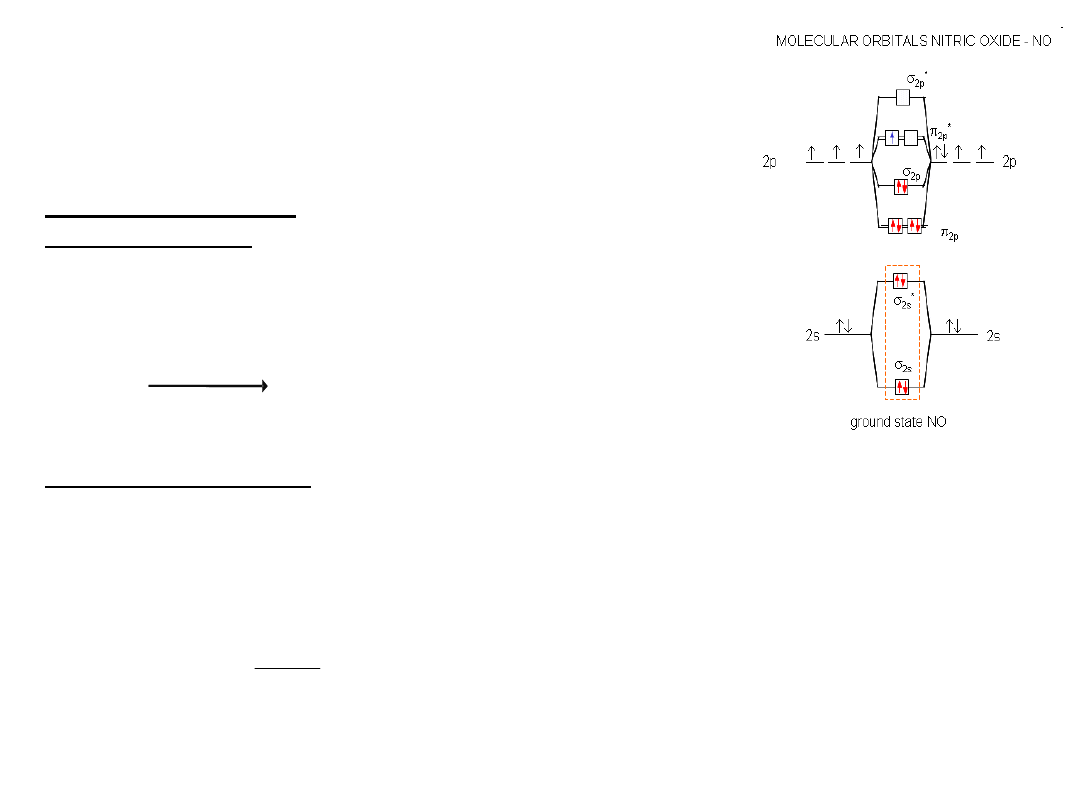
Budowa cząsteczki NO: 5 + 6 = 11
O
2
:
6 + 6 = 12
Budowa cząsteczki NO jest taka jak O
2
ale o 1 elektron mniej:
KK (2s)
2
(
*
2s)
2
(2p
x
)
2
(2p
y
)
2
(2p
z
)
2
(
*
2p
y
)
1
liczby elektronów
walencyjnych
walencyjnych
rząd
wiązania:
katalityczne
spalanie
2,5
=
2
3
-
8
12
12
Tlenowe połączenia
azotowców
Kwas azotowy(I I I ) = HNO
2
kwas azotowy(I I I ) kwas azotawy HNO
2
J est to kwas nietrwały. W stężonych roztworach ulega rozkładowi:
3HNO
2
= H
+
+ NO
3
-
+ 2NO + H
2
O
HNO
2
H
+
+ NO
2
-
K
a
= 510
-4
Sole kwasu azotawego: azotyny, np. NaNO
2
, NH
4
NO
2
, Ca(NO
2
)
2
Anion NO
2
-
: 5 + 2 x 6 + 1 = 18 el. walencyjnych
Cząsteczka O
3
: 6 x 3 = 18 el. walencyjnych
Anion NO
2
-
jest izoelektronowy z cząsteczką O
3
ta sama
struktura orbitali molekularnych (patrz cząsteczka O
3
wg. teorii
orbitali molekularnych).
J est kwasem słabym:
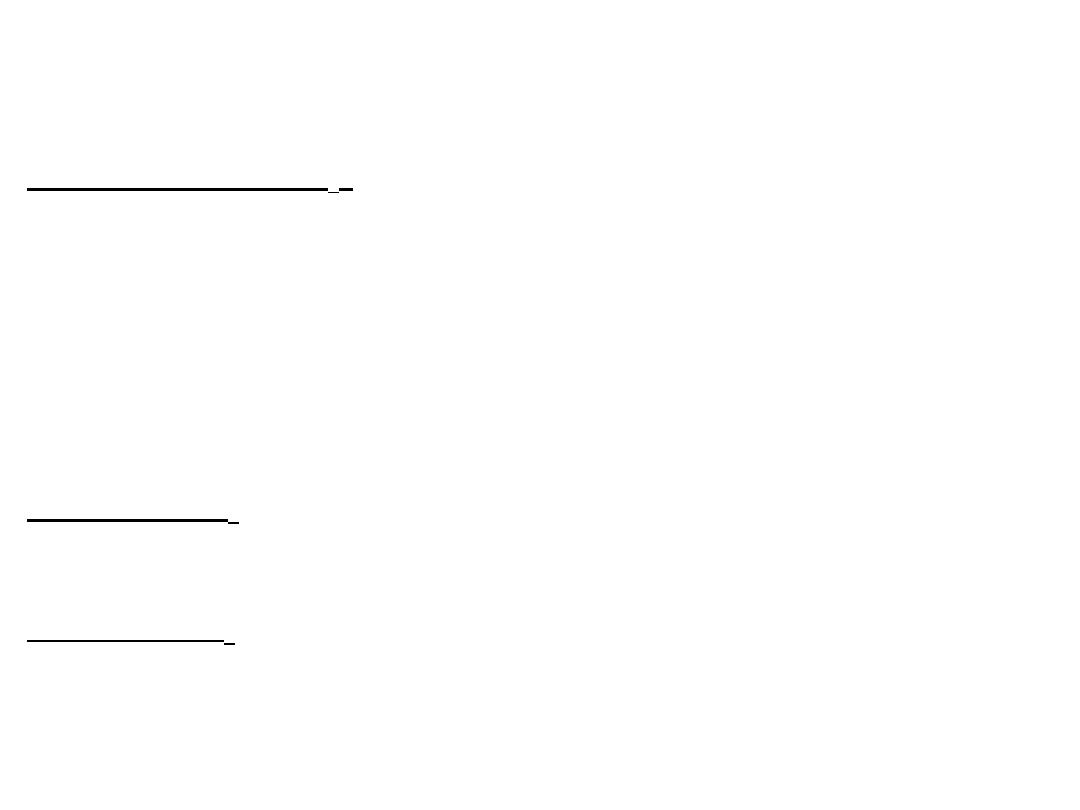
13
13
Tlenowe połączenia
azotowców
Dwutlenek azotu (NO
2
)
2NO + O
2
= 2NO
2
W temperaturze < 420 K NO
2
ulega dimeryzacji:
2NO
2
N
2
O
4
N
2
O
4
+ H
2
O = HNO
3
+ HNO
2
jonowo: N
2
O
4
+ H
2
O = H
+
+ NO
3
-
+ HNO
2
Cząsteczka NO
2
5 + 2 x 6 = 17 elektronów walencyjnych 1 niesparowany
elektron cząsteczka paramagnetyczna
Cząsteczka O
3
6 x 3 = 18 elektronów walencyjnych
Cząsteczka NO
2
ma budowę podobną do O
3
- ale posiada o 1
elektron mniej:
1
0
del
2
del
2
3
,
2
2
2
,
1
2
2
2
2
y
2
1
y
2
3
2
1
)
(
)
(
)
(
)
(
)
t
(
)
p
2
(
)
p
2
(
)
s
2
(
)
s
2
(
KKK
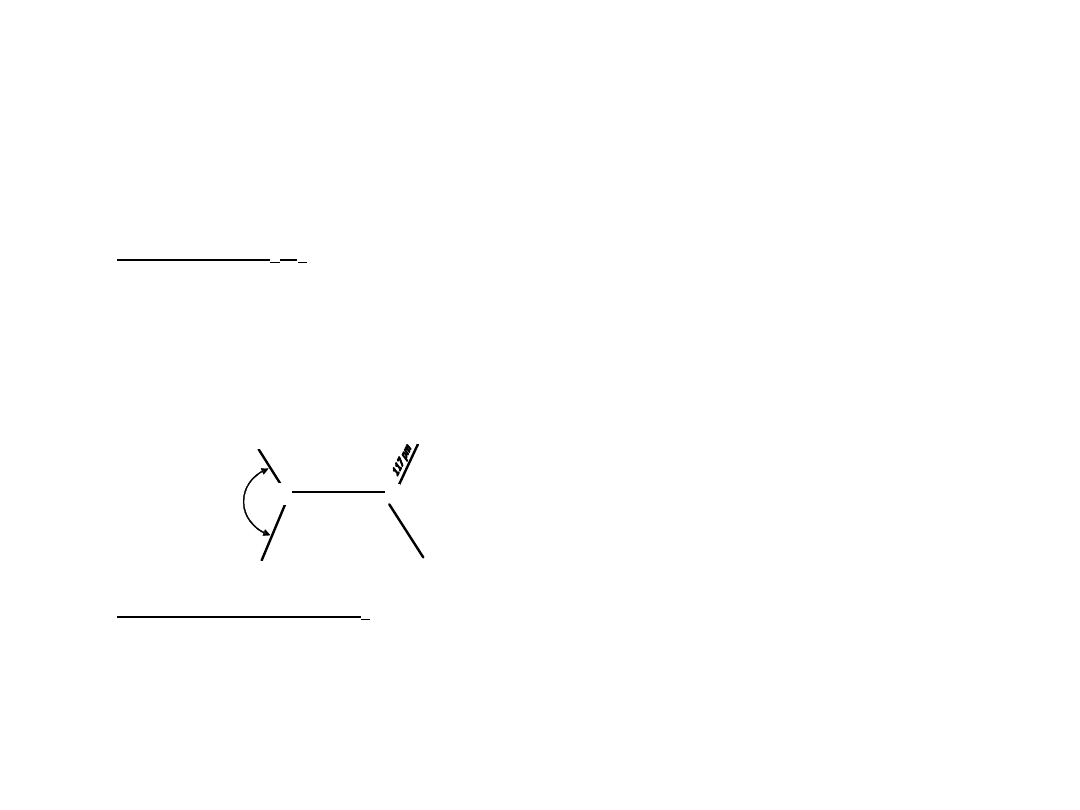
14
14
Tlenowe połączenia
azotowców
Cząsteczka N
2
O
4
2 x 5 + 4 x 6 = 34 elektrony walencyjne nie ma tutaj
niesparowanego elektronu cząsteczka diamagnetyczna
Wiązanie N - N w cząsteczce N
2
O
4
ma większą długość (164 pm) niż
pojedyńcze wiązanie N - N w cząsteczce hydrazyny (145 pm)
wiązanie słabsze od wiązania pojedynczego:
Kwas azotowy - HNO
3
J est to mocny kwas:
HNO
3
H
+
+ NO
3
-
J est kwasem utleniającym:
Cu + HNO
3
= ?
3Cu + 8H
+
+ 2NO
3
-
= 3Cu
2+
+ 2NO + 4H
2
O
126
0
N
N
O
O
O
O
164 pm

15
15
Tlenowe połączenia
azotowców
Kwas azotowy - HNO
3
J est to mocny kwas:
HNO
3
H
+
+ NO
3
-
J est kwasem utleniającym:
Cu + HNO
3
= ?
3Cu + 8H
+
+ 2NO
3
-
= 3Cu
2+
+ 2NO + 4H
2
O
Dobierz współczynniki do tej reakcji pisząc reakcje połówkowe
Cu + HCl reakcja nie zachodzi HCl nie jest kwasem
utleniającym.
W HNO
3
roztwarzają się wszystkie metale za wyjątkiem złota
i platynowców.
Woda królewska - mieszanina stężonych roztworów wodnych HNO
3
i HCl w stosunku objętościowym 1 : 3. Reakcja roztwarzania złota
w wodzie królewskiej:
Dobierz współczynniki do tej reakcji pisząc reakcje połówkowe.
O
H
2
NO
AuCl
H
4
NO
Cl
4
Au
2
4
3

16
16
Otrzymywanie kwasu azotowego –
etapy otrzymywania
1
o
N
2
+ 3H
2
= 2NH
3
2
o
4NH
3
+ 5O
2
= 4NO + 6H
2
O
3
o
NO +
1
/
2
O
2
= NO
2
4
o
2NO
2
N
2
O
4
5
o
N
2
O
4
+ H
2
O = HNO
3
+ HNO
2
6
o
3HNO
2
= HNO
3
+ 2NO + H
2
O
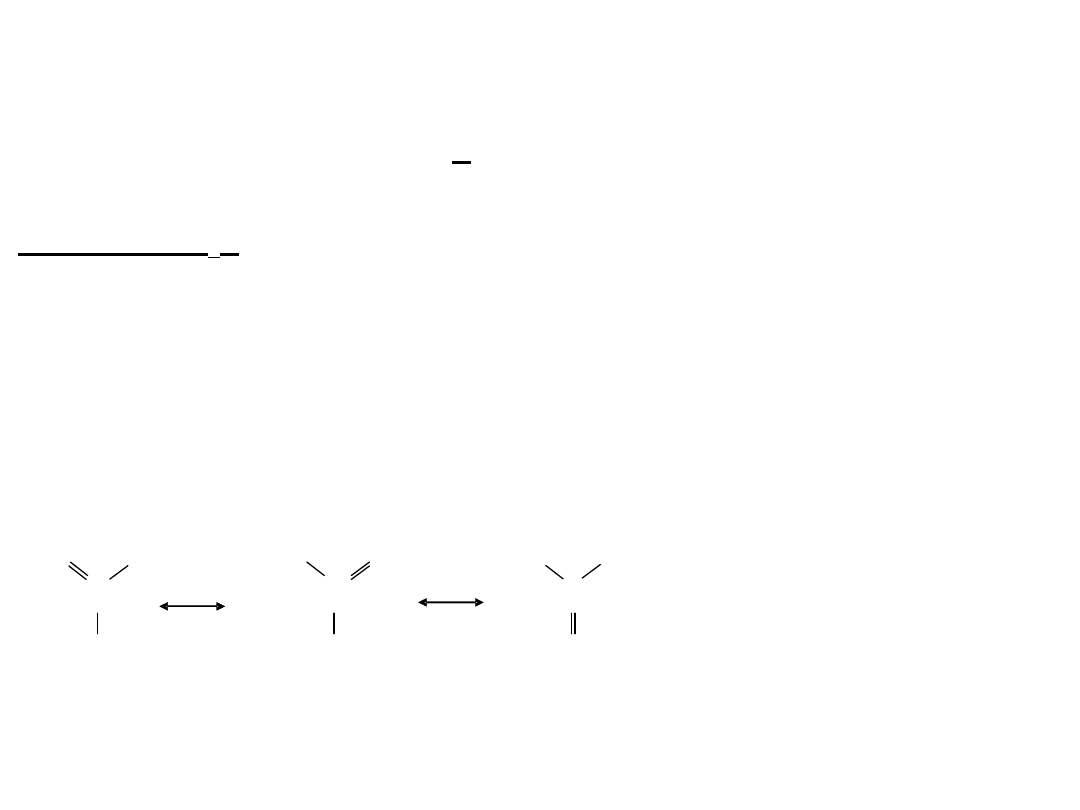
17
17
HNO
3
Stężony HNO
3
: 69% mas., d = 1,41 kg/ dm
3
Sole kwasu azotowego AZOTANY, np: NaNO
3
, Ca(NO
3
)
2
,
Al(NO
3
)
3
Kształt anionu
3
NO
jest płaski (hybrydyzacja sp
2
)
Strukturę elektronową (wzory Lewisa) anionu
3
NO
oddają
3 mezomeryczne wzory elektronowe:
:
O O
:
:
O
O
:
:
O O
:
N
N
N
:
O
:
:
O
:
:
O

18
18
Tlenki fosforu, arsenu, antymonu i
bizmutu
• Fosfor, arsen i antymon nie tworzą prostych tlenków
Me
2
O
3
i Me
2
O
5
, tylko odpowiednie dimery (odróżnia je
to od azotu, który ma zdolność do tworzenia wiązań
wielokrotnych). Bizmut tworzy tlenek (Bi
2
O
3
)n (o
budowie polimerycznej),
a pięciotlenku Bi
2
O
5
nie tworzy wcale:
4Me + 3O
2
→ Me
4
O
6
(Me=P, As, Sb)
4nBi + 3nO
2
→ 2(Bi
2
O
3
)n
• Zasadowość tritlenków rośnie w szeregu N
2
O
3
→
(Bi
2
O
3
)n. Tritlenki azotu, fosforu i arsenu są kwasowe,
antymonu – amfoteryczny a bizmutu – zasadowy.
• Trwałość pentatlenków maleje w szeregu N
2
O
5
→
Sb
4
O
10
.
19
19
Tlenki i kwasy tlenowe
fosforu
st. utl. tlenki
kwasy
+3 P
4
O
6
H
3
PO
3
ortofosforawy = fosforowy(I I I )
+5
P
4
O
10
H
3
PO
4
ortofosforowy = fosforowy(V)
P
4
O
6
+ 6H
2
O = 4H
3
PO
3
P
4
O
10
+ 6H
2
O = 4H
3
PO
4
H
3
PO
4
ma ścisłą nazwę kwas ortojednofosforowy, zwyczajowo
nazywamy go kwasem fosforowym
H
3
PO
4
- kwas o średniej mocy
(x)
:
H
3
PO
4
H
+
+ H
2
PO
4
-
K
a1
= 7 10
-3
H
2
PO
4
-
H
+
+ HPO
4
2-
K
a2
= 8 10
-8
HPO
4
2-
H
+
+ PO
4
3-
K
a3
= 4 10
-13
(x)
ze względu na 1-szy etap dysocjacji
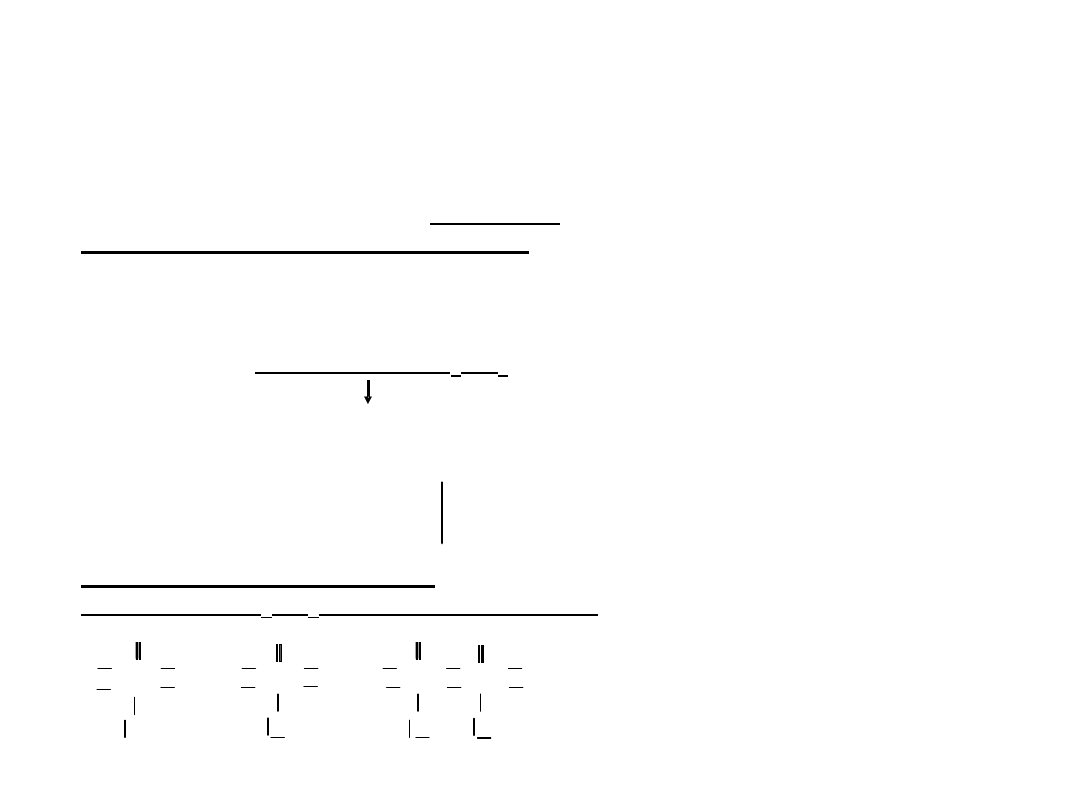
20
20
Tlenki i kwasy tlenowe
fosforu
Sole kwasu fosforowego to fosforany
Przykłady soli kwasu fosforowego:
NaH
2
PO
4
, Ca(H
2
PO
4
)
2
dwuwodorofosforan sodu i wapnia
K
2
HPO
4
, MgHPO
4
jednowodorofosforan potasu i magnezu
Ca
3
(PO
4
)
2
, AlPO
4
(obojętny) fosforan wapnia i glinu
Odwadnianie H
3
PO
4
kondensacja kwasu fosforowego polifosforany
Mamy dwa typy polifosforanów:
budowa łańcuchowa
budowa pierścieniowa
kwasy ortofosforowe
kwasy metafosforowe
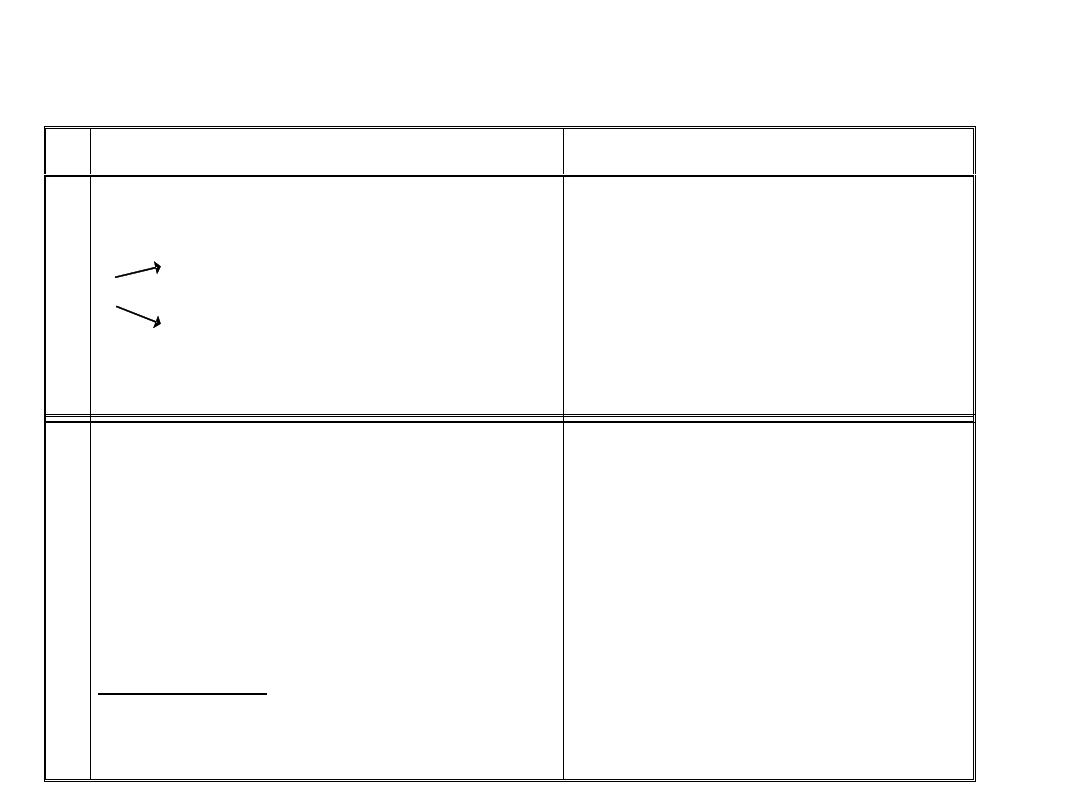
1. Łańcuchy polifosforanów
Ogrzewanie H
3
PO
4
w temp. 470 - 570 K:
O
O
O O
HO - P - OH + HO - P - OH = HO - P - O - P - OH + H
2
O
OH OH
OH OH
kwas ortodwufosforowy
(H
4
P
2
O
7
)
walencyjnych
21
21
Połączenia pozostałych azotowców z
tlenem
+3
+5
As
Amfoteryczny
AsO
3
3-
(H
3
AsO
3
)
As
4
O
6
As
3+
(As
4
O
6
- arszenik - silna trucizna)
Kwasowy
As
4
O
10
AsO
4
3-
(H
3
AsO
4
)
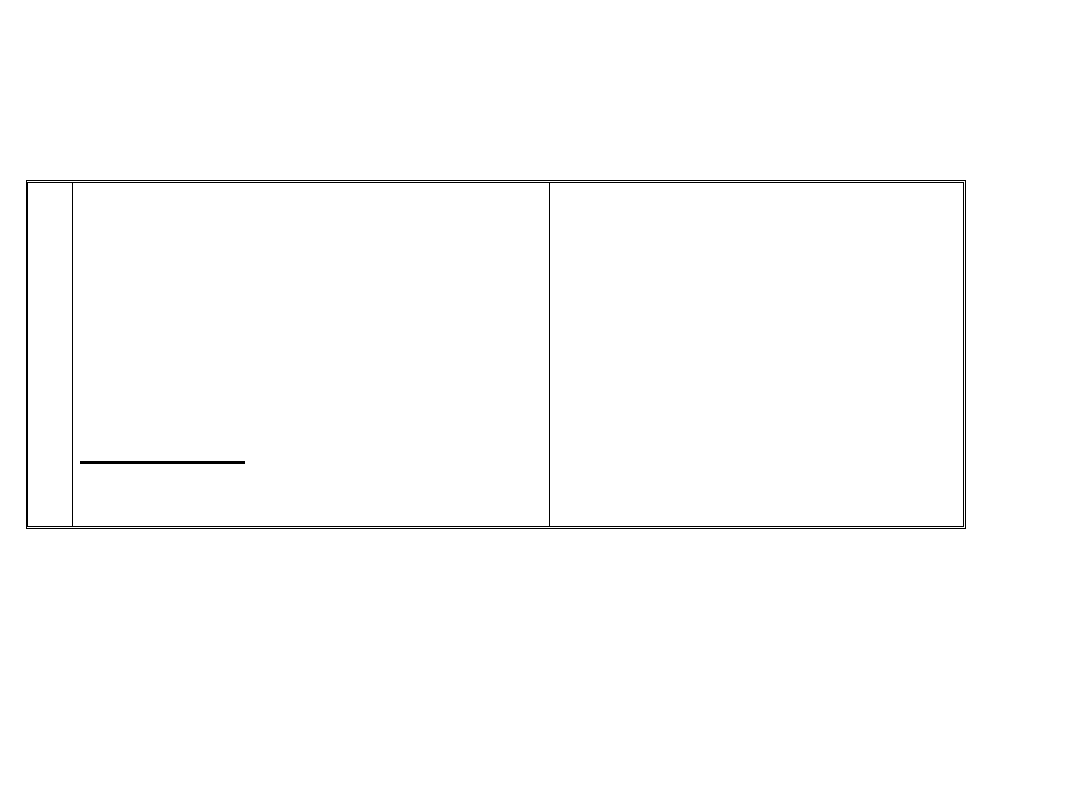
Sb
Zasadowy
Sb
4
O
6
Sb
3+
Sb(OH)
3
– wodorotlenek antymonu(I I I )
Sb
2
(SO
4
)
3
- siarczan antymonu(I I I )
Hydroliza Sb
3+
:
Sb
3+
+ H
2
O = SbO
+
+ 2H
+
SbO
+
: kation antymonylowy
Kwasowy
Sb
2
O
5
[Sb(OH)
6
]
-
HSb(OH)
6
– kwas
heksahydroksoantymonowy(V)
22
22
Połączenia pozostałych azotowców z
tlenem
Bi
Zasadowy
Bi
2
O
3
Bi
3+
Bi(OH)
3
– wodorotlenek bizmutu(I I I )
Bi
2
(SO
4
)
3
- siarczan bizmutu(I I I )
Hydroliza Bi
3+
:
Bi
3+
+ H
2
O = BiO
+
+ 2H
+
BiO
+
: kation bizmutylowy
Kwasowy
Bi
2
O
5
BiO
3
-
(BiO
4
3-
)
Kwasy bizmutu(V) nie są znane

23
23
• Nawozy azotowe - to nawozy, które zawierają
główny składnik pokarmowy roślin - azot,
niezbędny do syntezy m.in. białek, często w
formie bezpośrednio przyswajalnej przez
rośliny, rzadziej w formie przyswajalnej po
przemianach zachodzących w glebie.
• Spośród wszelkich nawozów mineralnych
nawozy azotowe mają największe znaczenie
gospodarcze, wpływając w największym stopniu
na plonowanie większości roślin.
• Nawozy te dzieli się na
:
• amonowe
: siarczan (21% N), chlorek amonu
(25% N), węglan amonu, ortofosforan(V)
amonu, woda amoniakalna
• saletrzane
(azotanowe(V)): saletra wapniowa
(14% N), saletra sodowa (15% N), saletra
potasowa (14% N)
• saletrzano-amonowe
: mieszaniny soli amonu i
saletr oraz saletra amonowa (34% N), saletrzak
• amidowe np. mocznik (46% N).
• Do nawozów azotowych zaliczyć można ponadto
niektóre mączki nawozowe, takie jak mączka
rybna (mączka mięsna) - 9-10% N, mączka
rogowa, z kopyt, racic - 12-14% N, mączka z
suszonej krwi - 12-15% N itp.

24
24
Nawozy fosforowe
Są to nawozy sztuczne zawierające związki fosforu rozpuszczalne w
wodzie.
F o s f o r y t y (zawierają Ca
3
(PO
4
)
2
) nie mogą być używane
jako nawozy.
Przerabia się je na :
a) SUPERFOSFATY
Ca
3
(PO
4
)
2
+ 2H
2
SO
4
= Ca(H
2
PO
4
)
2
+ 2CaSO
4
Ca
3
(PO
4
)
2
+ H
2
SO
4
= 2CaHPO
4
+ CaSO
4
b) SUPERFOSFATY PODWÓJ NE
Ca
3
(PO
4
)
2
+ 4H
3
PO
4
= 3Ca(H
2
PO
4
)
2
Są to nawozy sztuczne zawierające związki fosforu rozpuszczalne w
wodzie.
F o s f o r y t y (zawierają Ca
3
(PO
4
)
2
) nie mogą być używane
jako nawozy.
Przerabia się je na :
a) SUPERFOSFATY
Ca
3
(PO
4
)
2
+ 2H
2
SO
4
= Ca(H
2
PO
4
)
2
+ 2CaSO
4
Ca
3
(PO
4
)
2
+ H
2
SO
4
= 2CaHPO
4
+ CaSO
4
b) SUPERFOSFATY PODWÓJ NE
Ca
3
(PO
4
)
2
+ 4H
3
PO
4
= 3Ca(H
2
PO
4
)
2
25
25
TLENOWCE
tlen
siarka
selen
tellur
polon
Elektroujemność
wg skali
Allreda-Rochowa
3,50
2,44
2,48
2,01
1,76
stan skupienia
gaz
ciała stałe
metaliczność
niemetale
półmetale
metal
elektrony
walencyjne
s
2
p
4

26
26
Stopnie utlenienia
• główny stopień utlenienia -2 (H
2
O,
H
2
S),
• tlen poza -2 st. utlenienia występuje
też na -1 (H
2
O
2
) i na +2 (OF
2
),
• pozostałe tlenowce występują na
stopniach utlenienia: +2, +4, + 6,
• trwałość stopni utlenienia +4 i +6
wzrasta ze wzrostem masy atomowej
tlenowca.
Tlenki – przeważają wiązania jonowe.
Siarczki, selenki i tellurki - do 50% wiązania jonowego.
Tlenki – przeważają wiązania jonowe.
Siarczki, selenki i tellurki - do 50% wiązania jonowego.

27
27
Występowanie w przyrodzie
Tlen
litosfera
46% mas.
hydrosfera 89% mas.
atmosfera 23% mas.
Tlen w stanie wolnym występuje w postaci: O, O
2
i O
3
związki chemiczne, minerały woda, krzemiany, dwutlenek krzemu
(krzemionka), minerały (sole) tlenowe.
średnio
w skorupie
ziemskiej 50%
Siarka
Zawartość w skorupie ziemskiej 0,026% mas. (16-te miejsce).
W stanie wolnym występuje w USA, Rosji, Sycylii, Polsce
(Tarnobrzeg).
Minerały siarki:
FeS
piryt
ZnS
blenda cynkowa
PbS
galena ołowiowa
CaSO
4
2H
2
O
gips
CaSO
4
anhydryt
BaSO
4
baryt
28
28
Występowanie w przyrodzie
Selen i tellur: zawartość w skorupie ziemskiej wynosi odpowiednio:
5 10
-6
i 1 10
-7
%
Towarzyszą minerałom siarczkowym.
Polon – naturalny pierwiastek promieniotwórczy - występuje w rudach
uranowych.
29
29
Otrzymywanie
Tlen
a) Elektroliza roztworów wodnych zasad i soli:
ANODA: 2OH
-
= H
2
O +
1
/
2
O
2
+ 2e
b) frakcjonowana destylacja skroplonego powietrza
c) Rozkład związków zawierających tlen:
HgO = Hg + 1/ 2O
2
KClO
3
= KCl + 3/ 2O
2
2MnO
4
-
+ 6H
+
+ 5H
2
O
2
= 2Mn
2+
+ 8H
2
O + 5O
2
Są to metody laboratoryjne otrzymywania tlenu.
Efekt J ule'a - Thomsona
- rozprężanie gazu powoduje jego silne oziębienie
Wyjątek: wodór i hel gazy hiperidealne
Temperatury skraplania:
N
2
= 77 K
He = 4 K
O
2
= 90 K
30
30
Otrzymywanie
Siarka
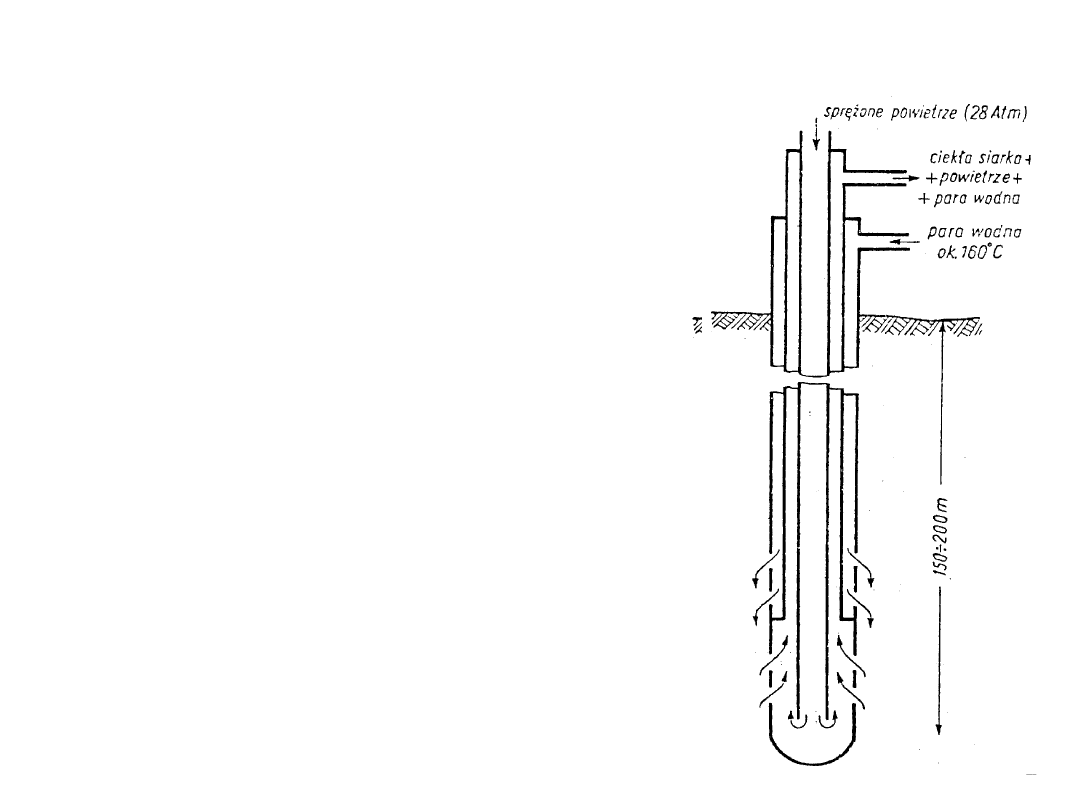
a)metoda odkrywkowa
- Tarnobrzeg
b) metoda Frascha –
wytapianie siarki
przegrzaną parą wodną
c) metoda Clausa
H
2
S + 1/2O
2
= H
2
O + S
d) metoda laboratoryjna
S
2
O
3
2-
+ 2H
+
= S + SO
2
+ H
2
O
Siarka
a)metoda odkrywkowa
- Tarnobrzeg
b) metoda Frascha –
wytapianie siarki
przegrzaną parą wodną
c) metoda Clausa
H
2
S + 1/2O
2
= H
2
O + S
d) metoda laboratoryjna
S
2
O
3
2-
+ 2H
+
= S + SO
2
+ H
2
O

31
31
Otrzymywanie -selen
Występuje w skorupie ziemskiej w ilości 0,05 ppm
jako zanieczyszczenie niektórych rud siarczkowych.
Przemysłowo pozyskuje się go jako produkt uboczny
rafinacji rud miedzi i siarki. Doprowadzony do postaci
tlenku (SeO
2
) selen rozpuszcza się w kwasie
azotowym. Następnie przepuszcza się przez tak
otrzymany roztwór dwutlenek siarki. Wolny selen
wytrąca się jako czerwony osad (odmiana alotropowa
beta). Laboratoryjnie selen otrzymuje się redukując
hydrazyną kwas selenowy(VI) (H
2
SeO
4
).
Z punktu widzenia odżywiania bogatym źródłem
selenu jest pszenica, ryż brązowy, owies, pestki dyni,
a także drób.
Selen jest jednym z niezbędnych
Selen jest jednym z niezbędnych
ultraelementów, który musi być dostarczany w
ultraelementów, który musi być dostarczany w
pożywieniu. Zawartość selenu w produktach
pożywieniu. Zawartość selenu w produktach
spożywczych różni się znacznie, co związane jest z
spożywczych różni się znacznie, co związane jest z
dużymi różnicami w zawartości selenu w glebie i
dużymi różnicami w zawartości selenu w glebie i
wodzie w różnych częściach świata. Gleby na terenie
wodzie w różnych częściach świata. Gleby na terenie
Polski są uważane za ubogie w selen.
Polski są uważane za ubogie w selen.
Występuje w skorupie ziemskiej w ilości 0,05 ppm
jako zanieczyszczenie niektórych rud siarczkowych.
Przemysłowo pozyskuje się go jako produkt uboczny
rafinacji rud miedzi i siarki. Doprowadzony do postaci
tlenku (SeO
2
) selen rozpuszcza się w kwasie
azotowym. Następnie przepuszcza się przez tak
otrzymany roztwór dwutlenek siarki. Wolny selen
wytrąca się jako czerwony osad (odmiana alotropowa
beta). Laboratoryjnie selen otrzymuje się redukując
hydrazyną kwas selenowy(VI) (H
2
SeO
4
).
Z punktu widzenia odżywiania bogatym źródłem
selenu jest pszenica, ryż brązowy, owies, pestki dyni,
a także drób.
Selen jest jednym z niezbędnych
Selen jest jednym z niezbędnych
ultraelementów, który musi być dostarczany w
ultraelementów, który musi być dostarczany w
pożywieniu. Zawartość selenu w produktach
pożywieniu. Zawartość selenu w produktach
spożywczych różni się znacznie, co związane jest z
spożywczych różni się znacznie, co związane jest z
dużymi różnicami w zawartości selenu w glebie i
dużymi różnicami w zawartości selenu w glebie i
wodzie w różnych częściach świata. Gleby na terenie
wodzie w różnych częściach świata. Gleby na terenie
Polski są uważane za ubogie w selen.
Polski są uważane za ubogie w selen.

32
32
Tellur
• Tellur w postaci krystalicznej jest srebrzystobiały i
kruchy. Reaguje ze stężonym kwasem
azotowym(V) tworząc kwas tellurowy(IV)
(tellurawy), w reakcji telluru z wodą królewską
powstaje kwas tellurowy(VI) (tellurowy). Ze
stężonym gorącym kwasem siarkowym(VI) tellur
reaguje tworząc roztwór o barwie czerwonej,
zawierający kationy tetratellurowe Te
42+
.
Zabarwienie wynika z obecności 6
zdelokalizowanych elektronów π w płaskiej,
kwadratowej strukturze kationów
tetratellurowych. Kationy te pod wpływem wody
hydrolizują z wydzieleniem czarnego osadu telluru.
• Te Tworzy tellurki Te
2-
, tellurany(IV) TeO
32-
i
tellurany(VI) TeO
42-
. Tellurowodór H
2
Te jest
nietrwałym, trującym gazem, o nieprzyjemnym
zapachu. Pył i pary telluru działają szkodliwie przy
ich wdychaniu, drażnią także oczy.
33
33
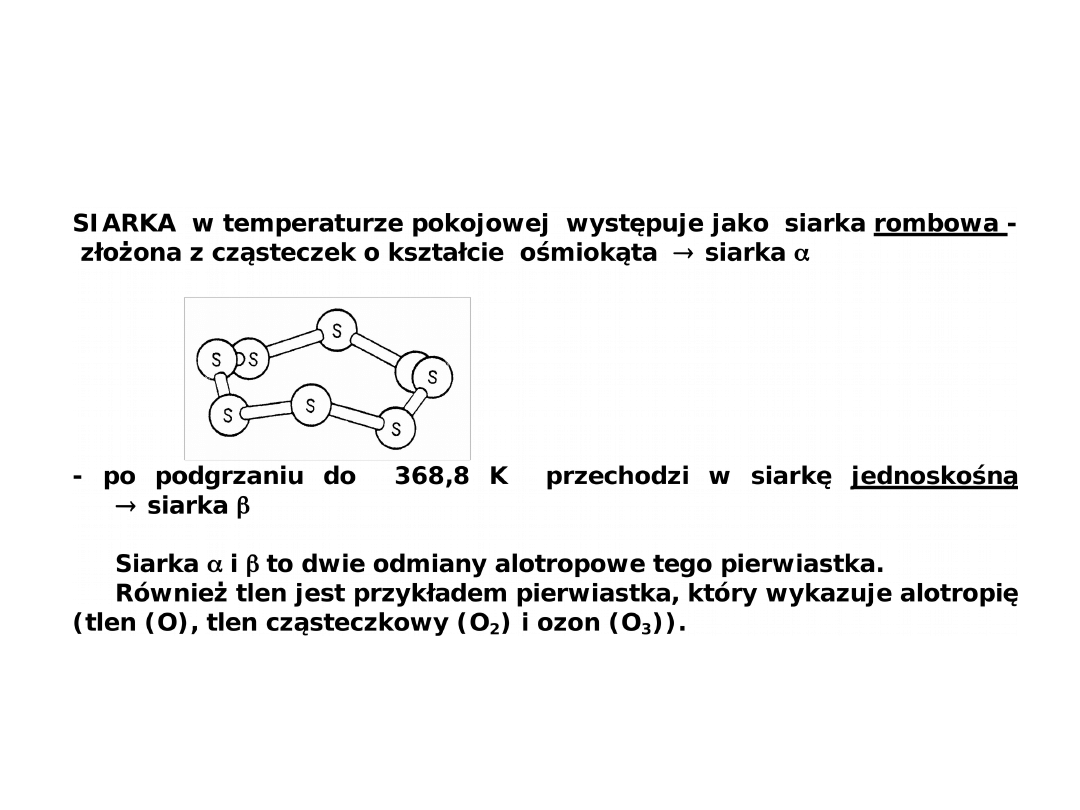
Struktura cząsteczek tlenu i siarki –
Alotropia
34
34
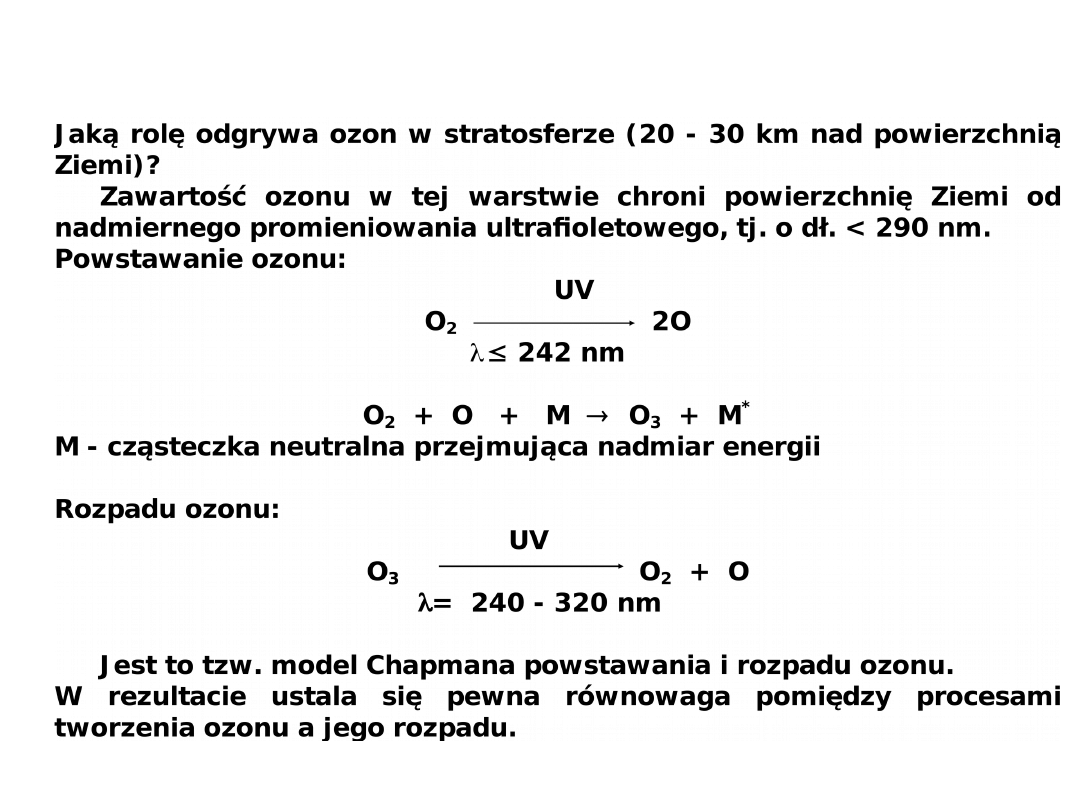
Ozon

35
35
Ozon
Ozon pochłania promieniowanie UV. Brak lub zmniejszenie zawartości
ozonu w stratosferze grozi poważnymi skutkami tak dla człowieka,
zwierząt, jak i roślin.
Dlaczego zawartość ozonu maleje?
Fluorowcopochodne metanu jak np. CCl
3
F, CCl
2
F
2
(freony) zmniejszają
zawartość ozonu:
CCl
3
F CCl
2
F + Cl
O
3
+ Cl ClO + O
2
Również tlenki azotu reagują z ozonem:
O
3
+ NO NO
2
+ O
2
36
36
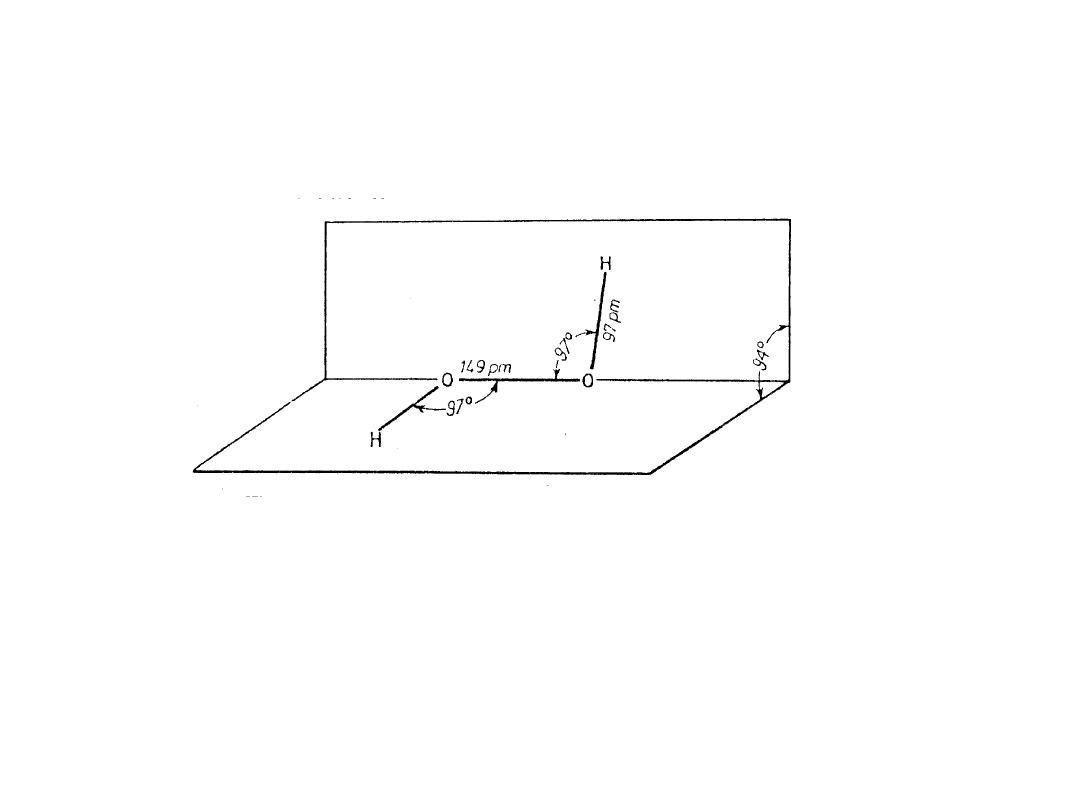
Związki tlenowców z wodorem -
wodorki

37
37
Związki tlenowców z wodorem -
wodorki
H
2(g)
+
1
/
2
O
2(g)
= H
2
O
(g)
H
o
= -286 kJ / mol
H
2(g)
+ S
(s)
= H
2
S
(g)
-21
H
2(g)
+ Se
(s)
= H
2
Se
(g)
+86
H
2(g)
+ Te
(s)
= H
2
Te
(g)
+154
H
2
O
H
2
S
H
2
Se
H
2
Te
wzrost trwałości
W roztworach wodnych wodorki są słabymi kwasami:
H
2
O
H
2
S
H
2
Se
H
2
Te
pK
a1
14,0
7,0
3,7
2,6
pK
a2
- 14,0 11,0 11,0
SOLE WODORKÓW
tlenki
siarczki selenki
tellurki
wzrost charakteru jonowego
38
38
Siarczki
Siarczki
Przykłady siarczków:
Ag
2
S
- siarczek srebra(I )
Me
2
I
S
Me
I
HS
MgS
- siarczek magnezu
Siarczki
wodoro-
Bi
2
S
3
- siarczek bizmutu(I I I )
siarczki
NaHS
- wodorosiarczek sodu
Ca(HS)
2
- wodorosiarczek wapnia
H
2
S H
+
+ HS
-
(K
a1
)
HS
-
H
+
+ S
2-
(K
a2
)
Silna hydroliza anionów siarczkowych:
S
2-
+ H
2
O = HS
-
+ OH
-
Większość siarczków jest bardzo trudno rozpuszczalna w wodzie,
np: PbS, HgS, CuS, ZnS
39
39
Nadtlenek wodoru
Powstaje z nadtlenków metali; np. z nadtlenku baru
BaO
2
+ H
2
SO
4
= BaSO
4
+ H
2
O
2
Roztwory wodne nadtlenku wodoru:
30% - perhydrol, 3% - woda utleniona

40
40
Nadtlenek wodoru
Nadtlenek wodoru jest nietrwały:
2H
2
O
2
= 2H
2
O + O
2
H
o
= +99 kJ / mol
Dodatek rozdrobnionej Pt, Ag, MnO
2
oraz matowana powierzchnia
przyspieszają rozkład H
2
O
2
.
Wykazuje słabe właściwości kwasowe:
H
2
O
2
+ H
2
O = H
3
O
+
+ HO
2
-
K
a
= 1,5 10
-12
H
2
O
2
jest silnym środkiem utleniającym:
H
2
O
2
+ 2H
+
+ 2e
2H
2
O
E
o
= +1,77 V
np:
2[Cr(OH)
4
]
-
+ 3H
2
O
2
+ 2OH
-
= 2CrO
4
2-
+ 8H
2
O
H
2
O
2
może również wykazywać właściwości redukujące:
H
2
O
2
2H
+
+ O
2
+ 2e
E
0
= +0,695 V
np:
2MnO
4
-
+ 6H
+
+ 5H
2
O
2
= 2Mn
2+
+ 8H
2
O + 5O
2
41
41
Połączenia z tlenem
a) SO
2
- ditlenek siarki (dwutlenek siarki)
Metody otrzymywania:
1
o
S + O
2
= SO
2
2
o
2FeS
2
+ 11/ 2O
2
= Fe
2
O
3
+ 4SO
2
3
o
2CaSO
4
+ C = 2CaO + 2SO
2
+ CO
2
4
o
HSO
3
-
+ H
+
= SO
2
+ H
2
O
5
o
Cu + SO
4
2-
+ 4H
+
= Cu
2+
+ SO
2
+ 2H
2
O
1
o
- 3
o
Metody przemysłowe
4
o
– 5
o
Metody laboratoryjne
stopień
utlenienia
+2
+4
+6
Siarka
Selen
Tellur
SO
-
TeO
SO
2
SeO
2
TeO
2
SO
3
SeO
3
TeO
3
42
42
b) SO
3
- tritlenek siarki (trójtlenek siarki)
2SO
2(g)
+ O
2(g)
= 2SO
3(g)
H
o
= -96 kJ / mol
Od jakich czynników zależy wydajność i szybkość tej reakcji ?
Szybkość
Wydajność
1. Temperatura
+
-
2. Ciśnienie
+
+
3. Nadmiar
substratu (tlenu)
+
+
4. Katalizator
+
0
Optymalne warunki syntezy SO
3
:
- optymalna temperatura (650-850 K),
- wysokie ciśnienie,
- nadmiar jednego z substratów, np. tlenu,
- obecność katalizatora (Pt, V
2
O
5
).
Metoda laboratoryjna otrzymywania SO
3
to rozkład termiczny
disiarczanu potasu: K
2
S
2
O
7
= K
2
SO
4
+ SO
3

43
43
Kwaśny deszcz
Główną przyczyną kwaśnego deszczu (pH 5,5) jest dwutlenek siarki
SO
2
+ H
2
O = H
2
SO
3
H
2
SO
3
= H
+
+ HSO
3
-
pK
a1
= 1,62
Naturalny deszcz ma pH 5,6
pK
a1
= 6,35
35
,
6
pKa
HCO
H
CO
H
CO
H
O
H
CO
1
3
3
2
3
2
2
2

44
44
Tlenowe kwasy siarki
Znanych jest 10 tlenowych kwasów siarki. Ale tylko niektóre są znane w
stanie czystym. Najważniejsze to :
H
2
O + SO
2
= H
2
SO
3
kwas siarkawy
= kwas siarkowy(I V)
H
2
O + SO
3
= H
2
SO
4
kwas siarkowy
= kwas siarkowy(VI )
H
2
SO
4
+ SO
3
= H
2
S
2
O
7
kwas dwusiarkowy
(H
2
S) + (SO
3
) = (H
2
S
2
O
3
)
kwas tiosiarkowy
(H
2
O
2
) + (SO
3
) = (H
2
SO
5
)
kwas nadtlenojednosiarkowy
kwas peroksosiarkowy
(H
2
SO
5
) + (SO
3
) = (H
2
S
2
O
8
) kwas nadtlenodwusiarkowy
kwas peroksodwusiarkowy
Uwaga:
Reakcje z udziałem reagentów podane w nawiasach nie
zachodzą! Pokazano w ten sposób jedynie "pochodzenie"
tych kwasów.
Uwaga:
Reakcje z udziałem reagentów podane w nawiasach nie
zachodzą! Pokazano w ten sposób jedynie "pochodzenie"
tych kwasów.
45
45
Tlenowe kwasy siarki
H
H
2
2
S
S
2
2
O
O
3
3
nie istnieje, a jedynie jego sole.
nie istnieje, a jedynie jego sole.
Stopnie utlenienia siarki w tych kwasach:
Stopnie utlenienia siarki w tych kwasach:
H
H
2
2
SO
SO
3
3
+ 4 st. utlenienia
+ 4 st. utlenienia
H
H
2
2
S
S
2
2
O
O
3
3
+ 2 st. utlenienia (formalny) - faktyczne - 2 i +6
+ 2 st. utlenienia (formalny) - faktyczne - 2 i +6
Pozostałe kwasy: +6 st. utlenienia
Pozostałe kwasy: +6 st. utlenienia
H
H
2
2
S
S
2
2
O
O
3
3
nie istnieje, a jedynie jego sole.
nie istnieje, a jedynie jego sole.
Stopnie utlenienia siarki w tych kwasach:
Stopnie utlenienia siarki w tych kwasach:
H
H
2
2
SO
SO
3
3
+ 4 st. utlenienia
+ 4 st. utlenienia
H
H
2
2
S
S
2
2
O
O
3
3
+ 2 st. utlenienia (formalny) - faktyczne - 2 i +6
+ 2 st. utlenienia (formalny) - faktyczne - 2 i +6
Pozostałe kwasy: +6 st. utlenienia
Pozostałe kwasy: +6 st. utlenienia
Wzory elektronowe wybranych kwasów tlenowych siarki
H
2
SO
3
O
H - O - S - O - H
H
2
SO
4
H - O - S - O - H
O
O

46
46
Kwas siarkowy
H
2
SO
4
to bardzo mocny kwas (ze względu na pierwszy stopień
dysocjacji):
H
2
SO
4
H
+
+ HSO
4
-
Średnio mocny ze względu na drugi stopień dysocjacji:
HSO
4
-
H
+
+ SO
4
2-
pK
a2
= 1,99
J akie są stopnie dysocjacji kwasu siarkowego?
Dla 1 M H
2
SO
4
1
100 % ,
2
= 1 %
Stężony H
2
SO
4
d = 1,84 kg/ dm
3
96-98% H
2
SO
4
Rozcieńczanie kwasu (kwasów)
reakcja silnie egzotermiczna
wydziela się duża ilość ciepła

47
47
Otrzymywanie kwasu
siarkowego
1) Otrzymywanie SO
2
z siarczków, siarki lub siarczanu wapnia
2) Utlenianie SO
2
do SO
3
3) Oczyszczanie SO
3
od pyłów (elektrofiltry)
4) Rozpuszczanie w stężonym H
2
SO
4
H
2
SO
4
+ SO
3
= H
2
S
2
O
7
(OLEUM)
5) Rozcieńczanie oleum wodą
H
2
S
2
O
7
+ H
2
O = 2H
2
SO
4
48
48
Sole tlenowych kwasów siarki
Me
2
I
SO
3
siarczyny (obojętne) = siarczany(I V)
H
2
SO
3
Me
I
HSO
3
wodorosiarczyny (kwaśne siarczyny)
Me
2
I
SO
4
siarczany = siarczany(VI )
H
2
SO
4
Me
I
HSO
4
wodorosiarczany (kwaśne siarczany)
H
2
S
2
O
3
Me
2
I
S
2
O
3
tiosiarczany
H
2
S
2
O
8
Me
2
I
S
2
O
8
nadtlenodwusiarczany
49
49
Tlenowe kwasy siarki
H
2
S
2
O
3
O
H - O - S - O - H
S
H
2
S
2
O
7
O O
H - O - S - O - S - O - H
O O
H
2
SO
5
O
H - O - O - S - O - H
O
H
2
S
2
O
8
O O
H - O - S - O - O - S - O - H
O O

50
50
Tlenowe połączenia selenu i
telluru
a) Tlenki
+4 st. utlenienia:
SeO
2
, TeO
2
- właściwości amfoteryczne z przewagą kwasowych
+6 st. utlenienia:
SeO
3
, TeO
3
- właściwości kwasowe
b) Kwasy
+4 st. utlenienia:
H
2
SeO
3
- kwas selenawy (selenowy(I V))
SeO
2
+ H
2
O = H
2
SeO
3
M
2
I
SeO
3
- obojętne seleniny
M
I
HSeO
3
-
wodoroseleniny
H
2
TeO
3
- kwas tellurowy znany jest tylko w postaci soli, tj.
tellurynów, np. Na
2
TeO
3
+6 st. utlenienia:
H
2
SeO
4
- kwas selenowy
H
2
Se
2
O
7
- kwas dwuselenowy
H
6
TeO
6
- kwas ortotellurowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
Wyszukiwarka
Podobne podstrony:
Leszek wyklad11 metale
Leszek wyklad4 elektrochemia
Leszek wyklad9 teoria pasmowa ciala stalego
Leszek wyklad8a chlorowce
Leszek wyklad2
Leszek wyklad7
Leszek wyklad3
Leszek wyklad4
Leszek wyklad3
Leszek wyklad2
Leszek wyklad5
Leszek wyklad1
Leszek wyklad10 zwiazki kompleksowe
Leszek wyklad6
Leszek wyklad12 grupy dlowne
Leszek wyklad1
Leszek wyklad11 metale
więcej podobnych podstron