
1
1
SPRAWY ORGANIZACYJNE
• 1) Wykład: Podstawy Chemii Nieorganicznej
• 2 godz./tydzień - 30 godz./semestr
• Prowadzący wykład: prof. Wiesław Apostoluk,
prof. Piotr Drożdżewski i dr hab. Leszek Rycerz
prof. PWr
•
• kod kursu: CHC0120w
• 2) Warunki zaliczenia kursu CHC0120w:
• W czasie sesji egzaminacyjnej odbędą się:
• 2 egzaminy pisemne obejmujące wyłożoną teorię i
od 1 do 2 zadań.
• Studenci powinni znać i rozumieć cały układ
okresowy pierwiastków!

2
2
SPRAWY ORGANIZACYJNE
• P O D R Ę C Z N I K I
• 1) Literatura podstawowa do kursu „Podstawy Chemia
Nieorganicznej”- wykład
• A. Bielański, Podstawy chemii nieorganicznej, PWN,
Warszawa, 2004 (2002, 1998, 1994).
• 2) Literatura uzupełniająca do kursu ”Podstawy
Chemii Nieorganicznej”- wykład
• P. Mastalerz, Elementarna chemia nieorganiczna,
Wyd. Chemiczne, Wrocław, 1997.
• I. Barycka, K. Skudlarski, Podstawy chemii, Wyd. Pol.
Wrocławskiej, Wrocław, 2001.
• P.A. Cox, Chemia nieorganiczna – krótkie wykłady,
Wyd. Naukowe PWN, Warszawa, 2003.
• F.A. Cotton, G. Wilkinson, P.L. Gaus, Chemia
nieorganiczna – podstawy, Wyd. Naukowe PWN,
Warszawa, 1995.
• J.E. Brady, General Chemistry, Principles and
Structure, John Wiley & Sons, New York, 1990.

3
3
Materiały internetowe
wykorzystane do
przygotowania wykładu
• The Chemistry of Acids and Bases -
http://www.mccsc.edu/~nrapp/chemis
trypowerpoint/Student%20Ch%2017%20
• Chemistry, The Central Science, 10th
edition
Theodore L. Brown; H. Eugene LeMay,
Jr.; and Bruce E. Bursten (
Chapter 16 Acids
and Bases,
John D.Bookstaver, St. Charles Community College,
St. Peters, MO, 2006, Prentice Hall, Inc.)

4
4
Kwasy/Zasady - definicje
•
Arrhenius
Kwasy – substancje powodujące
zwiększenie stężenia jonów H
+
(jonów hydroniowych H
3
O
+
)
Zasady – substancje produkujące
jony OH
-
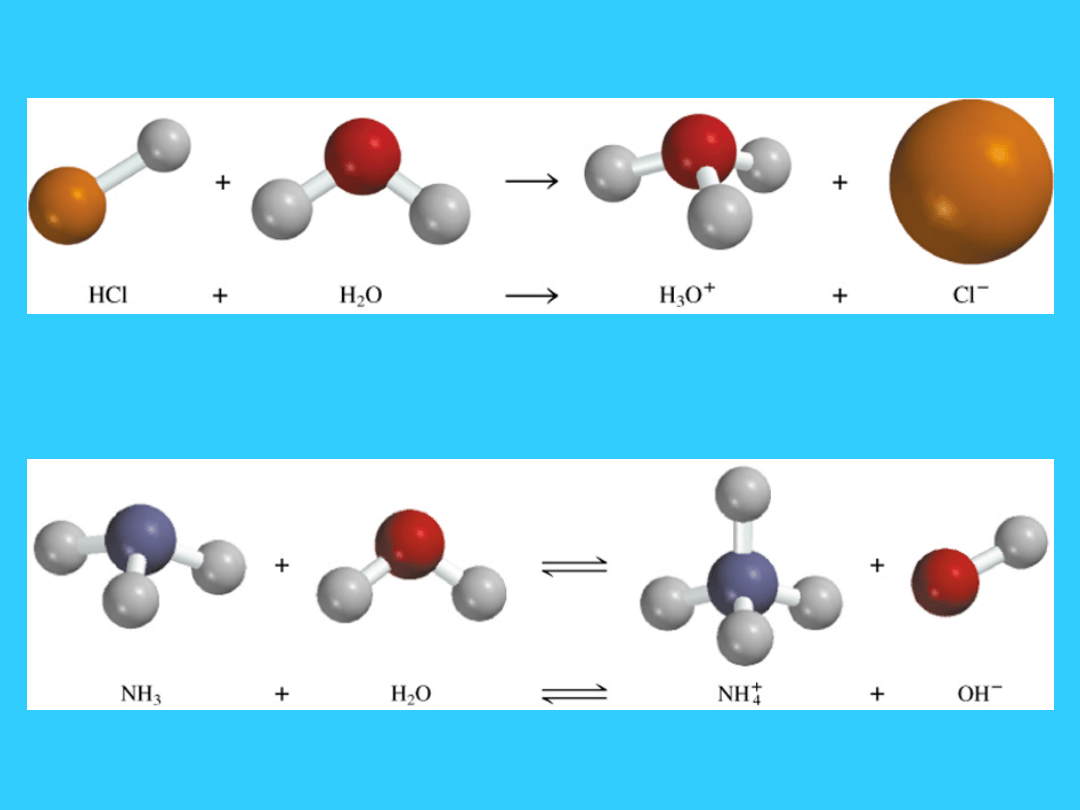
5
5
Kwas Arrheniusa dysocjuje z utworzeniem jonów H
+
(H
3
O
+
)
Zasada Arrheniusa dysocjuje z utworzeniem jonów OH
-
6
6
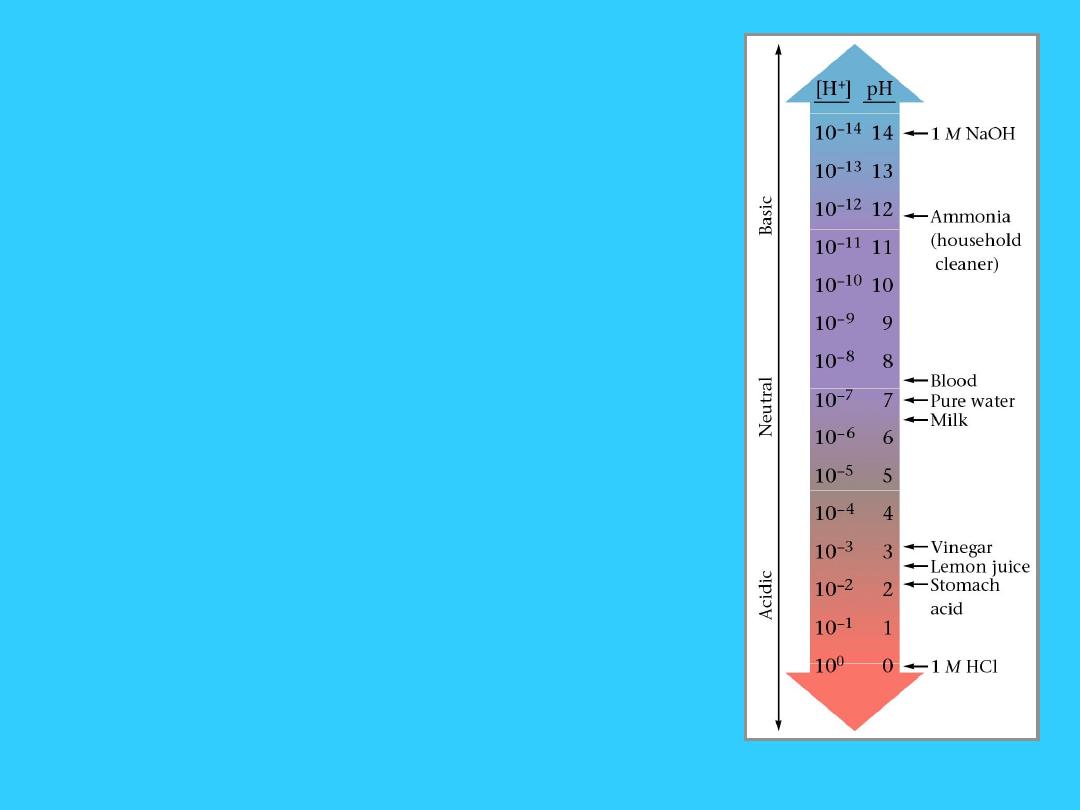
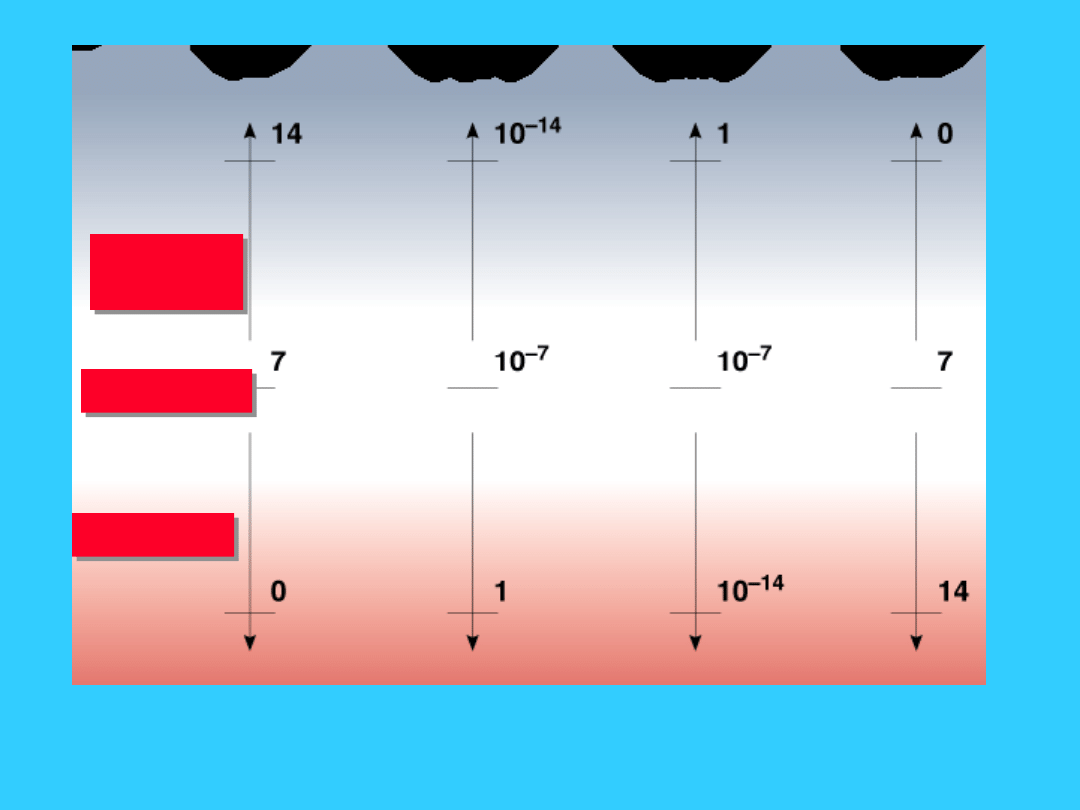
Skala pH - sposób
Skala pH - sposób
wyrażania mocy
wyrażania mocy
kwasów i zasad.
kwasów i zasad.
Zamiast używania
Zamiast używania
bardzo małych liczb
bardzo małych liczb
podajemy ujemną
podajemy ujemną
wartość logarytmu
wartość logarytmu
dziesiętnego ze
dziesiętnego ze
stężenia molowego
stężenia molowego
jonów H
jonów H
+
+
(lub OH
(lub OH
-
-
).
).
pH poniżej 7 =
pH poniżej 7 =
kwas
kwas
7 = r-r
7 = r-r
obojętny
obojętny
pH powyżej 7 =
pH powyżej 7 =
zasada
zasada
7
7
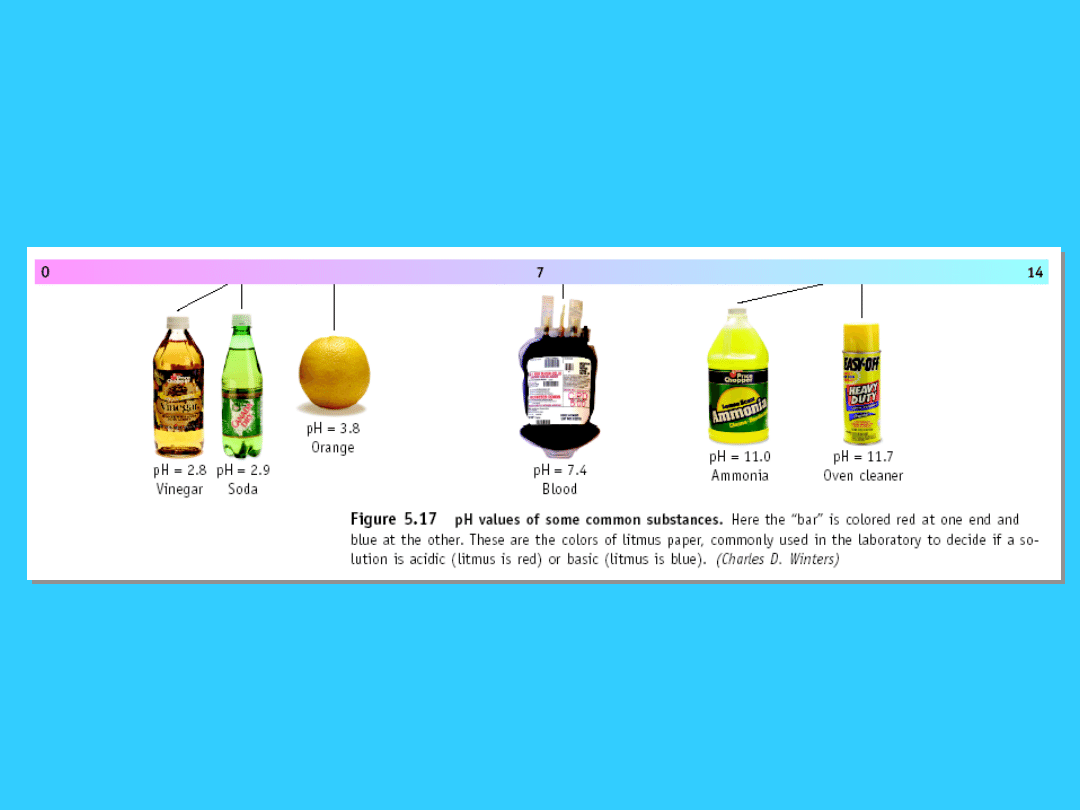
pH popularnych
pH popularnych
substancji
substancji

8
8
obliczenia pH
pH = - log [H+]
(Uwaga [ ] oznacza stężenie molowe)
Przykład: Jeżeli [H
+
] = 1 * 10
-10
pH = - log 1 * 10
-10
pH = - (- 10)
pH = 10
Przykład: Jeżeli [H
+
] = 1.8 * 10
-5
pH = - log 1.8 * 10
-5
pH = - (- 4.74)
pH = 4.74

9
9
Obliczenia pH –
Obliczenia pH –
znajdowanie stężenia jonów
znajdowanie stężenia jonów
H+
H+
Obliczenia pH –
Obliczenia pH –
znajdowanie stężenia jonów
znajdowanie stężenia jonów
H+
H+
pH Coli wynosi 3.12, jakie jest stężenie jonów
pH Coli wynosi 3.12, jakie jest stężenie jonów
[H
[H
+
+
] ???
] ???
ponieważ pH = - log [H
ponieważ pH = - log [H
+
+
] więc
] więc
- pH = log [H
- pH = log [H
+
+
]
]
antilog (10
antilog (10
x
x
) obydwu stron daje
) obydwu stron daje
10
10
-pH
-pH
=
=
[H
[H
+
+
]
]
[H
[H
+
+
] = 10
] = 10
-3.12
-3.12
= 7.6 x 10
= 7.6 x 10
-4
-4
M
M

10
10
Obliczenia pH – znajdowanie
Obliczenia pH – znajdowanie
stężenia jonów H+
stężenia jonów H+
•
Roztwór ma pH = 8.5. Jakie jest
Roztwór ma pH = 8.5. Jakie jest
stężenie molowe jonów H
stężenie molowe jonów H
+
+
?
?
pH = - log [H
pH = - log [H
+
+
]
]
8.5 = - log [H
8.5 = - log [H
+
+
]
]
-8.5 = log [H
-8.5 = log [H
+
+
]
]
Antylog -8.5 = antylog (log
Antylog -8.5 = antylog (log
[H
[H
+
+
])
])
10
10
-8.5
-8.5
= [H
= [H
+
+
]
]
3.16 X 10
3.16 X 10
-9
-9
= [H
= [H
+
+
]
]
pH = - log [H
pH = - log [H
+
+
]
]
8.5 = - log [H
8.5 = - log [H
+
+
]
]
-8.5 = log [H
-8.5 = log [H
+
+
]
]
Antylog -8.5 = antylog (log
Antylog -8.5 = antylog (log
[H
[H
+
+
])
])
10
10
-8.5
-8.5
= [H
= [H
+
+
]
]
3.16 X 10
3.16 X 10
-9
-9
= [H
= [H
+
+
]
]
11
11
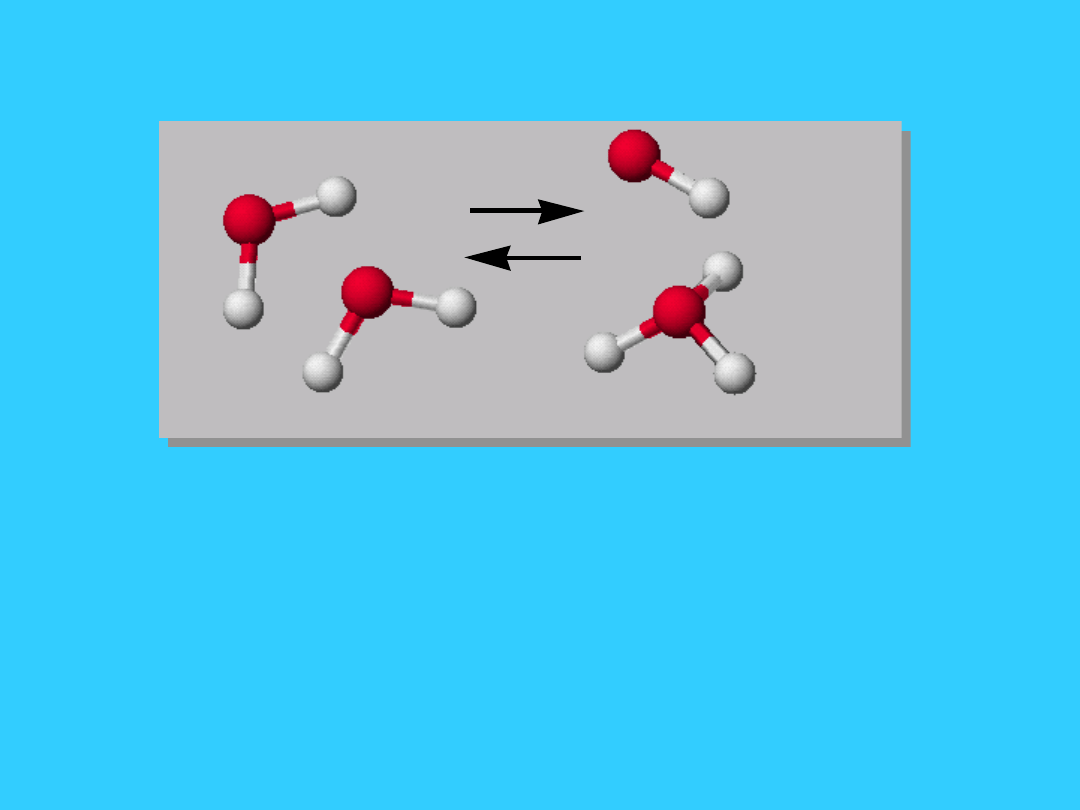
Woda jako
rozpuszczalnik
Woda jako
rozpuszczalnik
K
K
w
w
= [H
= [H
3
3
O
O
+
+
] [OH
] [OH
-
-
] = 1.00 x 10
] = 1.00 x 10
-14
-14
at 25
at 25
o
o
C
C
w roztworze obojętnym [H
w roztworze obojętnym [H
3
3
O
O
+
+
] = [OH
] = [OH
-
-
]
]
więc K
więc K
w
w
= [H
= [H
3
3
O
O
+
+
]
]
2
2
= [OH
= [OH
-
-
]
]
2
2
czyli [H
czyli [H
3
3
O
O
+
+
] = [OH
] = [OH
-
-
] = 1.00 x 10
] = 1.00 x 10
-7
-7
M
M
OH
-
H
3
O
+
OH
-
H
3
O
+
Autojonizacja
Autojonizacja

12
12
pOH
pOH = - log [OH
pOH = - log [OH
-
-
]
]
pH + pOH = pK
pH + pOH = pK
w
w
pH + pOH = 14
pH + pOH = 14
13
13
pH
pH
[H
+
]
[H
+
]
[OH
-
]
[OH
-
]
pOH
pOH
zasadow
e
zasadow
e
obojętne
obojętne
kwaśne
kwaśne

14
14
[H
[H
3
3
O
O
+
+
], [OH
], [OH
-
-
] i pH
] i pH
Jakie jest pH 0.0010 M r-ru NaOH?
Jakie jest pH 0.0010 M r-ru NaOH?
[OH-] = 0.0010 ( 1.0 * 10
[OH-] = 0.0010 ( 1.0 * 10
-3
-3
M)
M)
pOH = - log 0.0010
pOH = - log 0.0010
pOH = 3
pOH = 3
pH = 14 – 3 = 11
pH = 14 – 3 = 11
lub K
lub K
w
w
= [H
= [H
3
3
O
O
+
+
] [OH
] [OH
-
-
]
]
[H
[H
3
O
O
+
+
] = 1.0 * 10
] = 1.0 * 10
-11
-11
M
M
pH = - log (1.0 x 10
pH = - log (1.0 x 10
-11
-11
) = 11.00
) = 11.00

15
15
[OH
[OH
-
-
]
]
[H
[H
+
+
]
]
pOH
pOH
pH
pH
10
10
-p
O
H
-p
O
H
10
10
-p
H
-p
H
-Lo
g[H
-Lo
g[H
+
+
]
]
-
Lo
g[O
H
Lo
g[O
H
-
-
]
]
14
-
pO
H
14
-
pO
H
14
-
pH
14
-
pH
1.
0
x
10
1.
0
x
10
-1
4
-1
4
[O
H
[O
H
-
-
]
]
1.
0
x
10
1.
0
x
10
-1
4
-1
4
[H
[H
+
+
]
]

16
16
Obliczenia [H
3
O
+
], pH, [OH
-
] i pOH
Oblicz [H
3
O
+
], [OH
-
] i pOH roztworu o
pH = 3.67? Czy jest to roztwór kwaśny,
zasadowy czy obojętny?
17
17
Silne kwasy: HNO
3
, HCl, HI, HBr,
H
2
SO
4
, HClO
3
, HClO
4
.
.
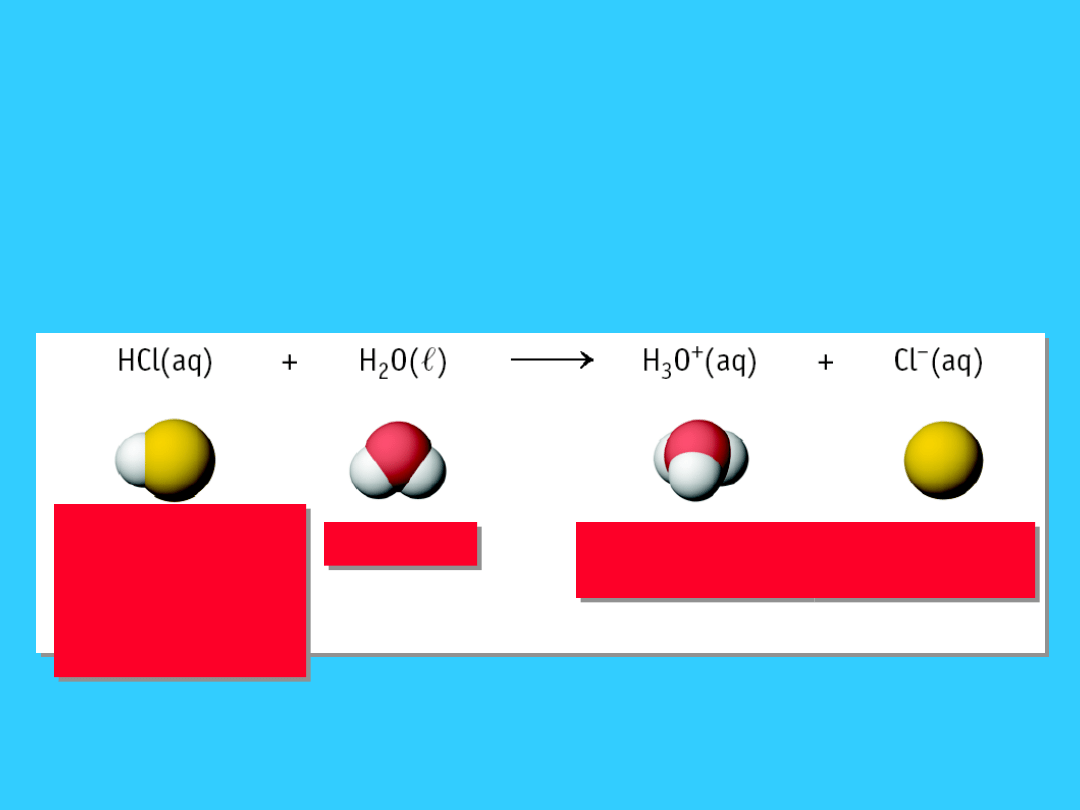
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady
Moc kwasu (zasady) jest
określona stopniem dysocjacji.
Moc kwasu (zasady) jest
określona stopniem dysocjacji.
Kwas solny -
mocny
elektrolit,
stopień
dysocjacji = 1
Kwas solny -
mocny
elektrolit,
stopień
dysocjacji = 1
woda
woda
Jon
hydroniowy
Jon
hydroniowy
Jon
chlorkowy
Jon
chlorkowy
18
18
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady
•
Ogólny podział na kwasy silne i słabe.
Ogólny podział na kwasy silne i słabe.
Silny kwas:
Silny kwas:
HNO
HNO
3
3
(aq) + H
(aq) + H
2
2
O (l) --->
O (l) --->
H
H
3
3
O
O
+
+
(aq) + NO
(aq) + NO
3
3
-
-
(aq)
(aq)
HNO
HNO
3
3
praktycznie ulega w 100% dysocjacji
praktycznie ulega w 100% dysocjacji
w wodzie.
w wodzie.
19
19
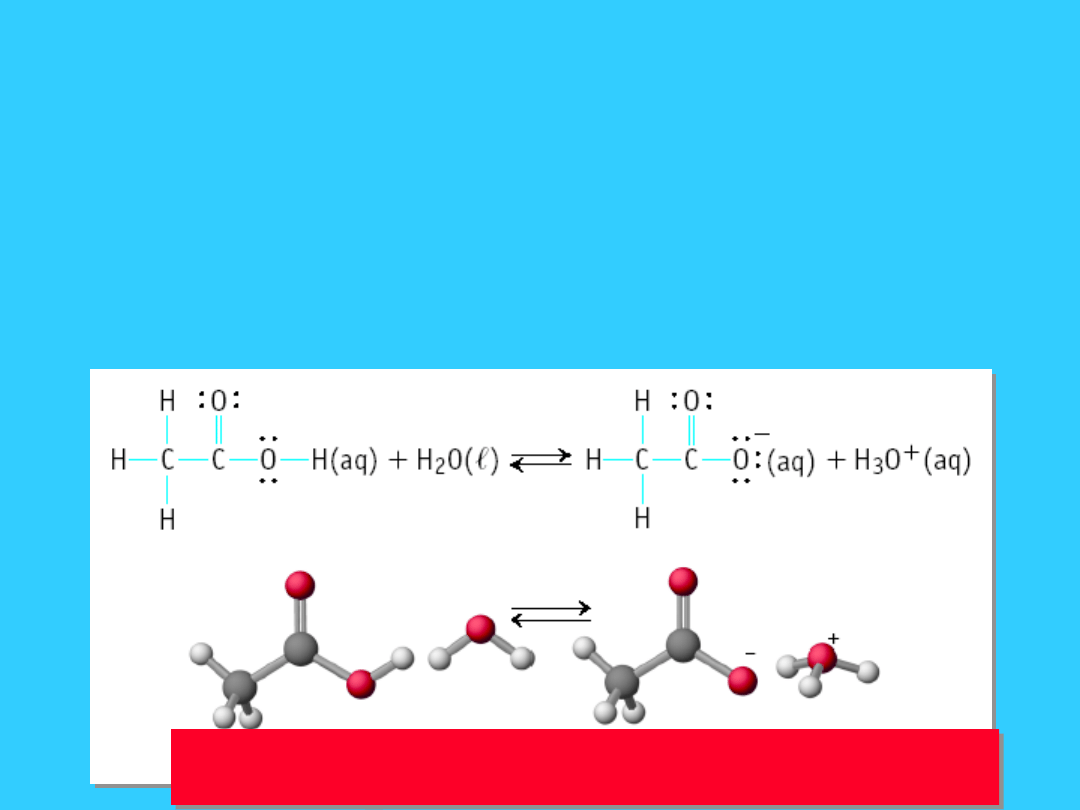
•
Słabe kwasy
Słabe kwasy
w nieznacznym stopniu
w nieznacznym stopniu
ulegają dysocjacji w wodzie.
ulegają dysocjacji w wodzie.
Przykładem najbardziej znanym jest kwas
Przykładem najbardziej znanym jest kwas
octowy CH
octowy CH
3
3
COOH
COOH
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady
kwas
octowy
kwas
octowy
woda jon octanowy jon
hydroniowy
woda jon octanowy jon
hydroniowy

20
20
•
Silna zasada
Silna zasada
:
:
w 100% ulega
w 100% ulega
dysocjacji w wodzie.
dysocjacji w wodzie.
NaOH (aq) ---> Na
NaOH (aq) ---> Na
+
+
(aq) + OH
(aq) + OH
-
-
(aq)
(aq)
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady
Silne zasady to KOH i
Silne zasady to KOH i
Ca(OH)
Ca(OH)
2
2
, Ba(OH)
, Ba(OH)
2
2
,
,
Sr(OH)2
Sr(OH)2
CaO + H
CaO + H
2
2
O
O
-->Ca(OH)
-->Ca(OH)
2
2
CaO
CaO

21
21
•
Słaba zasada
Słaba zasada
:
:
w nieznacznym
w nieznacznym
stopniu ulega dysocjacji w r-
stopniu ulega dysocjacji w r-
rze wodnym
rze wodnym
NH
NH
3
3
(aq) + H
(aq) + H
2
2
O (l) =
O (l) =
NH
NH
4
4
+
+
(aq) + OH
(aq) + OH
-
-
(aq)
(aq)
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady
Silne i słabe kwasy/zasady

22
22
Równowagi w roztworach
Równowagi w roztworach
słabych kwasów i zasad
słabych kwasów i zasad
CH
CH
3
3
COOH + H
COOH + H
2
2
O
O
=
=
H
H
3
3
O
O
+
+
+ CH
+ CH
3
3
COO
COO
-
-
[H
3
O
+
] [A
−
]
[HA]
K
a
=
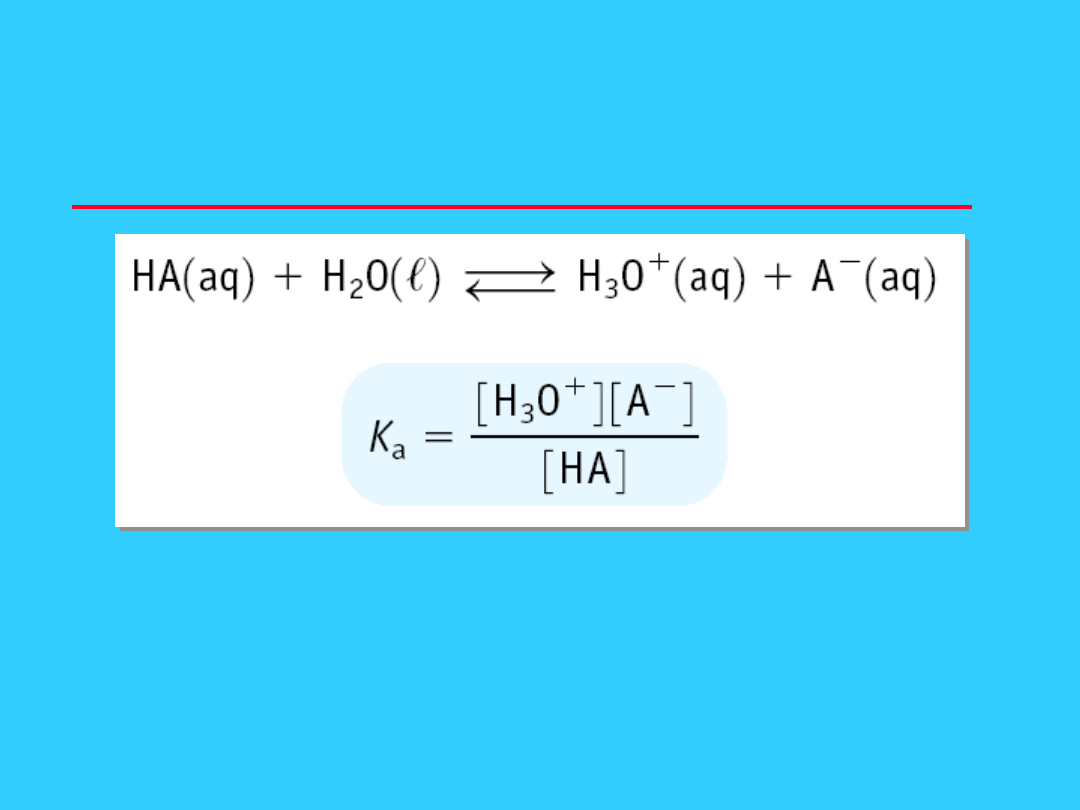
23
23
Rownowaga w r-rze
Rownowaga w r-rze
słabego kwasu
słabego kwasu
Rownowaga w r-rze
Rownowaga w r-rze
słabego kwasu
słabego kwasu
K
K
a
a
< 1
< 1
co prowadzi do małych stężęń [H
co prowadzi do małych stężęń [H
3
3
O
O
+
+
]
]
i pH w granicach 2 - 7
i pH w granicach 2 - 7
24
24
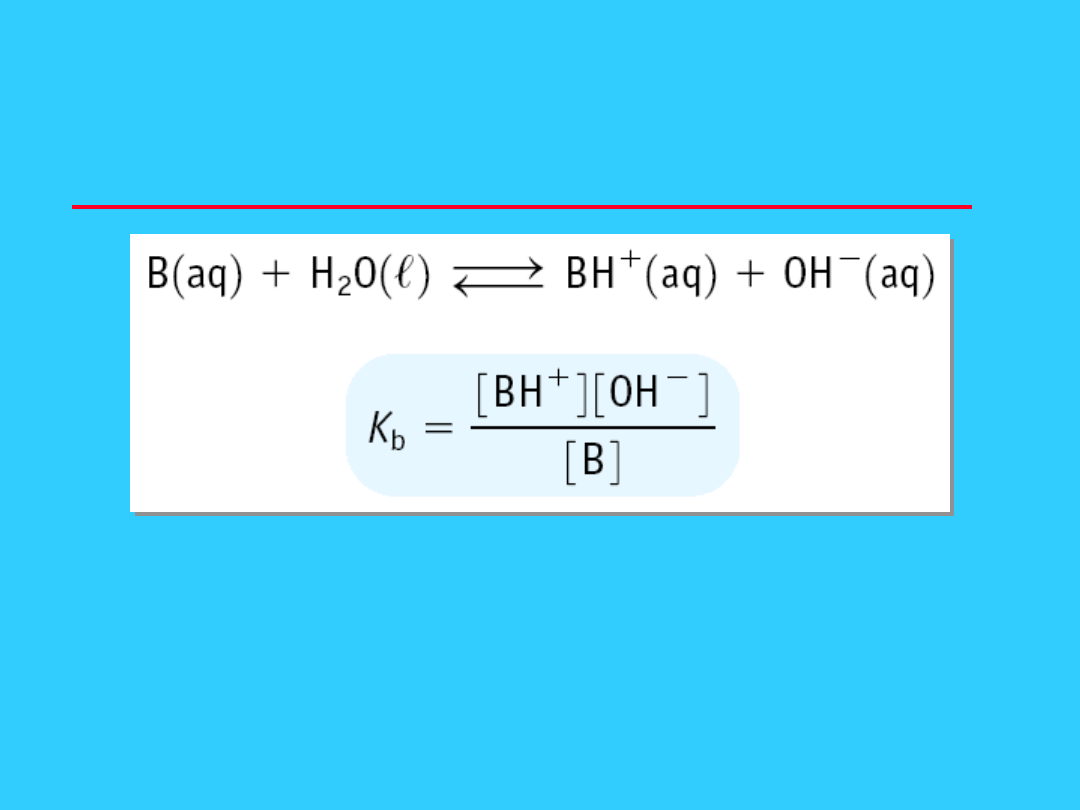
Rownowaga w r-rze słabej
Rownowaga w r-rze słabej
zasady
zasady
Rownowaga w r-rze słabej
Rownowaga w r-rze słabej
zasady
zasady
K
K
b
b
< 1
< 1
co prowadzi do małych stężeń [OH
co prowadzi do małych stężeń [OH
-
-
]
]
i pH w granicach 12 - 7
i pH w granicach 12 - 7
25
25
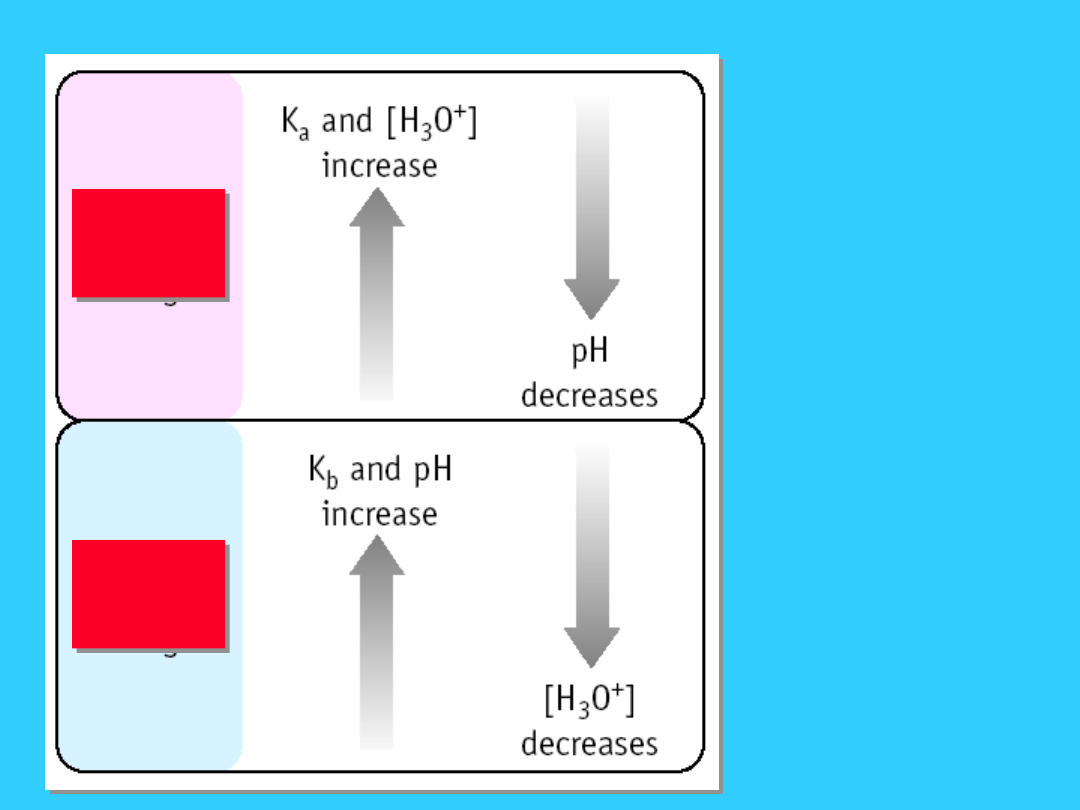
Relacje
Relacje
pomiędz
pomiędz
y K
y K
a
a
, K
, K
b
b
,
,
[H
[H
3
3
O
O
+
+
] i
] i
pH
pH
Wzrost
mocy
kwasu
Wzrost
mocy
kwasu
Wzrost
mocy
zasady
Wzrost
mocy
zasady

26
26
Równowaga w r-rze słabego
Równowaga w r-rze słabego
kwasu
kwasu
Równowaga w r-rze słabego
Równowaga w r-rze słabego
kwasu
kwasu
Mamy 1.00 M r-r kwasu octowego.
Mamy 1.00 M r-r kwasu octowego.
Oblicz równowagowe sężenia
Oblicz równowagowe sężenia
CH
CH
3
3
COOH, H
COOH, H
3
3
O
O
+
+
, CH
, CH
3
3
COO
COO
-
-
i pH.
i pH.
Krok 1.
Krok 1.
.
.
Definiujemy stężęnia
Definiujemy stężęnia
poszczególnych form
poszczególnych form
[CH
[CH
3
3
COOH]
COOH]
[H
[H
3
3
O
O
+
+
]
]
[CH
[CH
3
3
COO
COO
-
-
]
]
pocz.
pocz.
zmiana
zmiana
równ.
równ.
1.00
1.00
0
0
0
0
1.00
1.00
0
0
0
0
-x
-x
+x
+x
+x
+x
-x
-x
+x
+x
+x
+x
1.00-x
1.00-x
x
x
x
x
1.00-x
1.00-x
x
x
x
x

27
27
Równowaga w r-rze słabego
Równowaga w r-rze słabego
kwasu
kwasu
Równowaga w r-rze słabego
Równowaga w r-rze słabego
kwasu
kwasu
Krok 2.
Krok 2.
Piszemy wyrażenie na K
Piszemy wyrażenie na K
a
a
Mamy 1.00 M r-r kwasu octowego.
Mamy 1.00 M r-r kwasu octowego.
Oblicz równowagowe sężenia
Oblicz równowagowe sężenia
CH
CH
3
3
COOH, H
COOH, H
3
3
O
O
+
+
, CH
, CH
3
3
COO
COO
-
-
i pH.
i pH.
K
a
1.8 x 10
-5
=
[H
3
O
+
][OAc
-
]
[HOAc]
x
2
1.00 - x
K
a
1.8 x 10
-5
=
[H
3
O
+
][OAc
-
]
[HOAc]
x
2
1.00 - x

28
28
Równowaga w r-rze słabego
Równowaga w r-rze słabego
kwasu
kwasu
Równowaga w r-rze słabego
Równowaga w r-rze słabego
kwasu
kwasu
Krok 3.
Krok 3.
Rozwiązujemy równanie na
Rozwiązujemy równanie na
K
K
a
a
K
a
1.8 x 10
-5
=
[H
3
O
+
][OAc
-
]
[HOAc]
x
2
1.00 - x
K
a
1.8 x 10
-5
=
[H
3
O
+
][OAc
-
]
[HOAc]
x
2
1.00 - x
Zakładamy że x jest bardzo
Zakładamy że x jest bardzo
małe ponieważ K
małe ponieważ K
a
a
jest również
jest również
małe.
małe.
K
a
1.8 x 10
-5
=
x
2
1.00
K
a
1.8 x 10
-5
=
x
2
1.00

29
29
Równowaga w r-rze słabego
Równowaga w r-rze słabego
kwasu
kwasu
Równowaga w r-rze słabego
Równowaga w r-rze słabego
kwasu
kwasu
Krok 3a.
Krok 3a.
Rozwiązanie przybliżonego
Rozwiązanie przybliżonego
równania na K
równania na K
a
a
K
a
1.8 x 10
-5
=
x
2
1.00
K
a
1.8 x 10
-5
=
x
2
1.00
x =
x = [
[
H
H
3
3
O
O
+
+
] = [
] = [
OAc
OAc
-
-
] = 4.2 x 10
] = 4.2 x 10
-3
-3
M
M
pH = - log [
pH = - log [
H
H
3
3
O
O
+
+
] = -log (4.2 x 10
] = -log (4.2 x 10
-3
-3
)
)
=
= 2.37
2.37

30
30
Obliczanie K
a
z danych pH
• pH 0.10 M roztworu kwasu mrówkowego
HCOOH w temperaturze 25°C wynosi 2.38.
Obliczyć K
a
kwasu mrówkowego.
• Do obliczenia K
a
potrzebujemy steżenia
równowagowe.
• Z wartości pH obliczamy [H
3
O
+
], które jest takie
samo jak [HCOO
−
].
[H
3
O
+
] [COO
−
]
[HCOOH]
K
a
=

31
31
Obliczanie K
a
z danych pH
pH = −log [H
3
O
+
]
2.38 = −log [H
3
O
+
]
−2.38 = log [H
3
O
+
]
10
−2.38
= 10
log [H3O+]
= [H
3
O
+
]
4.2 10
−3
= [H
3
O
+
] = [HCOO
−
]

32
32
Obliczanie K
a
z danych pH
Teraz tworzymy tabelę…
4.2 10
−3
4.2 10
−3
0.10 − 4.2 10
−3
= 0.0958 = 0.10
równowago
we
+4.2 10
−3
+4.2 10
-3
−4.2 10
-3
zmiana
0
0
0.10
początkowe
[HCOO
−
], M
[H
3
O
+
], M
[HCOOH], M

33
33
Obliczanie K
a
z danych pH
[4.2 10
−3
] [4.2 10
−3
]
[0.10]
K
a
=
= 1.8 10
−4

34
34
Obliczanie stopnia
dysocjacji
• Stopień dysocjacji =
100%
• w tym przykładzie
[H
3
O
+
]
eq
= 4.2 10
−3
M
[HCOOH]
initial
= 0.10 M
[H
3
O
+
]
eq
[HA]
initial

35
35
Obliczanie stopnia
dysocjacji
stopień dysocjacji =
100
4.2 10
−3
0.10
= 4.2%

36
36
Równowaga w r-rze słabej
Równowaga w r-rze słabej
zasady
zasady
Oblicz pH 0.010 M r-ru NH
Oblicz pH 0.010 M r-ru NH
3*
3*
H
H
2
2
O.
O.
NH
NH
3
3
* H
* H
2
2
O
O
=
=
NH
NH
4
4
+
+
+ OH
+ OH
-
-
K
K
b
b
= 1.8 x 10
= 1.8 x 10
-5
-5
Krok 1.
Krok 1.
Definiujem stężenia równowagowe
Definiujem stężenia równowagowe
[NH
[NH
3
3
*H
*H
2
2
O]
O]
[NH
[NH
4
4
+
+
]
]
[OH
[OH
-
-
]
]
pocz.
pocz.
zmiana
zmiana
równ.
równ.
0.010
0.010
0
0
0
0
0.010
0.010
0
0
0
0
-x
-x
+x
+x
+x
+x
-x
-x
+x
+x
+x
+x
0.010 - x
0.010 - x
x
x
x
x
0.010 - x
0.010 - x
x
x
x
x

37
37
Równowaga w r-rze słabej
Równowaga w r-rze słabej
zasady
zasady
Oblicz pH 0.010 M roztworu NH
Oblicz pH 0.010 M roztworu NH
3
3
*H
*H
2
2
O.
O.
Krok 2.
Krok 2.
Rozwiązujemy równanie
Rozwiązujemy równanie
K
b
1.8 x 10
-5
=
[NH
4
+
][OH
-
]
[NH
3
]
=
x
2
0.010 - x
K
b
1.8 x 10
-5
=
[NH
4
+
][OH
-
]
[NH
3
]
=
x
2
0.010 - x
Zakładając, że x jest bardzo małe rozwiązujemy
Zakładając, że x jest bardzo małe rozwiązujemy
równanie uproszczone
równanie uproszczone
x = [OH
x = [OH
-
-
] = [NH
] = [NH
4
4
+
+
] = 4.2 x 10
] = 4.2 x 10
-4
-4
M
M
i [NH
i [NH
3
3
] = 0.010 - 4.2 x 10
] = 0.010 - 4.2 x 10
-4
-4
, =0.010 M
, =0.010 M

38
38
Równowaga w r-rze słabej
Równowaga w r-rze słabej
zasady
zasady
Krok 3.
Krok 3.
Obliczamy pH
Obliczamy pH
[OH
[OH
-
-
] = 4.2 x 10
] = 4.2 x 10
-4
-4
M
M
pOH = - log [OH
pOH = - log [OH
-
-
] = 3.37
] = 3.37
pH = 14 - pOH
pH = 14 - pOH
pH = 10.63
pH = 10.63
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
Wyszukiwarka
Podobne podstrony:
Leszek wyklad11 metale
Leszek wyklad4 elektrochemia
Leszek wyklad9 teoria pasmowa ciala stalego
Leszek wyklad8a chlorowce
Leszek wyklad2
Leszek wyklad7
Leszek wyklad3
Leszek wyklad4
Leszek wyklad3
Leszek wyklad2
Leszek wyklad5
Leszek wyklad1
Leszek wyklad8
Leszek wyklad10 zwiazki kompleksowe
Leszek wyklad6
Leszek wyklad12 grupy dlowne
Leszek wyklad11 metale
więcej podobnych podstron