1
Termodynamika
chemiczna
zakres i metoda
Waldemar Ufnalski
Wprowadzenie do termodynamiki
chemicznej
Wykład 1
0,0E+00
2,5E+05
5,0E+05
7,5E+05
1,0E+06
0
,0
E
+
0
0
2
,5
E
-0
2
5
,0
E
-0
2
7
,5
E
-0
2
1
,0
E
-0
1
1
,3
E
-0
1
V/m
3
P
/P
a
0,0
10,0
20,0
30,0
40,0
50,0
60,0
0
20
40
60
80
100
T/K
C
p
/(
J/
m
o
l
K
)
15
16
17
18
19
0,0
0,2
0,4
0,6
0,8
1,0
Współrzędna reakcji
G
/R
T
-10
-5
0
5
10
G
/R
T
G/RT
G/RT

2
1.1. Cel badań
termodynamicznych i
pojęcia podstawowe
Wykład 1
3
CHEMIA FIZYCZNA
Badanie i opis ilościowy
właściwości substancji oraz ich
przemian fizycznych i
chemicznych
TERMODYNAMIKA
CHEMICZNA
Badanie praw rządzących
przemianami energii układów
makroskopowych w wyniku
przemian fizycznych i
chemicznych
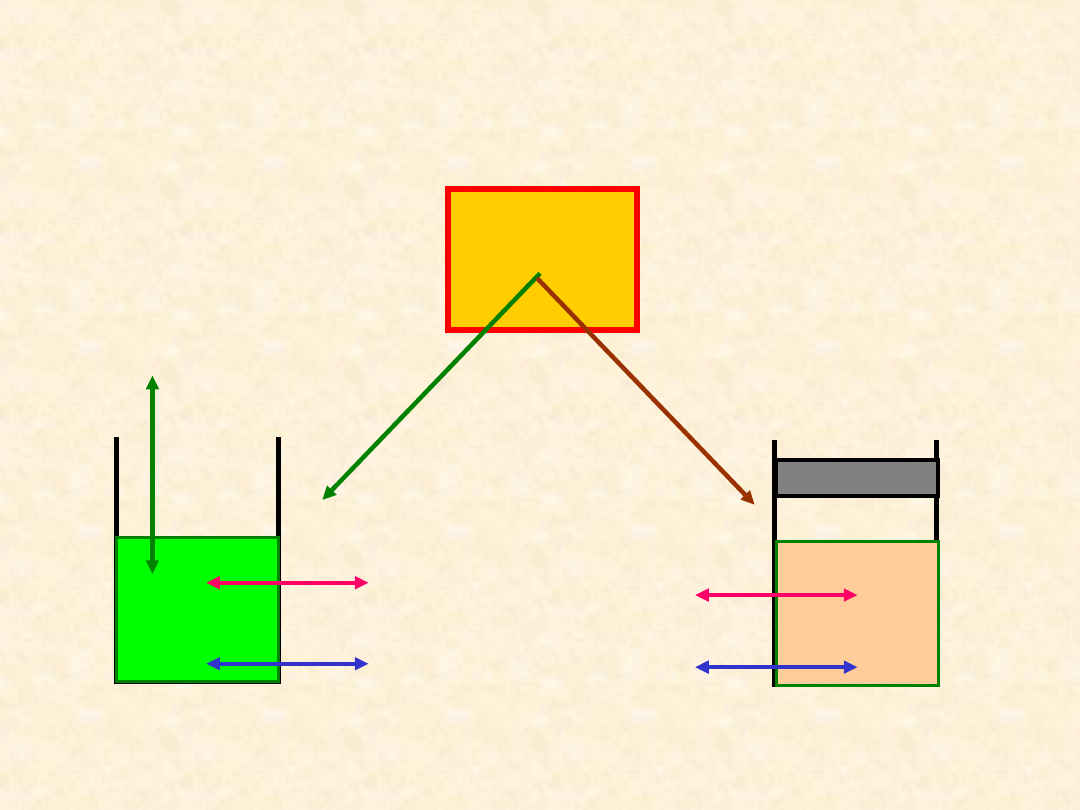
4
Ukła
d
Oddziaływanie układu z otoczeniem
-
wymiana materii i energii
Otocze
nie
Otocze
nie
Otocze
nie
Otwar
ty
Zamknię
ty
Q
W
Q
W
Składni
ki
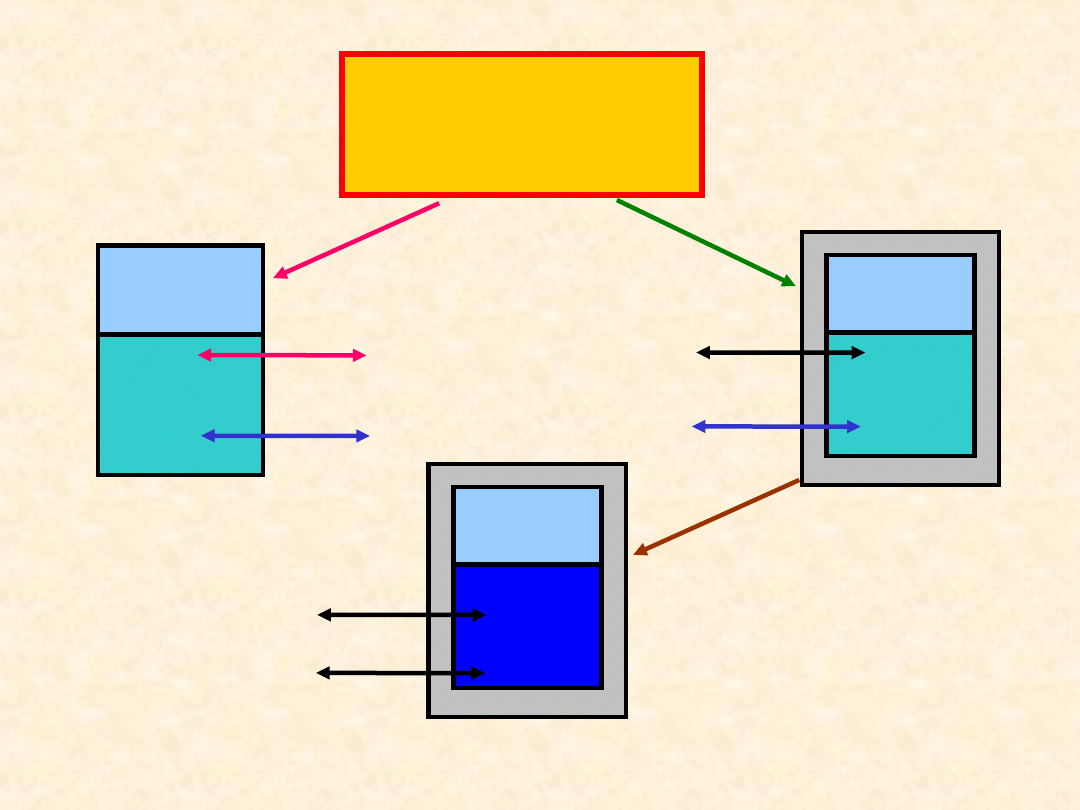
5
Układ
zamknięty
Otocze
nie
Otocze
nie
Otocze
nie
Otocze
nie
Q
0
Diatermic
zny
Adiabatyc
zny
Q =
0
W
= ?
W
= ?
Q =
0
W =
0
Izolowa
ny

6
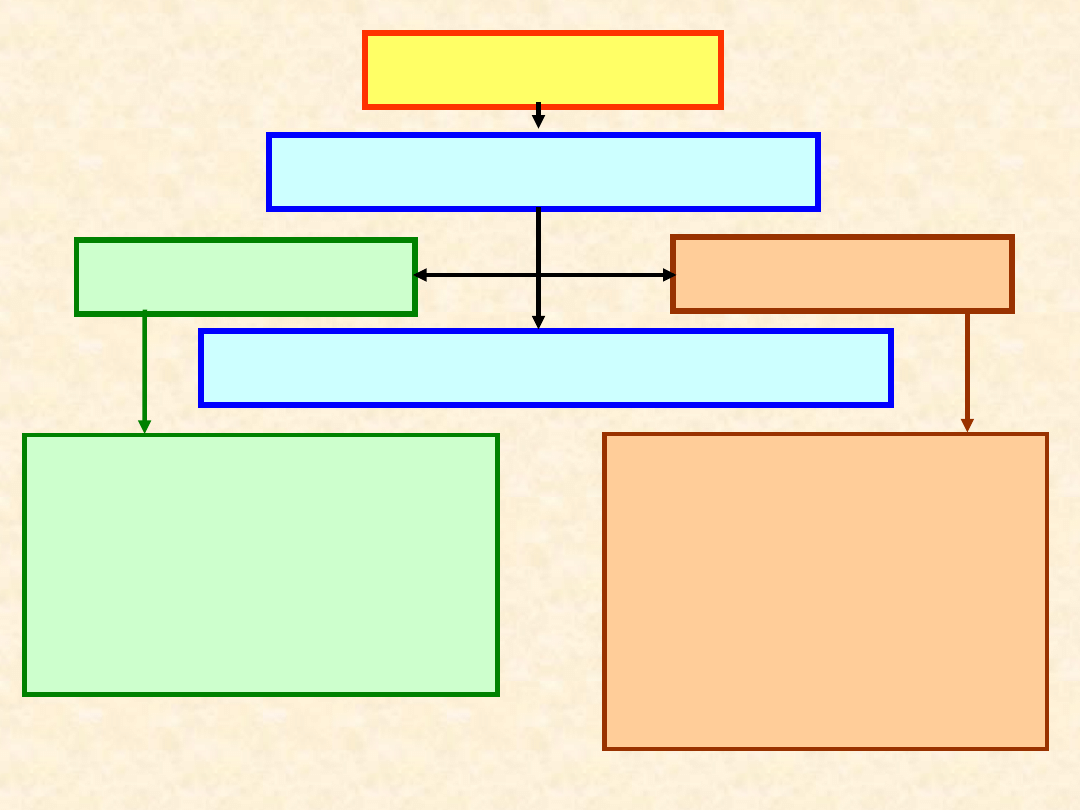
Więzy (ograniczenia)
narzucone układowi
Stały parametr
• Temperatura (T =
const)
• Ciśnienie (P = const)
• Objętość (V = const)
Nazwa układu
• Izotermiczny
• Izobaryczny
• Izochoryczny
7
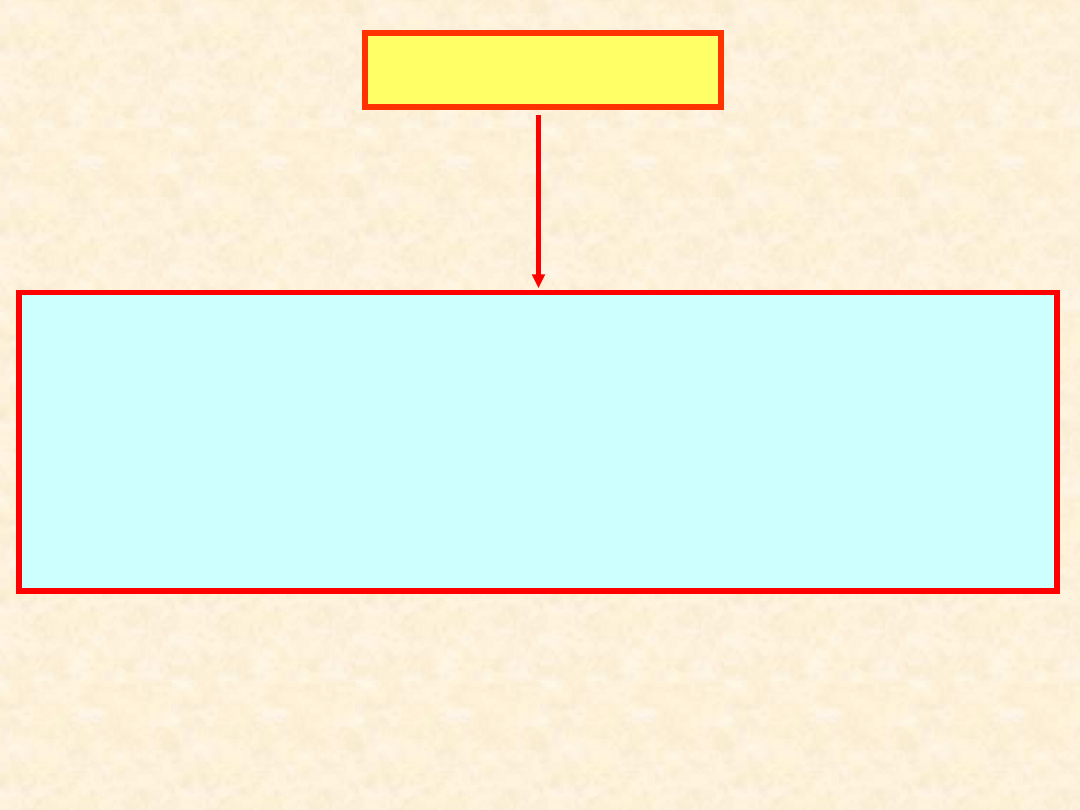
Stan
układu
Parametry stanu
układu
Ekstensywne
Intensywne
Liczba stopni swobody
(wariancja)
Proporcjonalne do
ilości materii w
układzie:
• masa
• objętość
Niezależne od
ilości materii w
układzie:
• temperatura
• ciśnienie
• ułamek molowy
8
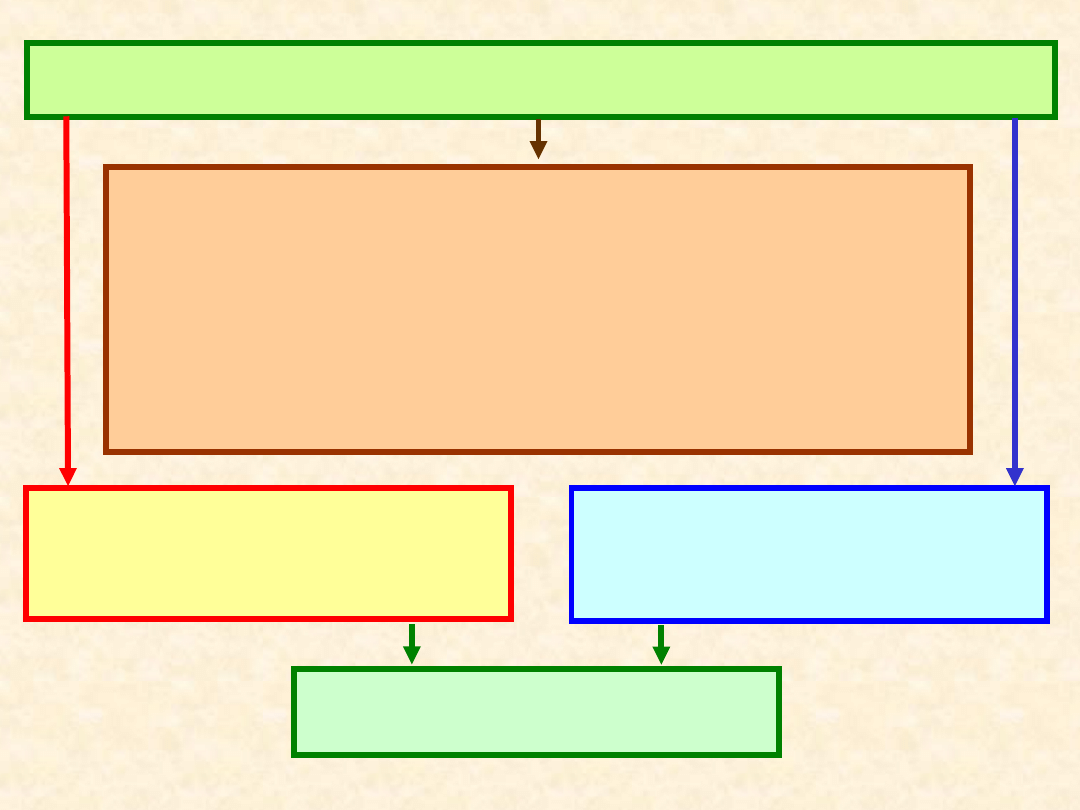
Stan
układu
Reguła Duhema:
Stan
termodynamiczny układu jest
jednoznacznie określony jeżeli znane
są ilości każdego składnika oraz
dodatkowo dwa parametry.
9
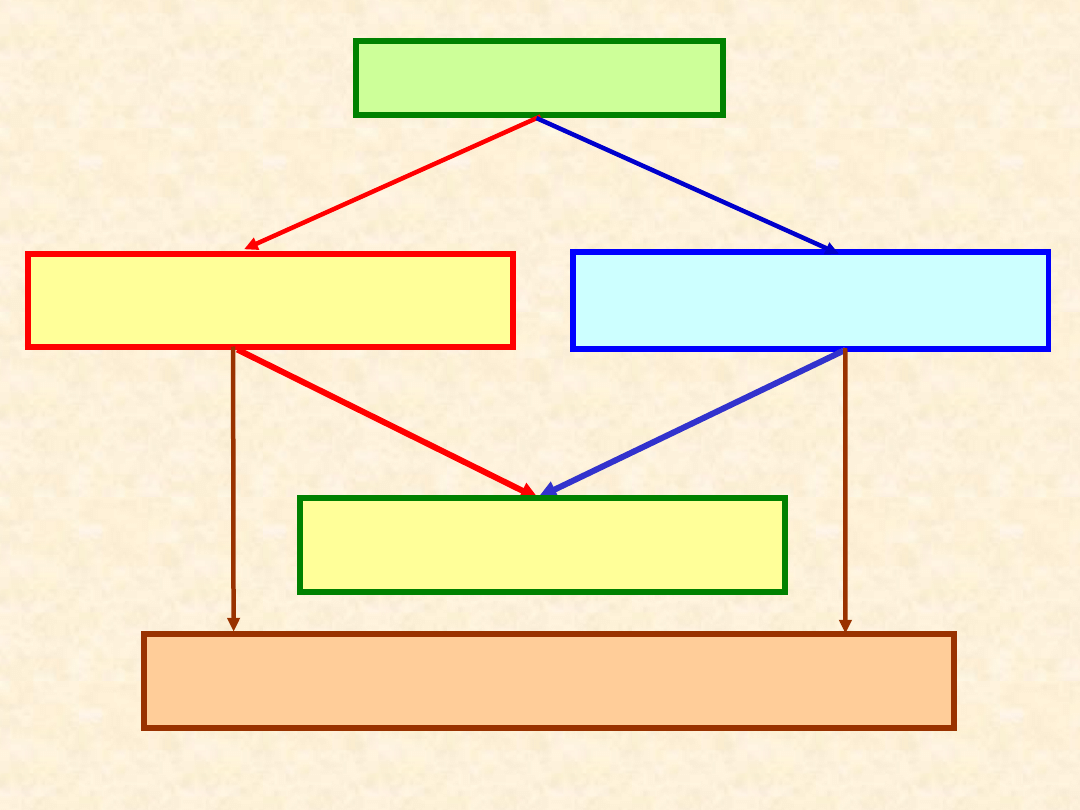
Faza wewnętrznie
zrównoważona
Jednoskładnikowa
= substancja czysta
• parametry intensywne mają identyczne
wartości w każdym elemencie objętości
fazy
• na granicy fazy następuje skokowa
zmiana wartości co najmniej jednego
parametru intensywnego
Wieloskładnikowa
= roztwór
stała, ciekła,
gazowa
10
Układ ...
jednoskładniko
wy,
wieloskładniko
wy,
jednofazowy
wielofazowy

11
1.2. Termodynamiczny
opis układów i przemian
- ograniczenia i sukcesy
Wykład 1

12
Metoda opisu
termodynamicznego ...
• Zdefiniować układ
• Określić więzy narzucone układowi
• Określić liczbę stopni swobody układu
• Wybrać parametry stanu układu
(zmienne niezależne)
• Na zbiorze parametrów stanu
zdefiniować funkcje termodynamiczne
(synonim - funkcje stanu)
• ....
13
.... metoda opisu
termodynamicznego...
• Obliczyć zmianę Y funkcji stanu w
wyniku opisywanej przemiany
• Zinterpretować obliczoną wartość Y
Y
Y
x
dx
j
x
const
j
x
x
j
k
i j
j
i
j
ii
.
1
Stan
początkowy
Y(x’
1
, x’
2
,
....x’
k
)
Stan końcowy
Y(x”
1
, x”
2
,
....x”
k
)
14
.... metoda opisu
termodynamicznego
Założenie:
• ciągłość parametrów i funkcji stanu
• ciągłość materii
• ignorowanie molekularnej budowy
materii
Ograniczenie:
• możliwość opisu wyłącznie układów
makroskopowych (N > 10
10
drobin) w
których nieciągłość materii jest
pomijalna

15
Sukcesy opisu
termodynamicznego ...
Opis:
• właściwości PVT substancji czystych i efektów
energetycznych ich przemian fizycznych
• przemian fazowych substancji czystych
(topnienie, parowanie, sublimacja, polimorfizm)
• efektów objętościowych i energetycznych
tworzenia roztworów z substancji czystych
• równowag fazowych w układach
wieloskładnikowych (ciecz - ciecz, ciecz - para,
ciecz - kryształ)
• ....

16
....sukcesy opisu
termodynamicznego
... opis
• efektów cieplnych reakcji chemicznych
• położenia stanu równowagi w układach,
w których przebiegają reakcje chemiczne
• ograniczeń procesu konwersji energii
cieplnej na energię mechaniczną (teoria
maszyn cieplnych)
• procesu konwersji energii chemicznej w
energię elektryczną

17
Zalety opisu
termodynamicznego
• Prostota wnioskowania metodami analizy
matematycznej
• Brak teoretycznych ograniczeń stopnia
złożoności układów (od „1 mola gazu”
do „organizmu żywego”)
• Możliwość obliczenia wartości wielkości
trudno mierzalnych na podstawie
wartości wielkości łatwo mierzalnych
• Brak konieczności kontrolowania „drogi
przemiany” - zmiana funkcji stanu zależy
wyłącznie od wartości parametrów stanu
początkowego i końcowego układu

18
Braki opisu
termodynamicznego
• Brak możliwości określenia szybkości przemiany
(czas nie jest parametrem stanu układu)
• Brak możliwości teoretycznego obliczenia
wartości funkcji termodynamicznych mogą
być one obliczane wyłącznie na podstawie
wartości doświadczalnych konieczność
pomiarów wielkości określających
charakterystykę termodynamiczną układów i ich
przemian TERMODYNAMIKA
DOŚWIADCZALNA.

19
TERMODYNAMIKA
DOŚWIADCZALNA
-najważniejsze typy pomiarów ....
•
Relacje PVT substancji czystych
•
Efekty cieplne przemian fizycznych substancji
czystych (ogrzewanie/oziębianie, przemiany
fazowe)
•
Efekty objętościowe i cieplne tworzenia
roztworów (rozpuszczania)
•
Równowagi fazowe w układach
jednoskładnikowych i wieloskładnikowych
(związek między ciśnieniem, temperaturą i
naturą (ewentualnie - składem) faz
współistniejących w stanie równowagi

20
...TERMODYNAMIKA
DOŚWIADCZALNA
-najważniejsze typy pomiarów
• Efekty energetyczne reakcji chemicznych
(efekty cieplne i SEM ogniw chemicznych)
• Położenie stanu równowagi (skład
równowagowy) układów w których przebiegają
reakcje chemiczne.
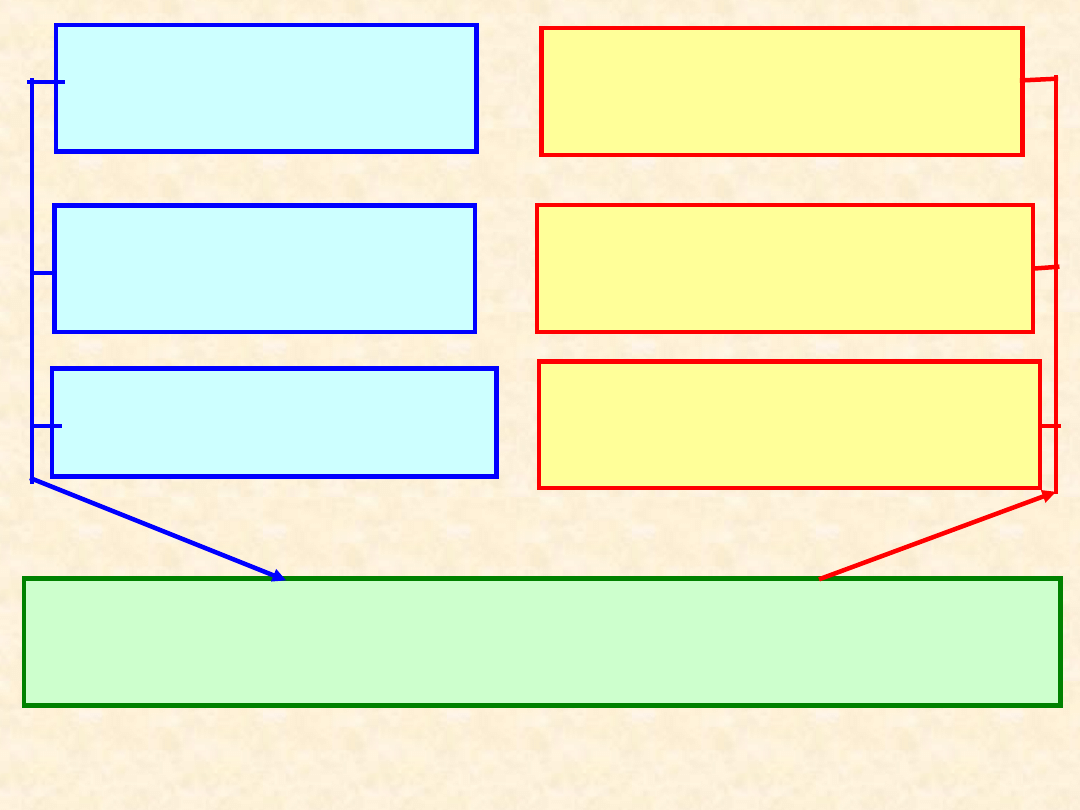
21
OPIS
MOLEKULAR
NY
OPIS
TERMODYNAMICZ
NY
SPEKTROSKOP
IA
CHEMIA
KWANTOWA
TERMODYNAMI
KA KLASYCZNA
TERMODYNAMI
KA
DOŚWIADCZALN
A
TERMODYNAMIKA STATYSTYCZNA

22
W każdej nauce jest tyle
prawdy, ile jest w niej
matematyki .
Emanuel Kant (1724 –
1804)
filozof niemiecki , twórca
idealizmu transcedentalnego
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
TD 01
Ubytki,niepr,poch poł(16 01 2008)
01 E CELE PODSTAWYid 3061 ppt
01 Podstawy i technika
01 Pomoc i wsparcie rodziny patologicznej polski system pomocy ofiarom przemocy w rodzinieid 2637 p
zapotrzebowanie ustroju na skladniki odzywcze 12 01 2009 kurs dla pielegniarek (2)
01 Badania neurologicz 1id 2599 ppt
01 AiPP Wstep
ANALIZA 01
01 WPROWADZENIA
01 piątek
choroby trzustki i watroby 2008 2009 (01 12 2008)
syst tr 1 (2)TM 01 03)13
Analiza 01
04 01 MORBILLO ROSOLIA VaMALATTIA
ut 01 obwrez 2013
Pielęgniarki kurs wersja 6 V 01
więcej podobnych podstron