© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
TERMODYNAMIKA
PROCESOWA I TECHNICZNA
Wykład XI
Równowaga fazowa w układach
wieloskładnikowych
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
2
RÓWNOWAGA FAZOWA
Uwagi wstępne
Zagadnienie równowagi fazowej ma fundamentalne znaczenie w opisie
wielu procesów odbywających się z udziałem dwu lub więcej faz,
w których następuje wymiana masy między fazami. Przykłady takich
procesów:
•
Destylacja i rektyfikacja
•
Absorpcja i desorpcja
•
Adsorpcja
•
Ekstrakcja
•
Krystalizacja
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
3
RÓWNOWAGA FAZOWA
Uwagi wstępne
Procesy te mogą zachodzić tylko wtedy gdy dany układ będzie odległy od stanu
równowagi. Szybkość przebiegu tych procesów jest na ogół proporcjonalna
do odległości od stanu równowagi. Zatem, znajomość stanu równowagi
jest podstawą do opisu takich procesów.
Stany równowagi fazowej najczęściej rozpatruje się w układach 2 fazowych:
destylacja – (ciecz + para), absorpcja – (ciecz + gaz), adsorpcja – (ciało stałe +
ciecz lub gaz), ekstrakcja – (ciecz + ciecz), krystalizacja – (ciecz + ciało stałe).
Zagadnienie równowagi fazowej rozpatrzymy na przykładzie układu
ciecz - para. Większość wyprowadzonych wniosków można bez problemów
uogólnić na inne układy dwu lub więcej fazowe.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
4
RÓWNOWAGA FAZOWA
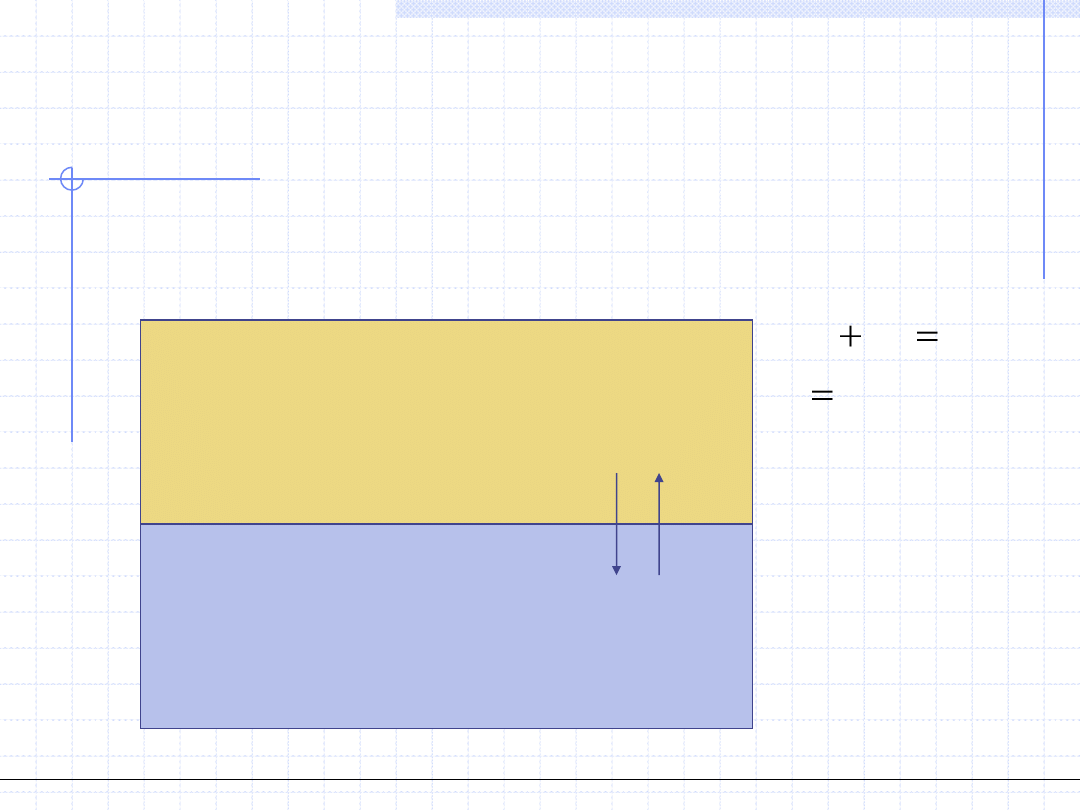
Układ ciecz – para (gaz)
Rozpatrzy układ zamknięty (bez wymiany masy z otoczeniem) k – składnikowy
składający się z dwu faz: ciekłej i parowej. Fazę ciekłą będziemy oznaczać
górnym indeksem „L” a parową indeksem „V”.
Para (Gaz)
n
1
V
,n
2
V
,…,n
i
V
,…,n
k
V
y
1
,y
2
,…,y
i
,…,y
k
p
V
,T
V
Ciecz
n
1
L
,n
2
L
,…,n
i
L
,…,n
k
L
x
1
,x
2
,…,x
i
,…,x
k
p
L
,T
L
k
i
const
n
n
L
i
V
i
,...,
2
,
1
.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
5
Warunki równowagi fazowej
.
.
const
T
T
T
const
p
p
p
L
V
L
V
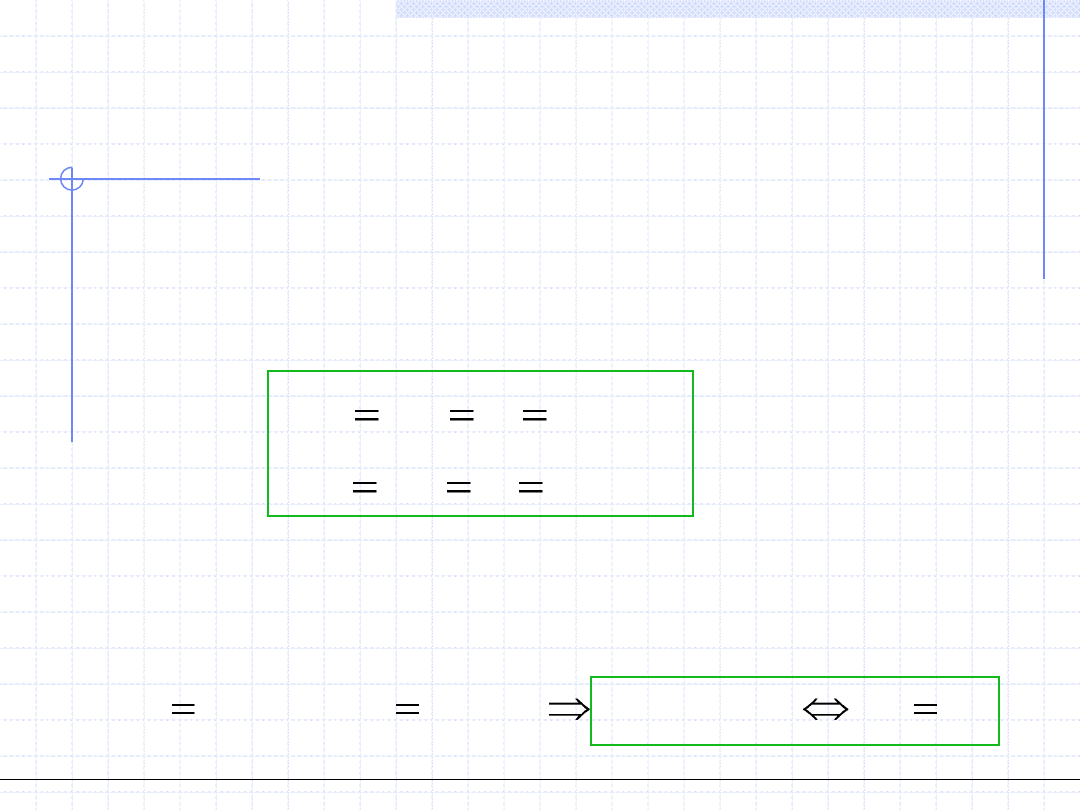
W układzie termodynamicznym dążącym do stanu równowagi tzn. gdy
układ jest izolowany od otoczenia, między fazami tworzącymi układ
zachodzą procesy wymiany energii cieplnej i mechanicznej. W wyniku tych
procesów w całym układzie musi nastąpić wyrównanie temperatury
i ciśnienia. Zatem w stanie równowagi muszą zachodzić równości:
Na podstawie tych równości możemy teraz zastosować wniosek wynikający
z II zasady termodynamiki, mówiący że w układach izotermiczno-izobarycznych
warunkiem równowagi termodynamicznej jest minimalizacja entalpii swobodnej
układu co można zapisać za pomocą prostej równości różniczkowej:
0
.)
.
(
dG
równowaga
const
T
const
p
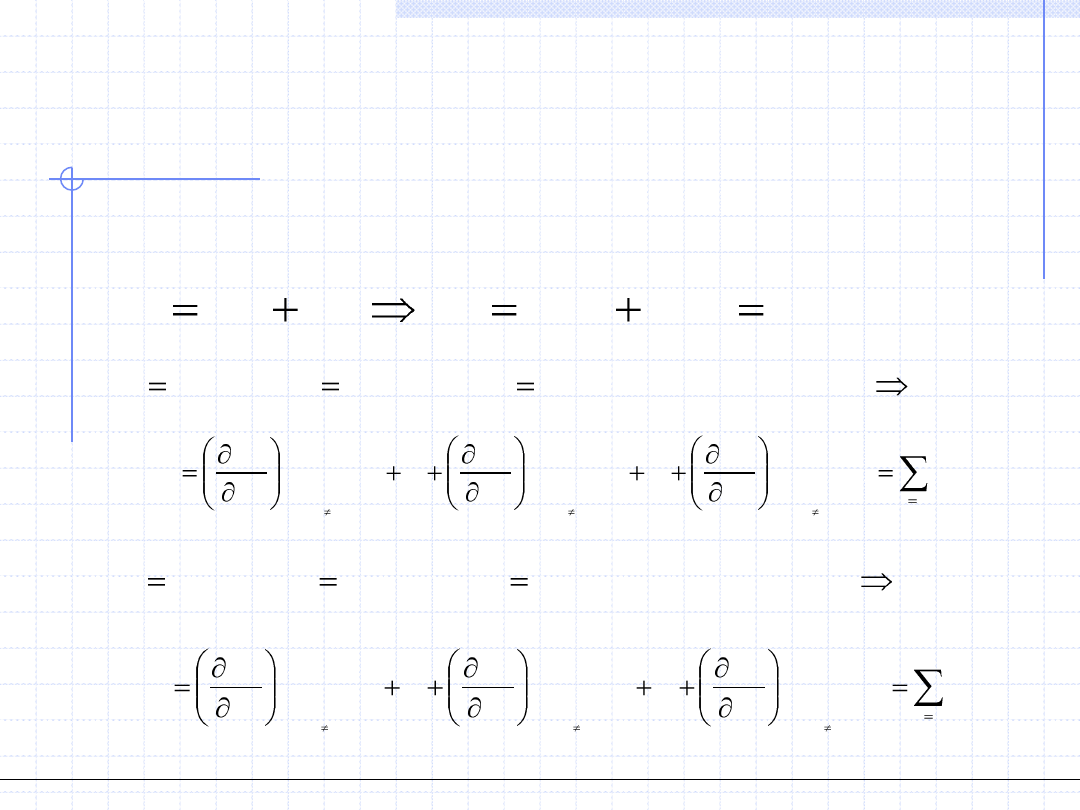
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
6
Warunki równowagi fazowej cd.
)
,...,
,...,
,
(
2
1
V
k
V
i
V
V
V
n
n
n
n
f
G
const
T
const
p
0
L
V
L
V
dG
dG
dG
G
G
G
k
i
V
i
V
i
V
k
n
T
p
V
k
V
V
i
n
T
p
V
i
V
V
n
T
p
V
V
V
dn
g
dn
n
G
dn
n
G
dn
n
G
dG
k
i
i
i
i
1
,
,
,
,
1
,
,
1
...
...
1
Wychodząc z tego ogólnego warunku wyprowadzimy teraz szczegółowe
warunki równowagi w układzie dwufazowym k – składnikowym.
)
,...,
,...,
,
(
2
1
L
k
L
i
L
L
L
n
n
n
n
f
G
const
T
const
p
k
i
L
i
L
i
L
k
n
T
p
L
k
L
L
i
n
T
p
L
i
L
L
n
T
p
L
L
L
dn
g
dn
n
G
dn
n
G
dn
n
G
dG
k
i
i
i
i
1
,
,
,
,
1
,
,
1
...
...
1
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
7
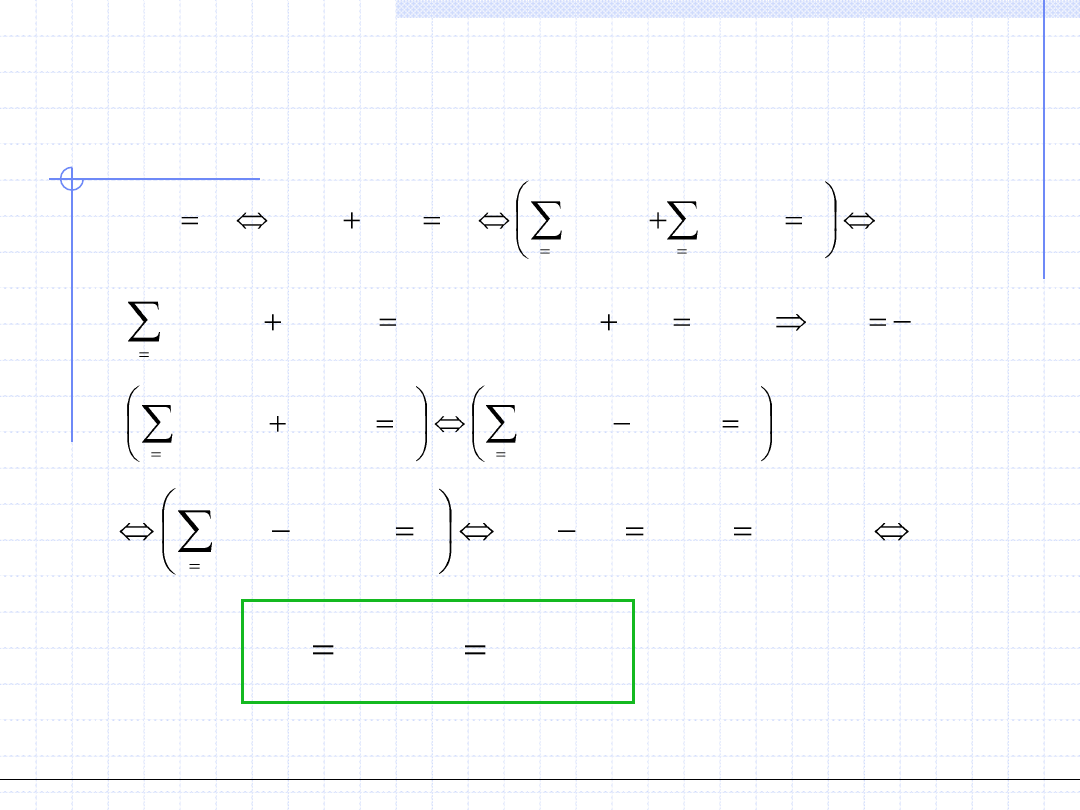
Warunki równowagi fazowej cd.
L
i
V
i
L
i
V
i
L
i
L
i
k
i
V
i
V
i
dn
dn
const
n
n
ale
dn
g
dn
g
.
)
(
0
)
(
1
0
)
0
(
)
0
(
1
1
k
i
L
i
L
i
k
i
V
i
V
i
L
V
dn
g
dn
g
dG
dG
dG
0
)
(
0
)
(
1
1
V
i
L
i
k
i
V
i
V
i
L
i
L
i
k
i
V
i
V
i
dn
g
dn
g
dn
g
dn
g
Układ znajduje się w stanie równowagi wtedy i tylko wtedy gdy wartość cząstkowych
entalpii swobodnych wszystkich składników w obydwu fazach są sobie równe.
)
,...,
2
,
1
0
(
0
)
(
1
k
i
g
g
dn
g
g
L
i
V
i
V
i
L
i
k
i
V
i
)
,...,
2
,
1
(
k
i
g
g
L
i
V
i
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
Warunki równowagi fazowej cd.
parowa
faza
ciek
faza
parowa
faza
ciek
faza
i
i
i
i
f
RTd
dg
f
RTd
dg
.
.
)
ln(
)
ln(
0
ln
0
L
i
V
i
L
i
V
i
f
f
RT
g
g
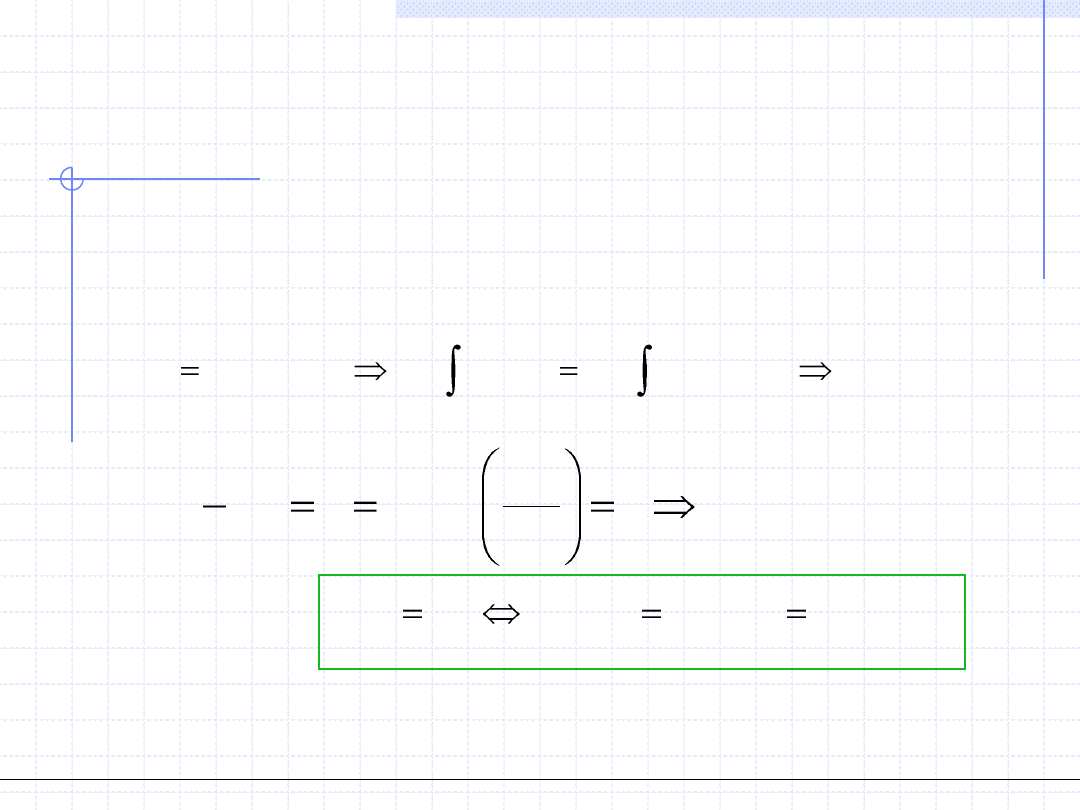
Posługiwanie się cząstkowymi entalpiami swobodnymi jest w wielu przypadkach
niewygodne. Dlatego też warunki równowagi zapisuje się za pomocą
pojęcia fugatywności składników. Wychodząc z definicji tego pojęcia otrzymujemy:
)
,...,
2
,
1
(
0
k
i
f
f
dG
L
i
V
i
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
Warunki równowagi fazowej cd.
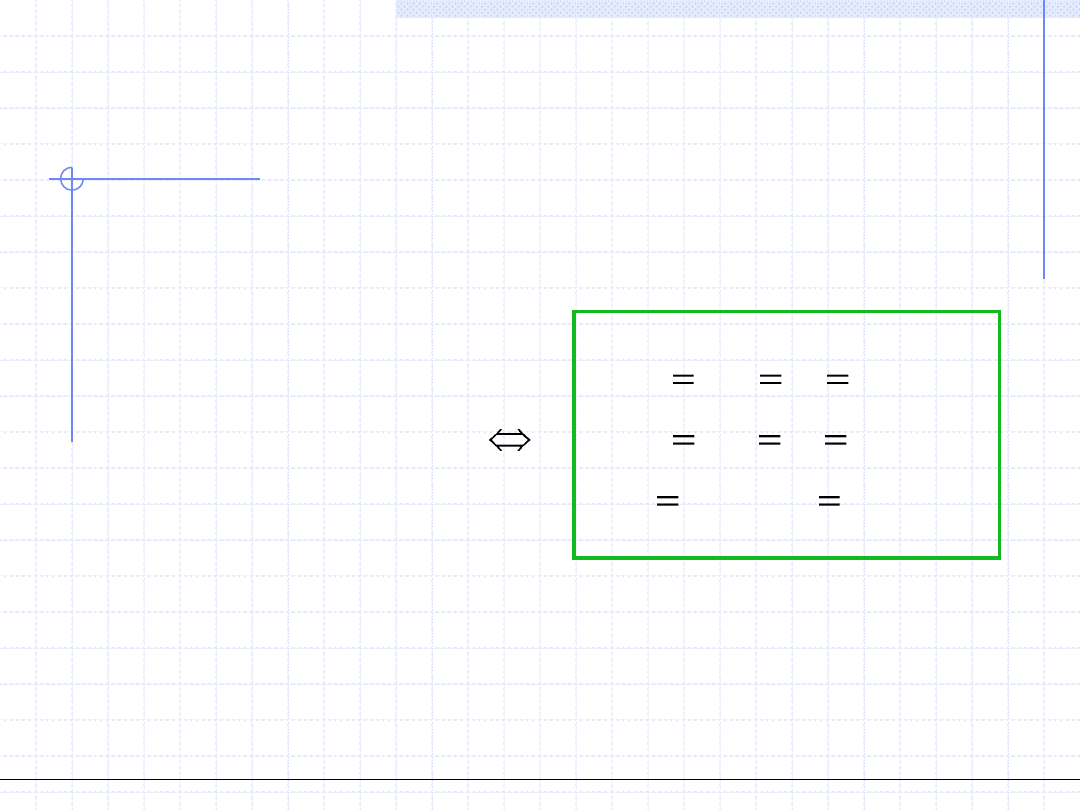
Zreasumujmy warunki równowagi układu dwufazowego ciecz para:
k
i
f
f
const
T
T
T
const
p
p
p
fazowa
Równowaga
L
i
V
i
L
V
L
V
,...,
2
,
1
.
.
Dla układów dwufazowych innego typu np. ciecz – ciecz warunki równowagi
będą miały w pełni analogiczną postać.
Warunki te można też rozciągnąć na układy trój i więcej fazowe.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
10
Problemy równowagi fazowej w
układzie ciecz - para
Rozpatrzmy teraz bardziej szczegółowo problemy równowagowe występujące
w układzie ciecz – para. Zastosujmy najpierw do naszego układu regułę faz
Gibbsa w celu obliczenia liczby stopni swobody określające liczbę niezależnych
parametrów potrzebnych do opisania równowagi fazowej w układzie.
k
k
f
k
s
2
2
2
Zatem do opisania równowagi fazowej w k – składnikowym układzie
2 – fazowym niezbędne jest ustalenie k parametrów.
Z kolei maksymalna liczba parametrów określających układ to:
- temperatura i ciśnienie: (2)
- skład fazy parowej (określony za pomocą ułamków molowych): k-1
- skład fazy ciekłej: k-1
W sumie mamy 2(k-1)+2=2k.
Zatem w praktyce należy ustalić k parametrów. Drugie k parametrów muszą
wynikać z warunków równowagowych. W zależności od tego które parametry
ustalamy z góry a które obliczamy z warunków równowagowych, mamy różne
problemy równowagowe. Takich przypadków może być dużo.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
11
Problemy równowagi fazowej w
układzie ciecz – para cd.
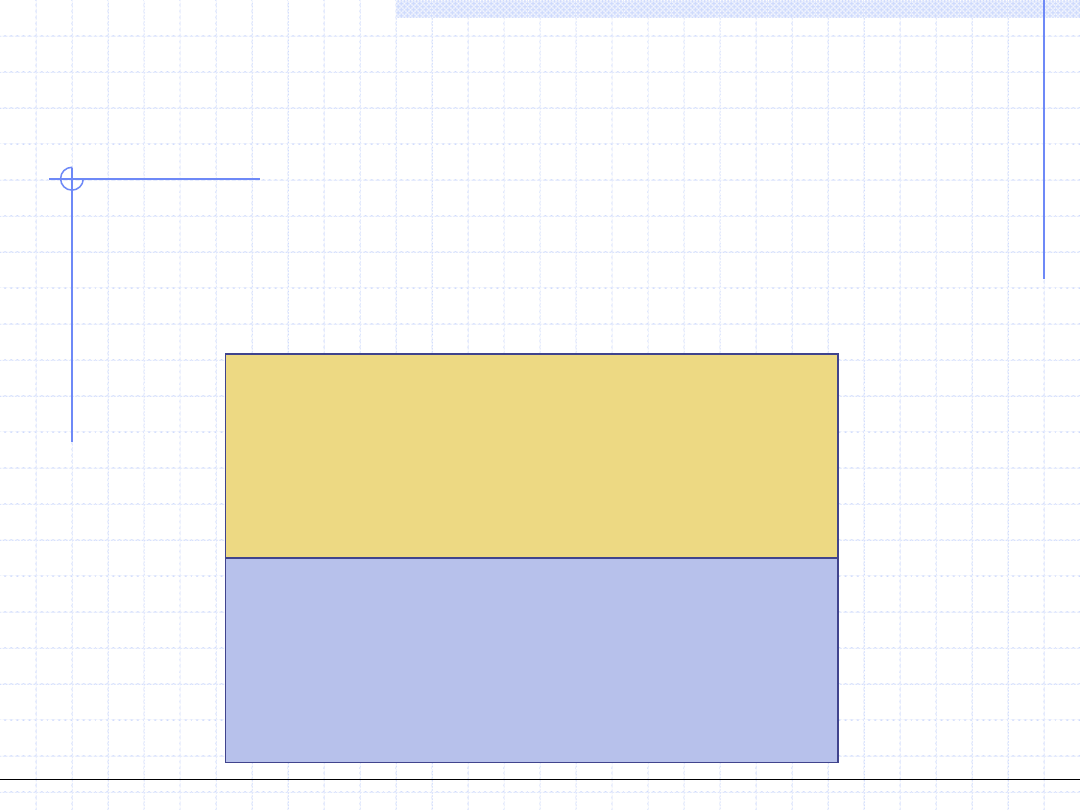
W praktyce procesu destylacji ważne są 4 problemy równowagowe. Są to:
1. Obliczanie ciśnienia i składu fazy parowej przy zadanej temperaturze
i zadanym składzie fazy ciekłej.
Para
p,y
1
,y
2
,…,y
i
,…,y
k
- ???
k niewiadomych parametrów
Ciecz
T,x
1
,x
2
,…,x
i
,…,x
k
k znanych parametrów
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
12
Problemy równowagi fazowej w
układzie ciecz – para cd.
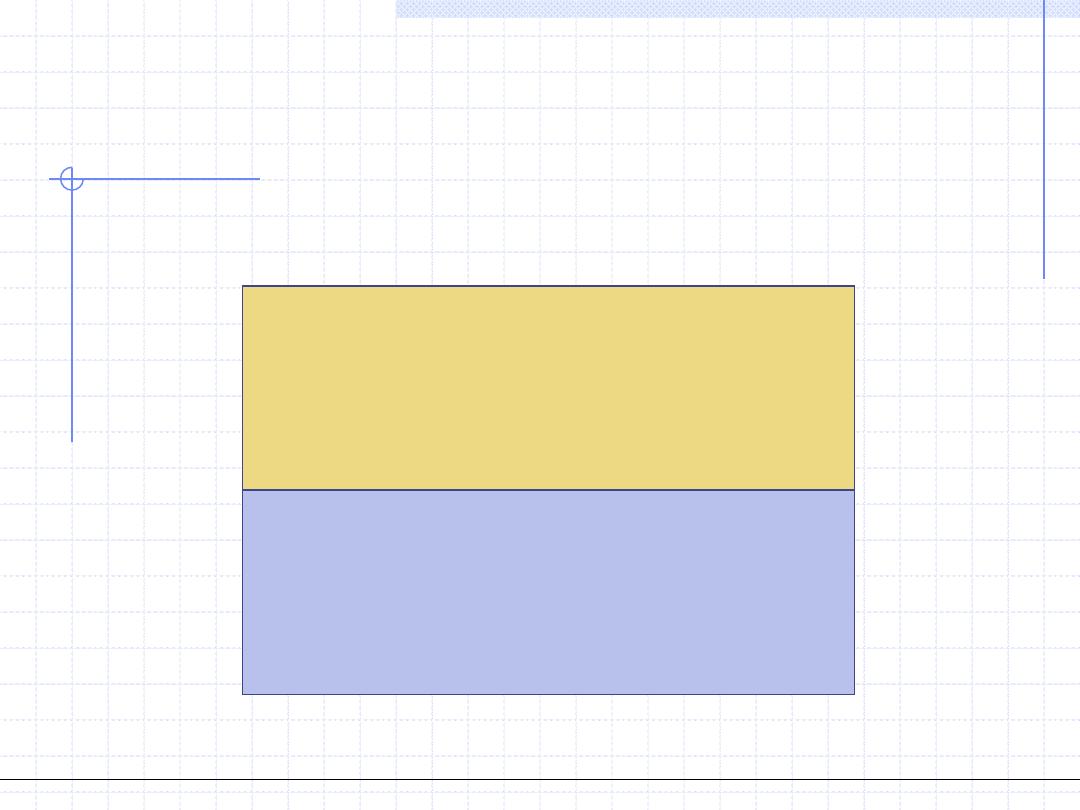
2. Obliczanie temperatury i składu fazy parowej przy zadanym ciśnieniu
i zadanym składzie fazy ciekłej.
Para
T,y
1
,y
2
,…,y
i
,…,y
k
- ???
k niewiadomych parametrów
Ciecz
p,x
1
,x
2
,…,x
i
,…,x
k
k znanych parametrów
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
13
Problemy równowagi fazowej w
układzie ciecz – para cd.
3. Obliczanie ciśnienia i składu fazy ciekłej przy zadanej temperaturze
i zadanym składzie fazy parowej.
Para
T,y
1
,y
2
,…,y
i
,…,y
k
k znanych parametrów
Ciecz
p,x
1
,x
2
,…,x
i
,…,x
k
- ???
k niewiadomych parametrów
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
14
Problemy równowagi fazowej w
układzie ciecz – para cd.
4. Obliczanie temperatury i składu fazy ciekłej przy zadanym ciśnieniu
i zadanym składzie fazy parowej.
Para
p,y
1
,y
2
,…,y
i
,…,y
k
k znanych parametrów
Ciecz
T,x
1
,x
2
,…,x
i
,…,x
k
- ???
k niewiadomych parametrów
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
15
Stała równowagi składnika
W rozważaniach i obliczeniach stanu równowagi fazowej bardzo pomocne są
pewne pojęcia pomocnicze takie jak tzw. stała równowagi i linia równowagi.
Pojęcia te dotyczą wybranego składnika „i”, który nas interesuje w danej chwili.
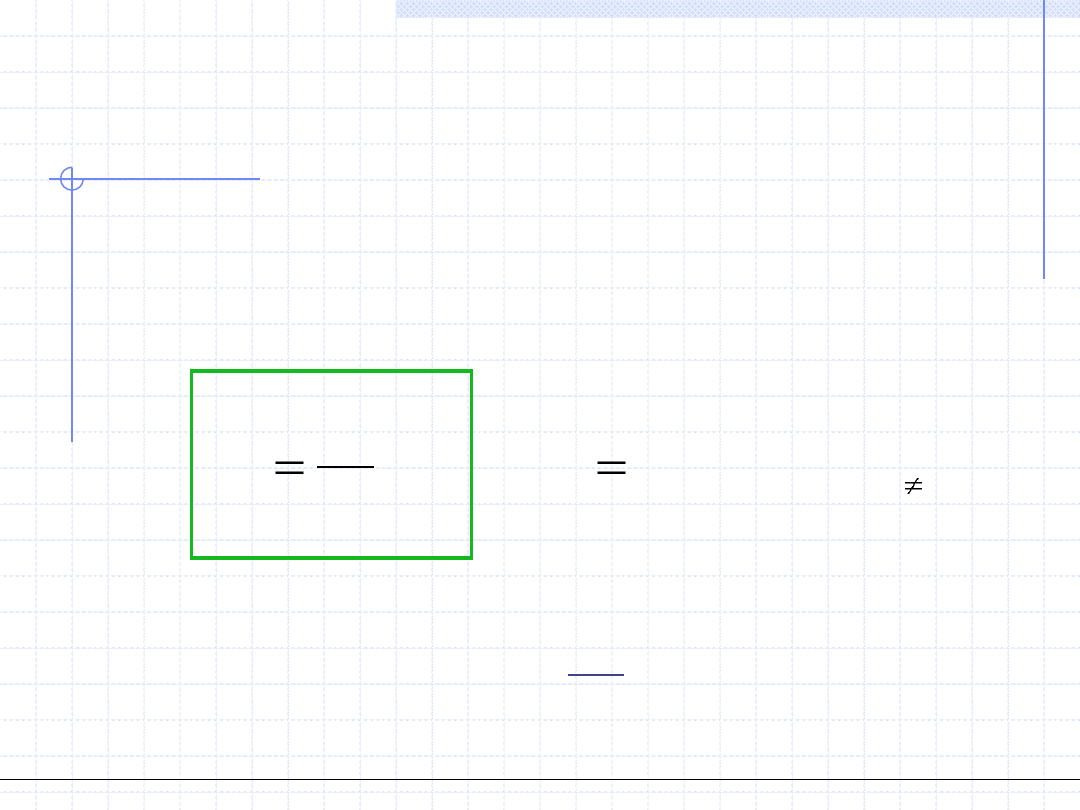
Stała równowagi fazowej składnika „i” nazywamy stosunek ułamków molowych
(lub innych wielkości określających zawartość składnika „i”) w poszczególnych
fazach. W szczególności dla układu ciecz –para stała równowagi jest definiowana
jako:
)
,
,
,
(
*
i
j
i
i
i
i
i
x
x
T
p
f
K
x
y
K
Gwiazdka w powyższym wzorze tradycyjnie wskazuje że mamy stan równowagi.
Jak zaznaczono powyżej, wielkość K
i
w ogólnym przypadku zależy od wielu
parametrów; w związku z tym określenie stała jest nieco mylące. Określenie
to powstało jednak dla opisu sytuacji gdzie wielkość ta jest stała. W ogólnym
przypadku należy pamiętać że wielkość ta na ogół jest zmienna.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
16
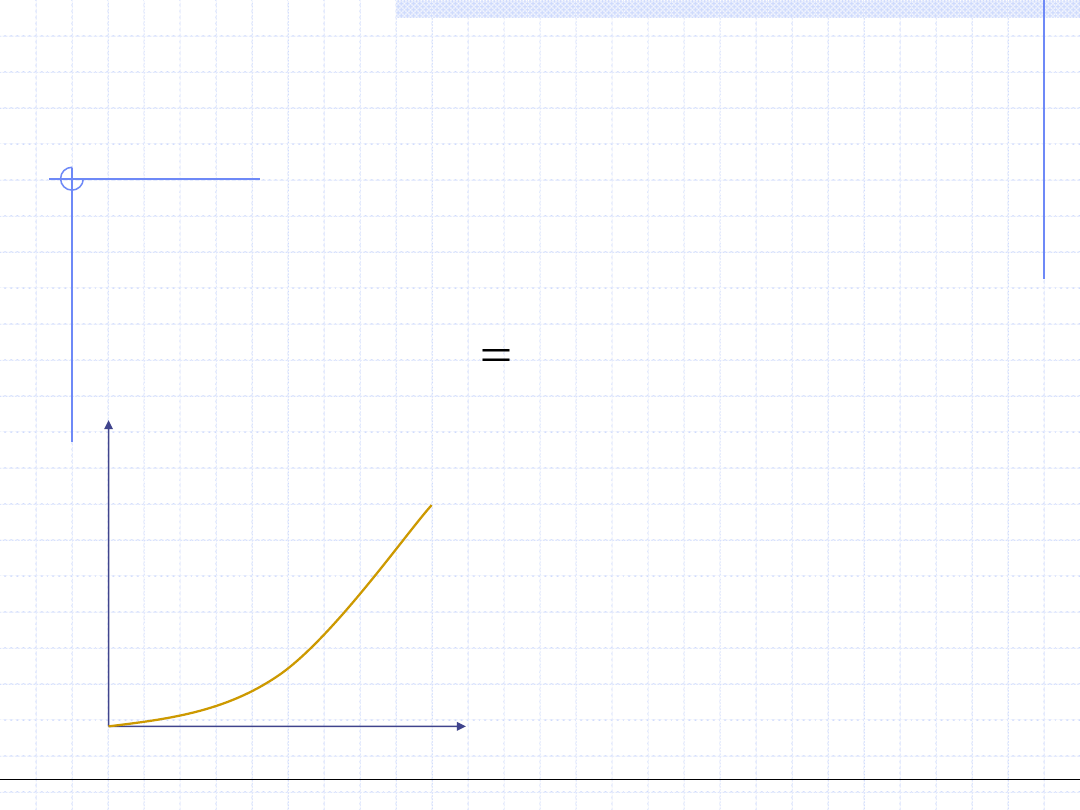
Linia równowagi składnika
W opisie równowagi dla niektórych procesów istotne są stany równowagi
w pewnym zakresie stężeń wybranego składnika „i” w jednej fazie przy
ustalonych pozostałych parametrach. W takim przypadku stężenia składnika
w drugiej fazie można traktować jak funkcję:
)
(
*
i
i
x
f
y
Wykres tej funkcji nazywamy linią równowagi składnika „i”.
y
i
*
x
i
Prawidłowo wykreślona linia równowagi
powinna określać, jakie parametry przy
jej wykreślaniu są stałe. Stałe może być
ciśnienie, temperatura lub też ciśnienie
i temperatura. Na ogół stałe są także
stężenia pozostałych składników
z uwzględnieniem ich wzajemnej zależności.
Np. sumaryczny ułamek molowy musi być
równy 1, zatem zmianie x
i
musi towarzyszyć
zmiana innego ułamka x
j
.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
17
Linia równowagi składnika cd.
)
(
*
i
i
x
f
p
i
i
x
p
i
x
p
K
*
,
Zarówno stała równowagi jak i linia równowagi mogą być określane w różnych
konfiguracjach stężeń w zależności od tego jaki rodzaj stężenia zastosujemy
w danej fazie. Przykładowo w fazie parowej możemy zastosować jako miarę
stężenia ciśnienie cząstkowe. Jeżeli w fazie ciekłej pozostaniemy przy ułamkach
molowych to linia równowagi będzie określała funkcję:
a stała równowagi będzie określona wzorem:
Ważnym terminem występującym przy opisie niektórych procesów jest
tzw. nachylenie linii równowagi oznaczane na ogół przez „m
i
”.
i
i
i
dx
dy
m
*
W przypadkach gdy stała równowagi nie zależy od x
i
wtedy linia równowagi
jest linią prostą a nachylenie linii równowagi jest równe stałej równowagi.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
18
Wyznaczanie stanów równowagowych
k
i
f
f
L
i
V
i
,...,
2
,
1
Punktem wyjścia do teoretycznego wyprowadzenia wzorów określających
stany równowagi fazowej jest fakt równości fugatywności poszczególnych
składników w obydwu fazach:
Opierając się na tej równości wyprowadzimy teraz wzory pozwalające
obliczać stałą równowagi fazowej K
i
.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
19
Wyznaczanie stanów równowagowych
Rozważmy najpierw lewą stronę równości czyli fugatywność składnika w fazie
parowej. Wprowadzając współczynnik fugatywności możemy napisać:
)
,...,
,...,
,
,
,
(
2
1
k
i
V
i
i
V
i
i
V
i
V
i
y
y
y
y
T
p
f
gdzie
p
y
p
f
Wyrażenie określające współczynnik fugatywności w ogólnym przypadku
zależy od składu fazy parowej oraz temperatury i ciśnienia. W niektórych
przypadkach możliwe jest znaczne uproszczenie, co pokażemy później.
Jeżeli uproszczenie jest niemożliwe to do określenia tej zależności można
stosować wzory wynikające z równań stanu.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
20
Przy określaniu prawej strony warunku równowagi stosowane są dwa sposoby,
z których wynikają dwie metody obliczeń równowagowych:
Wyznaczanie stanów równowagowych cd.
)
,...,
,...,
,
,
,
(
2
1
k
i
L
i
i
L
i
L
i
x
x
x
x
T
p
f
gdzie
p
x
f
i
L
i
i
V
i
i
L
i
i
V
i
x
y
p
x
p
y
*
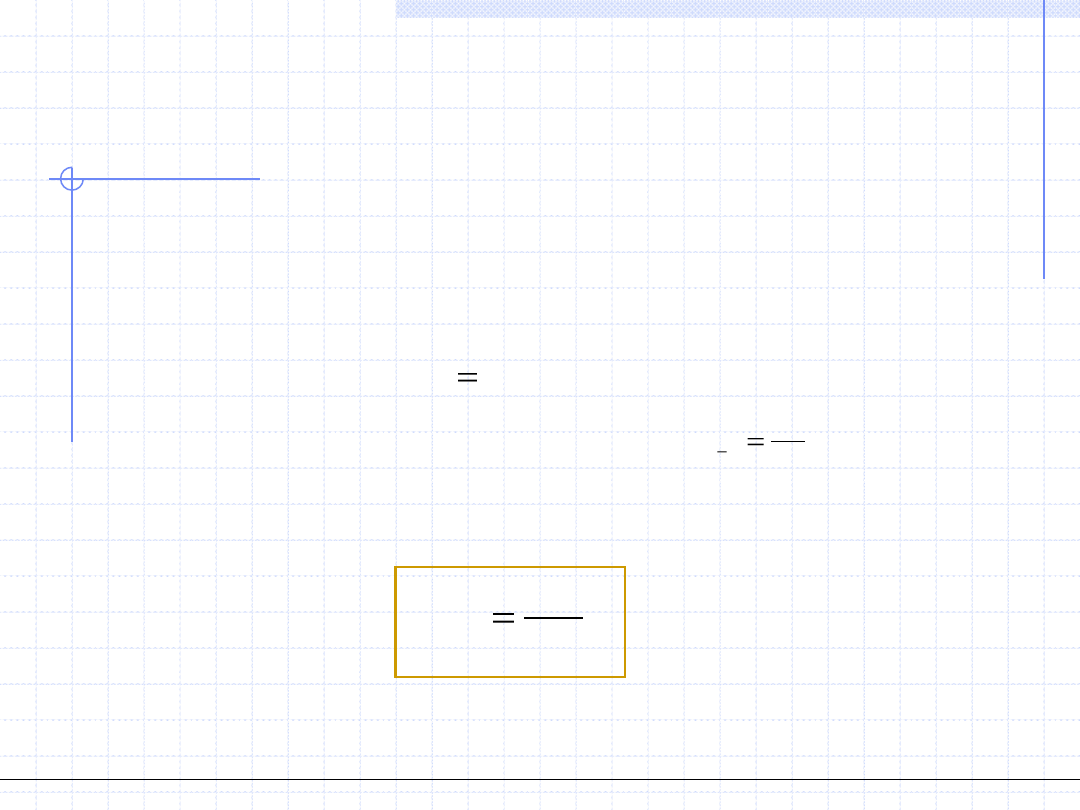
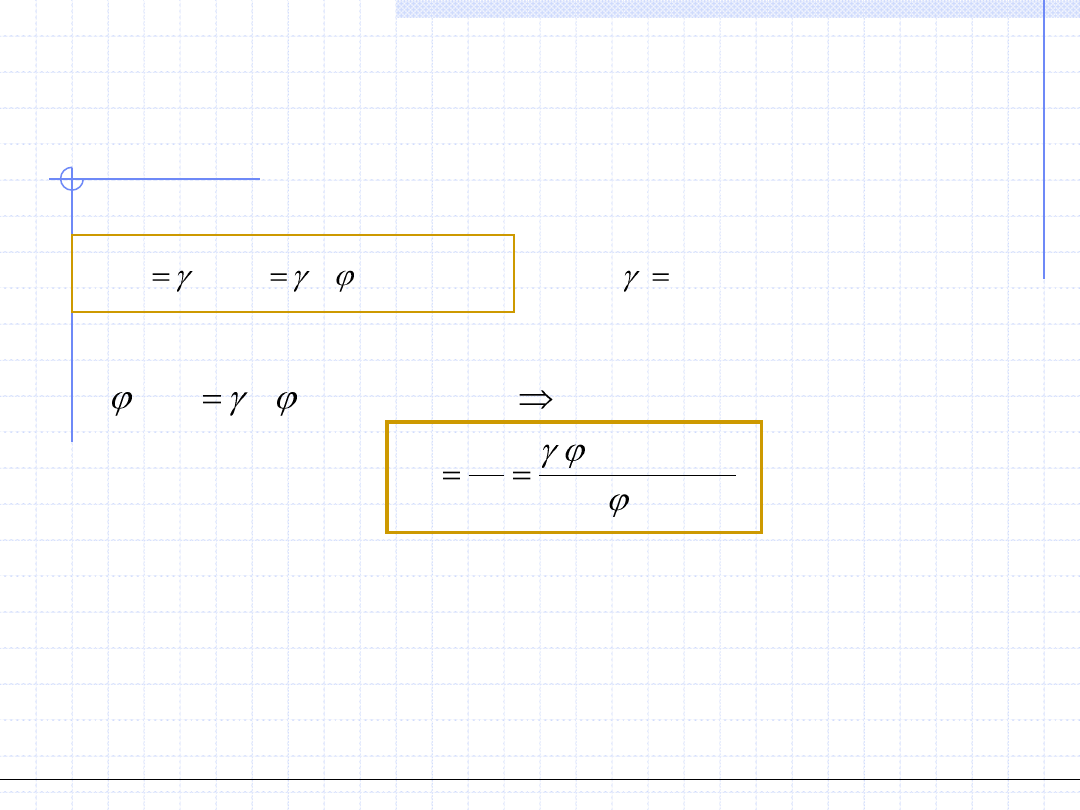
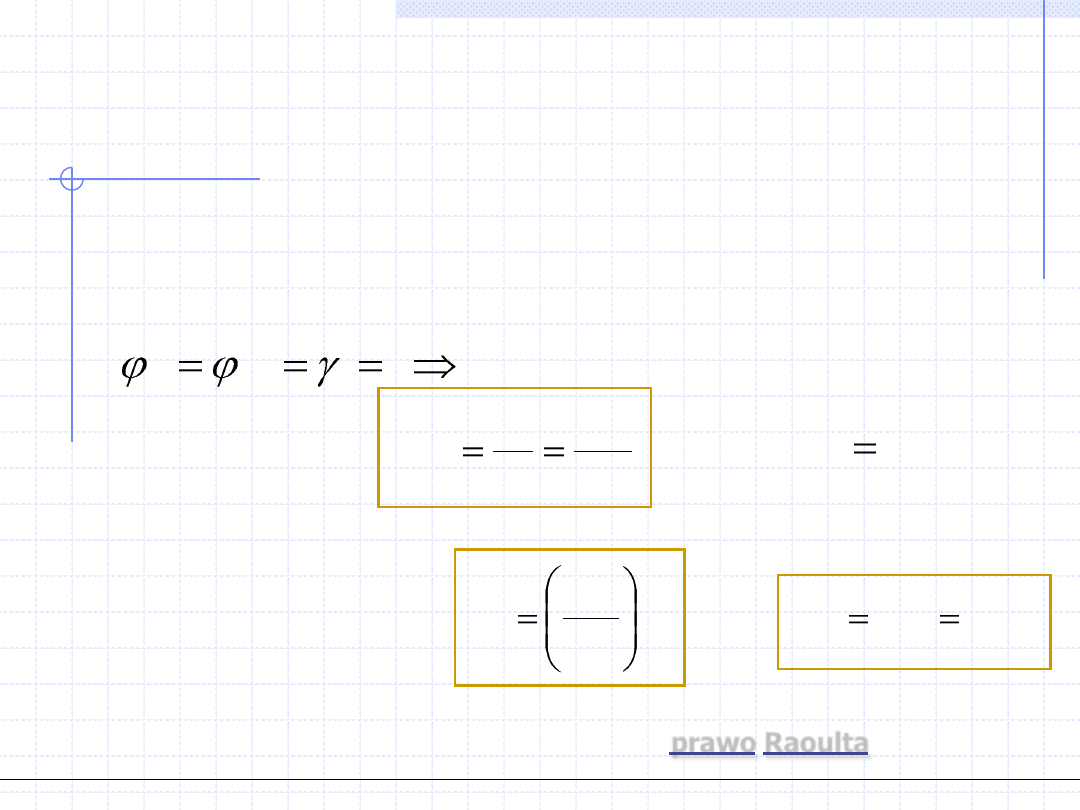
1. Metoda φ – φ
Porównanie obydwu wzorów daje:
Wzór powyższy aczkolwiek bardzo prosty w formie jest bardzo skomplikowany
i trudny w zastosowaniu. Występujące w nim współczynniki fugatywności zależą
bowiem zarówno od temperatury i ciśnienia jak i od składów obydwu faz, które
na ogół nie są znane. Występuje konieczność albo stosowania metody kolejnych
przybliżeń albo rozwiązywania układów równań z wieloma niewiadomymi.
V
i
L
i
i
i
i
x
y
K
*
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
21
Wyznaczanie stanów równowagowych cd.
)
,...,
,...,
,
,
,
(
)
(
2
1
0
0
,
0
,
0
k
i
i
i
n
i
V
n
i
i
i
L
i
i
i
L
i
x
x
x
x
T
p
f
gdzie
Po
p
x
f
x
f
)
(
0
0
,
0
,
i
n
i
V
n
i
i
i
i
V
i
Po
p
x
p
y
2. Metoda γ – φ
Porównanie obydwu wzorów daje:
Wzór powyższy umożliwia dokładne określenie stałej równowagi składnika „i”
pod warunkiem znajomości: współczynnika aktywności w fazie ciekłej - γ,
współczynnika fugatywności składnika w fazie parowej – φ oraz ciśnienia
nasycenia czystego składnika w temperaturze T i współczynnika fugatywności
pary nasyconej tego czystego składnika w tej temperaturze. Dla dokładnych
obliczeń konieczna jest jeszcze znajomość czynnika Poyntinga czystego
składnika.
p
Po
p
x
y
K
V
i
i
n
i
V
n
i
i
i
i
i
)
(
0
0
,
0
,
*
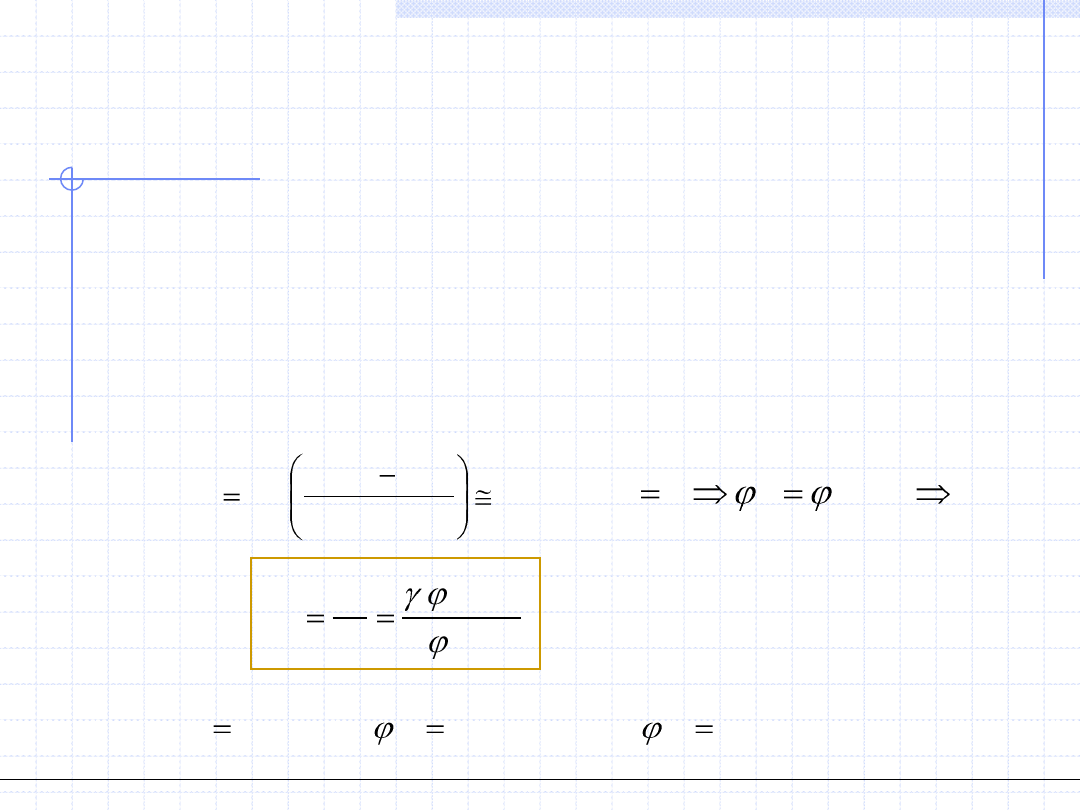
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
22
1. W zakresie umiarkowanych ciśnień możliwe są dwa uproszczenia:
- dotyczące czynnika Poyntinga
- zakładające prawo Amagata w fazie parowej
Stosowane uproszczenia wzoru
określającego równowagę fazową
1
)
(
exp
0
,
0
0
RT
p
p
v
Po
n
i
L
i
i
V
i
V
i
V
M
V
0
,
0
gdzie
p
p
x
y
K
V
i
n
i
V
n
i
i
i
i
i
0
0
,
0
,
*
W praktyce wyprowadzony powyżej wzór raczej rzadko jest stosowany
w pełnej postaci. Często stosuje się jego uproszczenia możliwe przy
pewnych dodatkowych założeniach. Teraz przedstawimy kolejne
uproszczenia zasadniczego wzoru metody γ – φ.
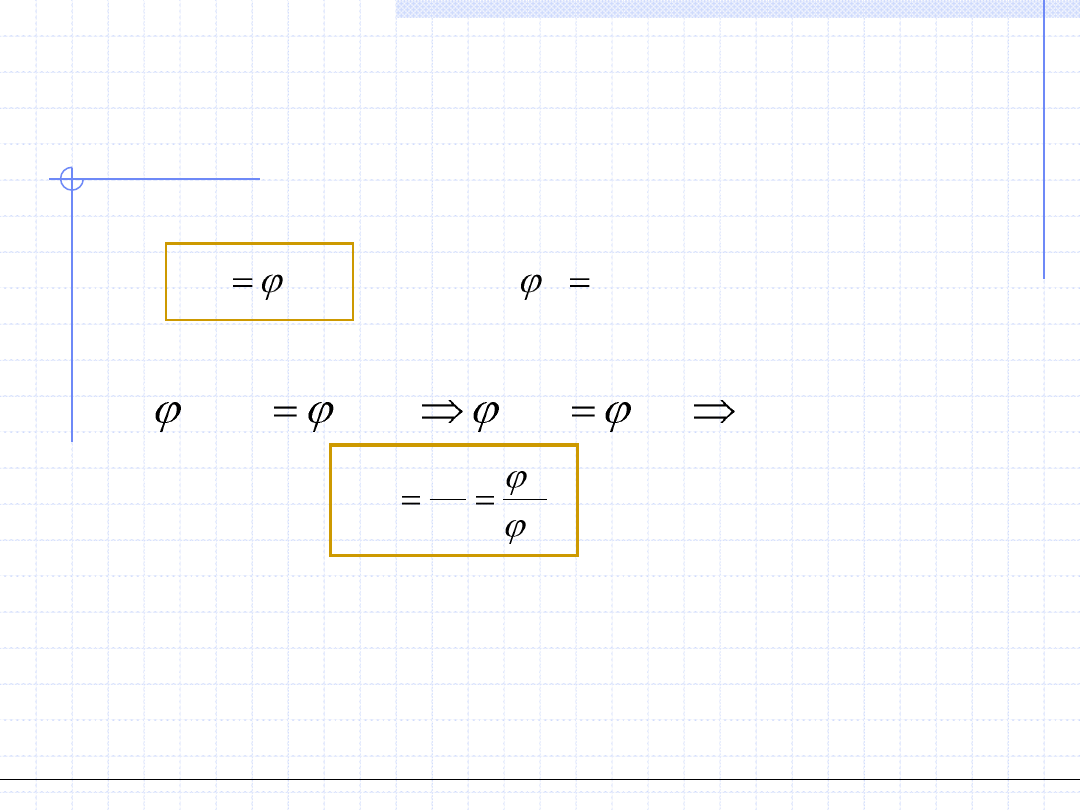
)
,
(
)
,
(
)
(
0
0
,
0
,
0
,
p
T
f
p
T
f
T
f
p
V
i
n
i
V
n
i
n
i
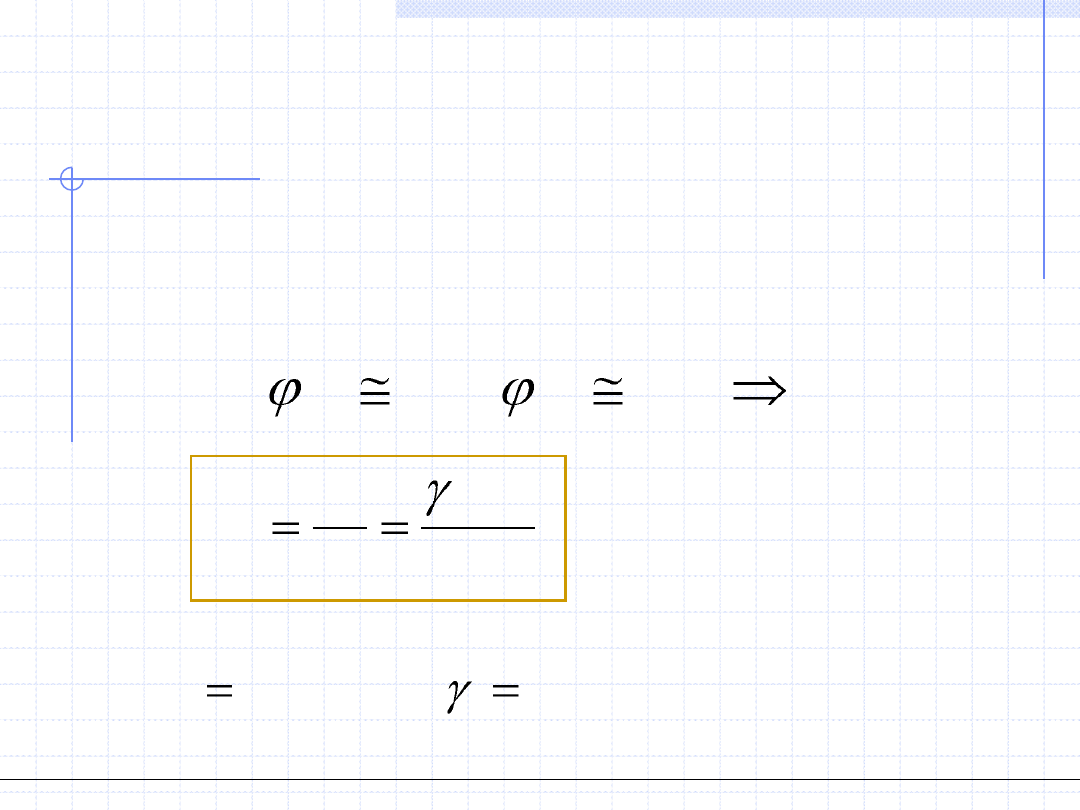
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
23
Stosowane uproszczenia wzoru
określającego równowagę fazową cd.
1
1
0
0
,
V
i
V
n
i
gdzie
p
p
x
y
K
n
i
i
i
i
i
0
,
*
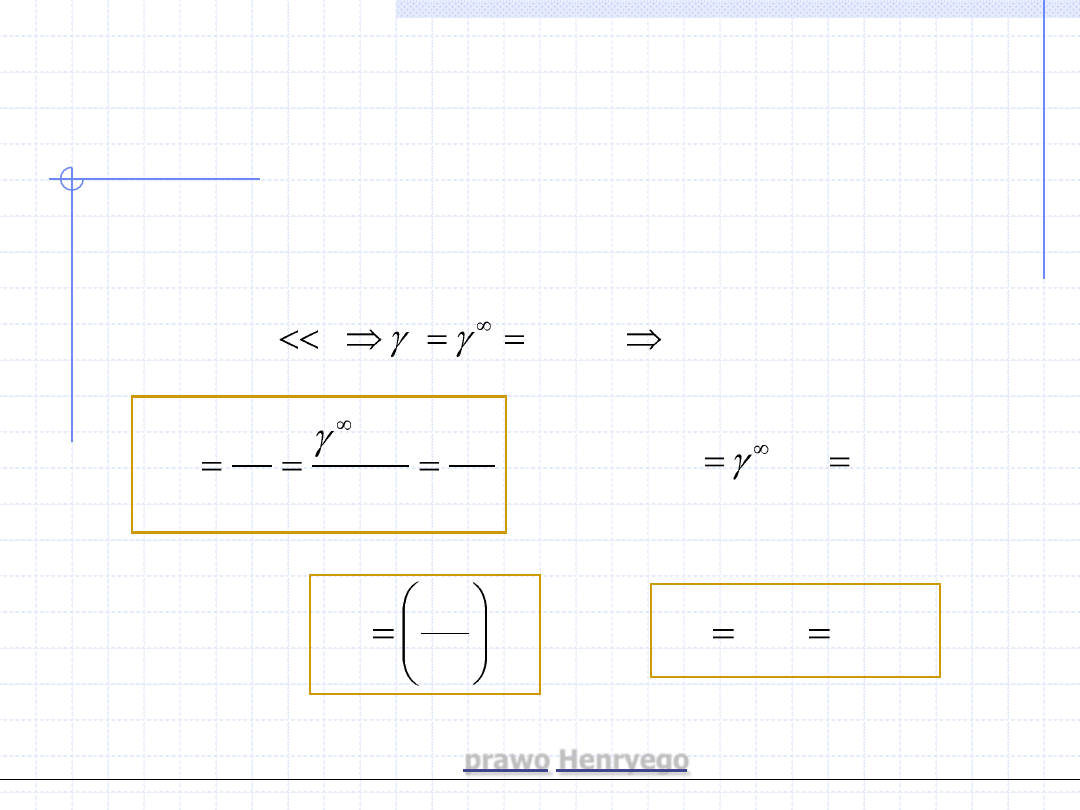
2. W zakresie niskich ciśnień dalszym uproszczeniem jest założenie, że faza
gazowa stosuje się do praw gazu doskonałego. Dla gazu doskonałego
współczynniki fugatywności stają się równe 1, zatem wzór przyjmuje
postać
)
,...,
,
,
,
(
)
(
2
1
0
,
k
i
n
i
x
x
x
T
p
f
T
f
p
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
24
i
i
i
i
i
i
i
x
H
py
p
x
p
H
y
zapis
inny
*
*
*
lub
:
Stosowane uproszczenia wzoru
określającego równowagę fazową cd.
1
.
i
i
i
x
const
0
*
,
i
i n
i
i
i
i
p
y
H
K
gdzie
x
p
p
0
,
( , )
i
i
i n
H
p
f p T
3. W zakresie niskich ciśnień oraz dla roztworów rozcieńczonych w fazie
ciekłej (x
i
<<1) dalszym uproszczeniem jest założenie, że w tym zakresie
współczynnik aktywności składnika jest wielkością stałą niezależną od
składu cieczy. Prowadzi to do:
Zakreślone wzory są zapisem bardzo ważnego prawa opisującego rozpuszczalność
gazów w cieczach. Jest to tzw. prawo Henryego.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
25
i
n
i
i
i
i
n
i
i
x
p
py
p
x
p
p
y
zapis
inny
0
,
*
*
0
,
*
lub
:
4. Najdalej idącym uproszczeniem jest przyjęcie że faza parowa stosuje
się do prawa gazów doskonałych a faza ciekła jest roztworem idealnym.
Założenie to stosujemy do całego zakresu stężeń a nie tylko do roztworów
rozcieńczonych jak w punkcie poprzednim. Zatem wszystkie współczynniki
fugatywności oraz wszystkie współczynniki aktywności stają się równe 1,
co prowadzi do
Stosowane uproszczenia wzoru
określającego równowagę fazową cd.
1
0
,
i
V
n
i
V
i
gdzie
p
p
x
y
K
n
i
i
i
i
0
,
*
)
(
0
,
T
f
p
n
i
Zakreślone wzory są zapisem bardzo ważnego prawa opisującego równowagę
destylacyjną w roztworach idealnych. Jest to tzw. prawo Raoulta.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
26
Prawa Henry’ego i Raoulta
Wyprowadzone z ogólnego warunku równowagi zależności uproszczone
znane powszechnie jako prawa Henry’ego i Raoulta mają ogromne znaczenie
w historycznym opisie procesów absorpcji i destylacji. Pierwotnie prawa te
były czysto empirycznym opisem równowagi w pewnych szczególnych układach.
Do dzisiaj określamy obszar stosowalności prawa Henry’ego i określamy
układy jako stosujące się do prawa Raoulta lub mające dodatnie albo ujemne
odchylenia od prawa Raoulta. Słownie prawa te można sformułować
w następujący sposób:
Zgodnie z prawem Henry’ego równowagowe ciśnienie cząstkowe składnika „i”
w fazie gazowej jest proporcjonalne do ułamka molowego tego składnika
w fazie ciekłej a współczynnik proporcjonalności nazywany stałą Henry’ego
zależy od temperatury i ciśnienia.
Zgodnie z prawem Raoulta równowagowe ciśnienie cząstkowe składnika „i”
w fazie gazowej jest proporcjonalne do ułamka molowego tego składnika
w fazie ciekłej a współczynnikiem proporcjonalności jest ciśnienie nasycenia
czystego składnika w danej temperaturze.

© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
William Henry 1774 – 1836
Angielski chemik, z wykształcenia lekarz.
Zmarł śmiercią samobójczą – zastrzelił się
w swojej prywatnej kaplicy.
Francois – Marie Raoult 1830 - 1901
Francuski chemik. Od roku 1867 do końca życia
był profesorem chemii w Grenoble.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
28
To tyle na dzisiaj.
Dziękuję bardzo za uwagę !
Wyszukiwarka
Podobne podstrony:
Term proc i tech WYKLAD III
Term proc i tech W X
Term proc i tech W XII
Term proc i tech W VIII
Term proc i tech W XIII
Elem. proc.tech, silniki spalinowe
Odlewnictwo Projekt, MBM, elnia, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc.tech, odlew
Narzędzia formierskie, MBM, elnia, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc.tech, odl
Spawalnictwo [1], MBM, uczelnia, VI semestr, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc
Proces technlogiczny, Proc. tech.wału.
wyklad3 tech bad
Wykład XI Metody opisu układów cyfrowych
Kapitał proc
A dane,inf,wiedza,uj dyn stat proc inf w zarz 2008 9
wyklad 29 i 30 tech bad
Wyk12 term
Wyklad XI prezentacja
Wyk4 term
Sp asp proc kom cz VII 2010
więcej podobnych podstron