© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
1
TERMODYNAMIKA
PROCESOWA I TECHNICZNA
Wykład XIII
Równowaga ciecz – para w układach
dwuskładnikowych
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
2
Równowaga fazowa w układach
dwuskładnikowych
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
3
Uwagi ogólne
Stosunkowo prosto równowagę fazową można opisać w przypadku układów
dwuskładnikowych (binarnych). W układach takich liczba stopni swobody wynosi
zgodnie z regułą faz:
s=k-f+2=2-2+2=2.
Równowaga w układzie jest zatem w pełni określona po ustaleniu dwu parametrów.
Parametrami tymi mogą być:
-ciśnienie – p
- temperatura – T
-skład fazy ciekłej – x
1
lub x
2
-skład fazy parowej – y
1
lub y
2
.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
4
Uwagi ogólne
W praktyce często rozpatrywane są sytuacje procesów izotermiczych (T=const.)
lub izobarycznych (p=const.).
Równowaga fazowa w układach binarnych jest chętnie rozpatrywana na
wykresach
zależności różnych parametrów od składu wyrażonego za pomocą ułamków
molowych. Skład taki w bardzo prosty sposób jest interpretowany za pomocą
przedziału liczb rzeczywistych [0,1].
Wartość x jest przyjmowana jako ułamek molowy składnika 1 czyli x=x
1
.
Ułamek molowy drugiego składnika x
2
=1-x
1
=1-x jest odległością danego punktu
od punktu x=1. W takiej interpretacji odcięta x=0 reprezentuje czysty składnik 1
a odcięta x=0 czysty składnik 2.
Oś odciętych może reprezentować skład fazy ciekłej, skład fazy parowej
lub jednocześnie obydwa składy.
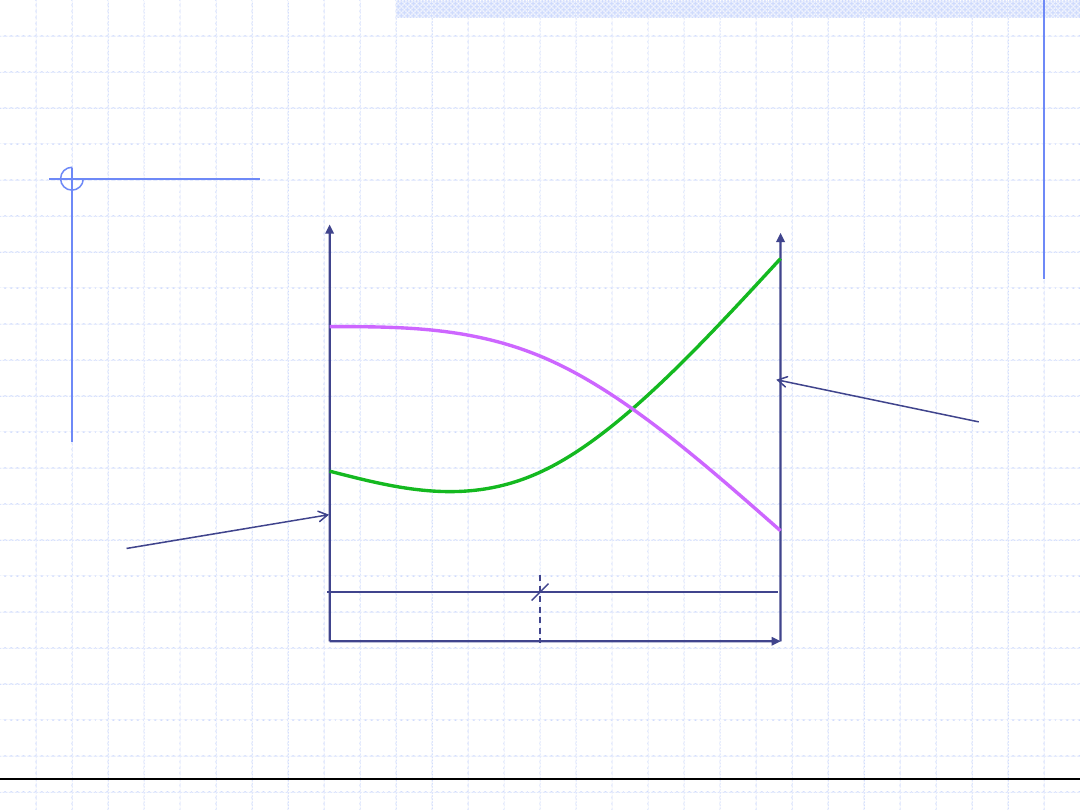
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
5
Wykresy dla układów binarnych
x=x
1
=0
y=y
1
=0
1-x=1-x
1
=x
2
=1
1-y=1-y
1
=y
2
=1
x=x
1
=1
y=y
1
=1
1-x=1-x
1
=x
2
=0
1-y=1-y
1
=y
2
=0
Dowolny parametr Y
Y(y)
Y(x)
Y
1
0V
Y
1
0L
Y
2
0L
Y
2
0V
x
1
=x
x
2
=1-x
Czysty składnik 2
Czysty składnik 1
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
6
Wykresy równowagowe dla binarnych
układów izotermicznych (T=const.)
0
,
2 n
p
0
,
1 n
p
1
0
,
1
1
x
p
p
n
x=x
1
=0
x=x
1
=1
Ciśnienie cząstkowe p
1
,p
2
i ogólne p
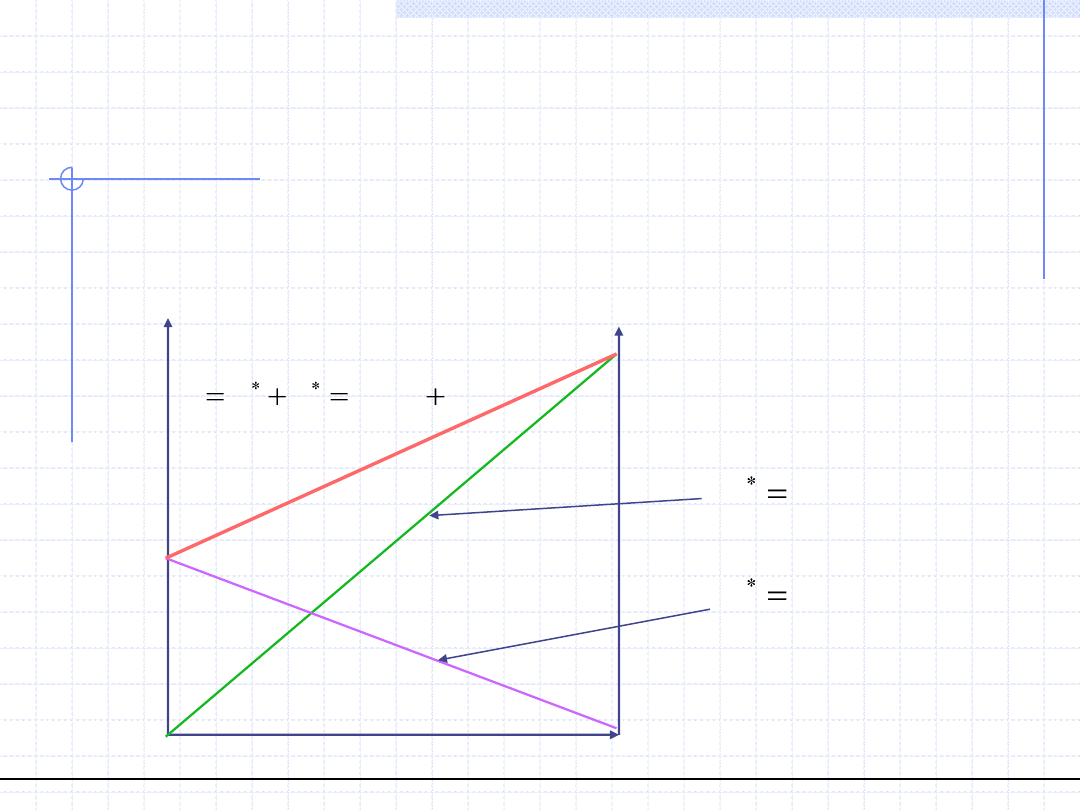
Zakładając, że układ stosuje się do prawa Raoulta wykres równowagowy
ma szczególnie prostą postać:
2
0
,
2
1
0
,
1
2
1
x
p
x
p
p
p
p
n
n
2
0
,
2
2
x
p
p
n
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
7
Wykresy równowagowe dla binarnych
układów izotermicznych (T=const.)
0
,
2 n
p
0
,
1 n
p
x=x
1
=0
x=x
1
=1
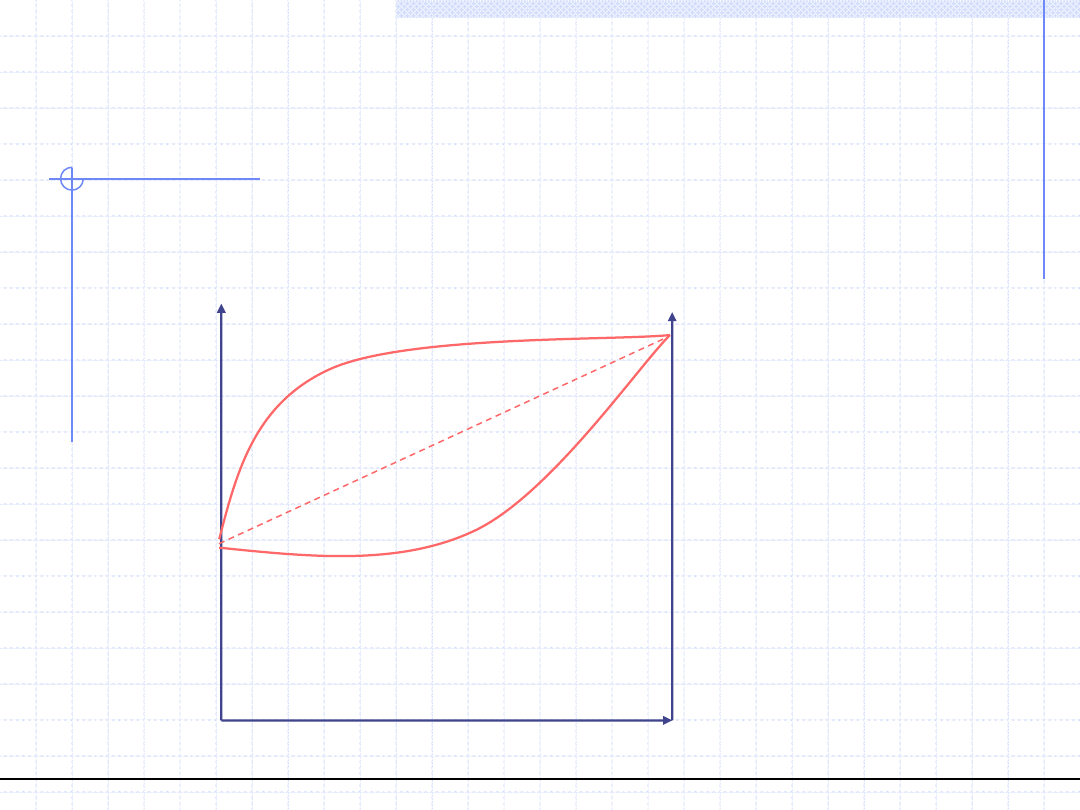
Na ogół rzeczywiste układy nie stosują się do prawa Raoulta.
Generalnie układy rzeczywiste mają dodatnie lub ujemne odchylenia od
prawa Raoulta. Odchylenia dodatnie są w przypadkach gdy rzeczywiste
ciśnienie w układzie jest wyższe niż ciśnienie wynikające z prawa Raoulta.
Ujemne odchylenia mamy w przypadku gdy rzeczywiste ciśnienie jest
niższe niż wynikające z prawa Raoulta. Na wykresie p – x wygląda to tak:
Odchylenia dodatnie
Odchylenia ujemne
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
8
Współczynnik względnej lotności
2
1
12
K
K
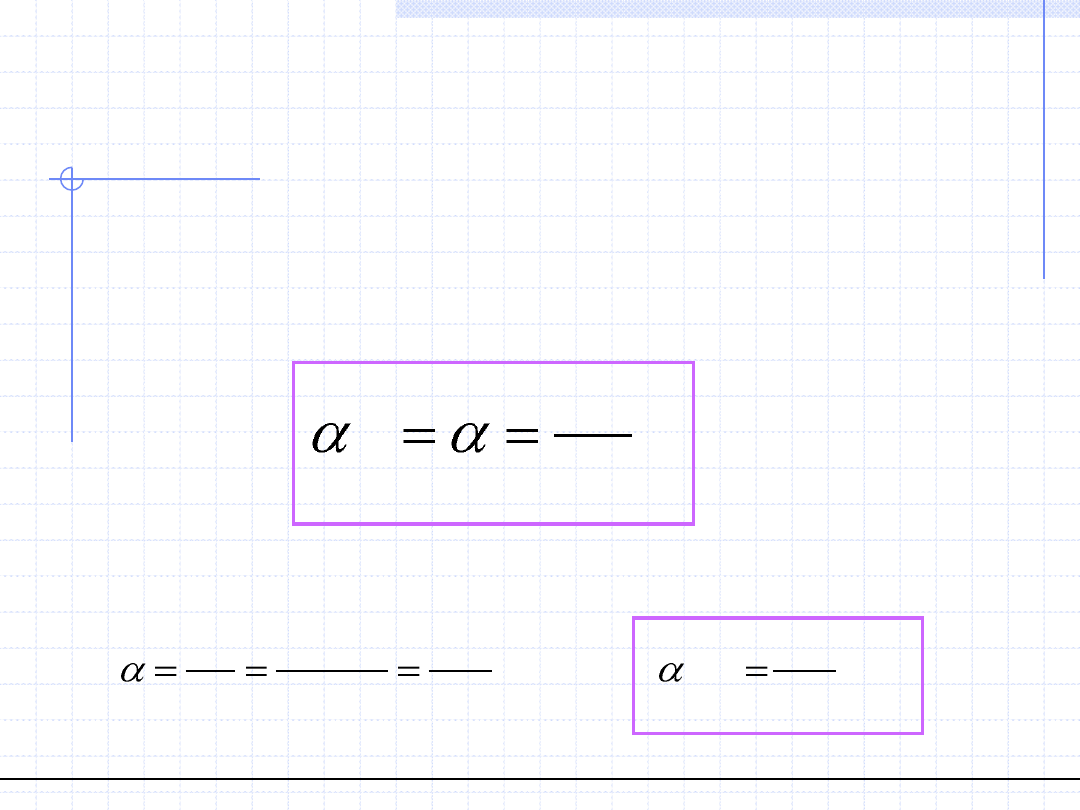
W destylacyjnych układach dwuskładnikowych przy opisie stanów równowagi
stosowany jest tzw. współczynnik względnej lotności α. Definicja tego
współczynnika wymaga wyboru jednego ze składników jako punktu odniesienia.
Najczęściej wybierany jest składnik 2 mniej lotny tzn. posiadający wyższą
temperaturę wrzenia.
Współczynnik względnej lotności jest to stosunek stałej równowagi danego
składnika do stałej równowagi wybranego wzorca. Dla składnika 1 mamy:
W przypadku układów stosujących się do prawa Raoulta wartość współczynnika
względnej lotności zależy tylko od temperatury i wynosi:
0
,
2
0
,
1
)
(
0
,
2
0
,
1
0
,
2
0
,
1
2
1
/
/
n
n
PR
n
n
n
n
p
p
p
p
p
p
p
p
K
K
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
9
Współczynnik względnej lotności cd.
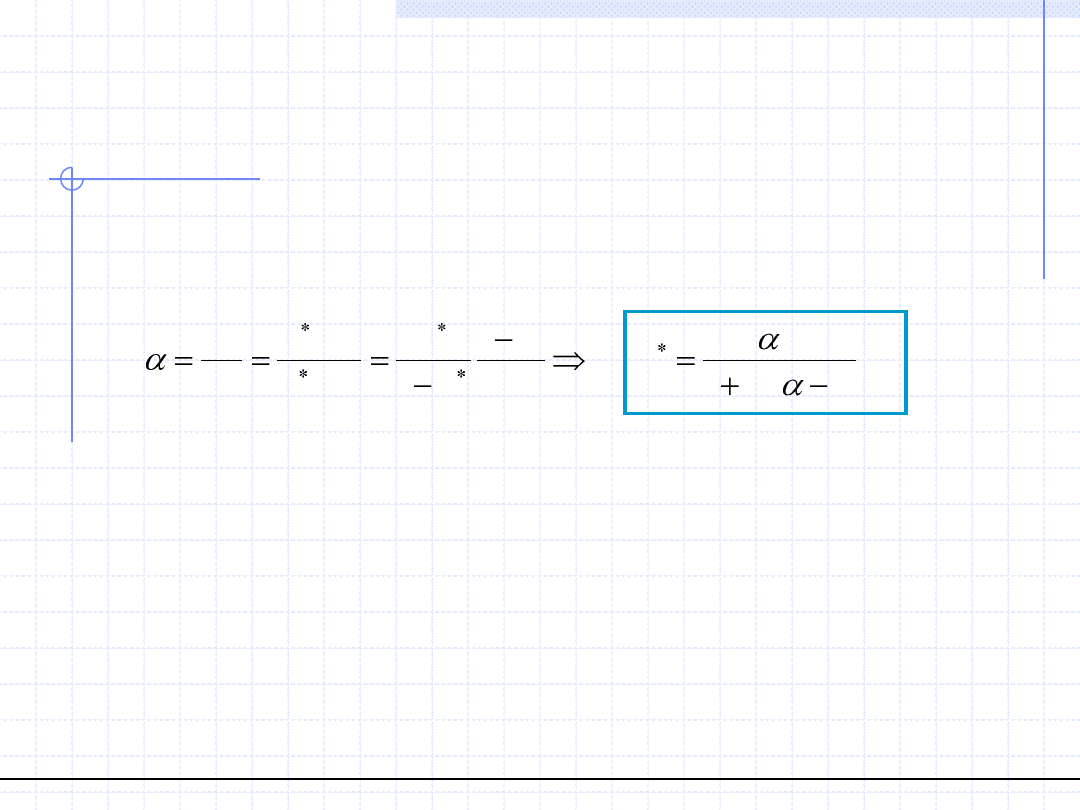
Znajomość współczynnika względnej lotności dla układu binarnego pozwala
na wyznaczenie linii równowagi w całym zakresie stężeń:
)
1
(
1
1
1
/
/
1
1
1
1
1
1
1
2
2
1
1
2
1
x
x
y
x
x
y
y
x
y
x
y
K
K
Otrzymane równanie przedstawia linię równowagi w binarnym układzie
destylacyjnym i nosi nazwę równania Fenskego. Parametrem w tym równaniu
jest wsp. α.
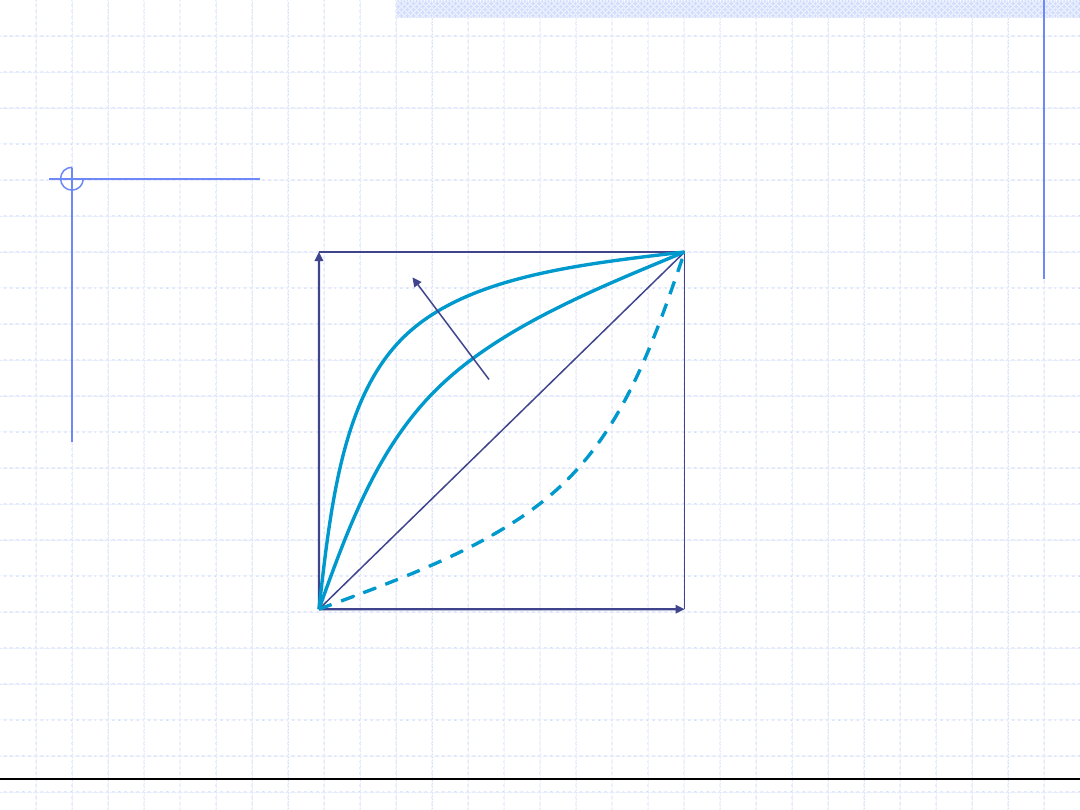
Linię równowagi w układach destylacyjnych tzn. funkcję y
*
=f(x) często rysuje
się w kwadracie jednostkowym:
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
10
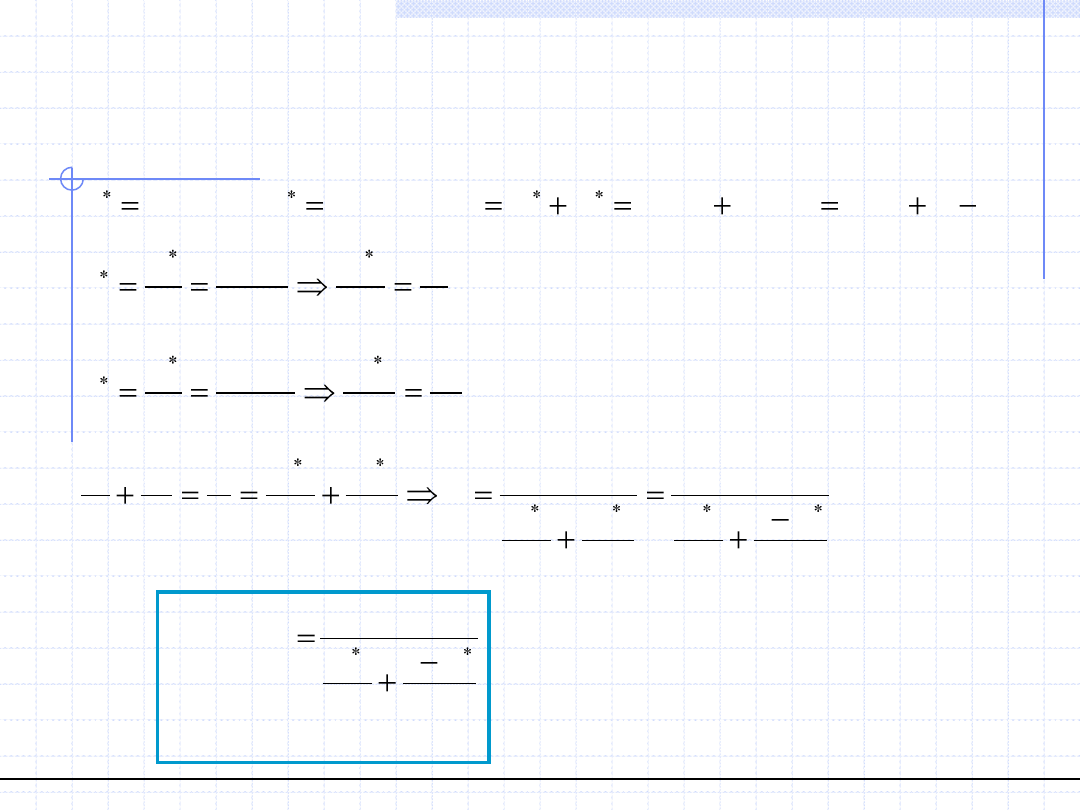
Linia równowagi w binarnym układzie
destylacyjnym x - y
x
1
=x
y
1
*
=y
α>1
α<1
T=const., prawo Raoulta => α=const.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
11
Zależność ciśnienia od składu fazy
parowej dla układów stosujących się do
prawa Raoulta
0
0
0
0
0
0
1
1
1,
2
2
2,
1
2
1
1,
2
2,
1,
2,
0
1
1,
1
1
1
1
0
1,
0
2
2,
2
2
2
2
0
2,
1
2
1
2
0
0
1
2
1,
2,
0
0
0
0
1,
2,
1,
2,
*
(1
)
1
1
1
1
1
(
)
n
n
n
n
n
n
n
n
n
n
n
n
n
n
n
n
p
x p
p
x p
p
p
p
x p
x p
xp
x p
x p
p
y
x
y
p
p
p
p
x p
p
y
x
y
p
p
p
p
x
x
y
y
p
y
y
y
y
p
p
p
p
p
p
p
p
p
p y
0
0
1,
2,
1
n
n
y
y
p
p
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
12
Wykresy równowagowe p – (x,y)
dla T=const.
0
,
2 n
p
0
,
1 n
p
x=x
1
=0
y=y
1
=0
x=x
1
=1
y=y
1
=1
p=x
1
p
1
0
+x
2
p
2
0
(prawo Raoulta)
p=f(x
1
), (dodatnie
odchylenie od pr. R.)
p=1/(y
1
/p
1
0
+y
2
/p
2
0
)
(prawo Raoulta)
p=f(y
1
), (dodatnie
odchylenie od pr. R.)
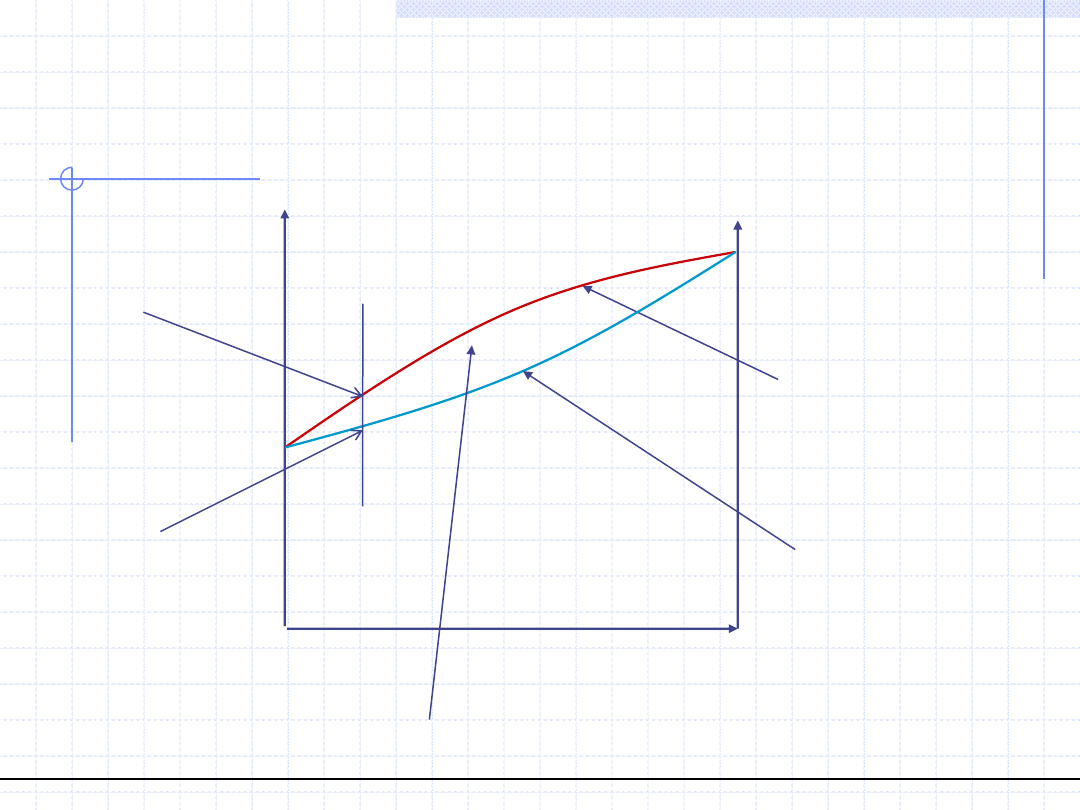
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
13
Wykresy równowagowe p – (x,y)
dla T=const.
0
,
2 n
p
0
,
1 n
p
x=x
1
=0
y=y
1
=0
x=x
1
=1
y=y
1
=1
Ciecz przechłodzona
Para przegrzana
p=f(x
1
), (dodatnie
odchylenie od pr. R.)
p=f(y
1
), (dodatnie
odchylenie od pr. R.)
Obszar dwufazowy (ciecz nasycona + para nasycona)
Ciśnienie, przy którym
skrapla się para o składzie y
Ciśnienie, przy którym wrze
ciecz o składzie x=y
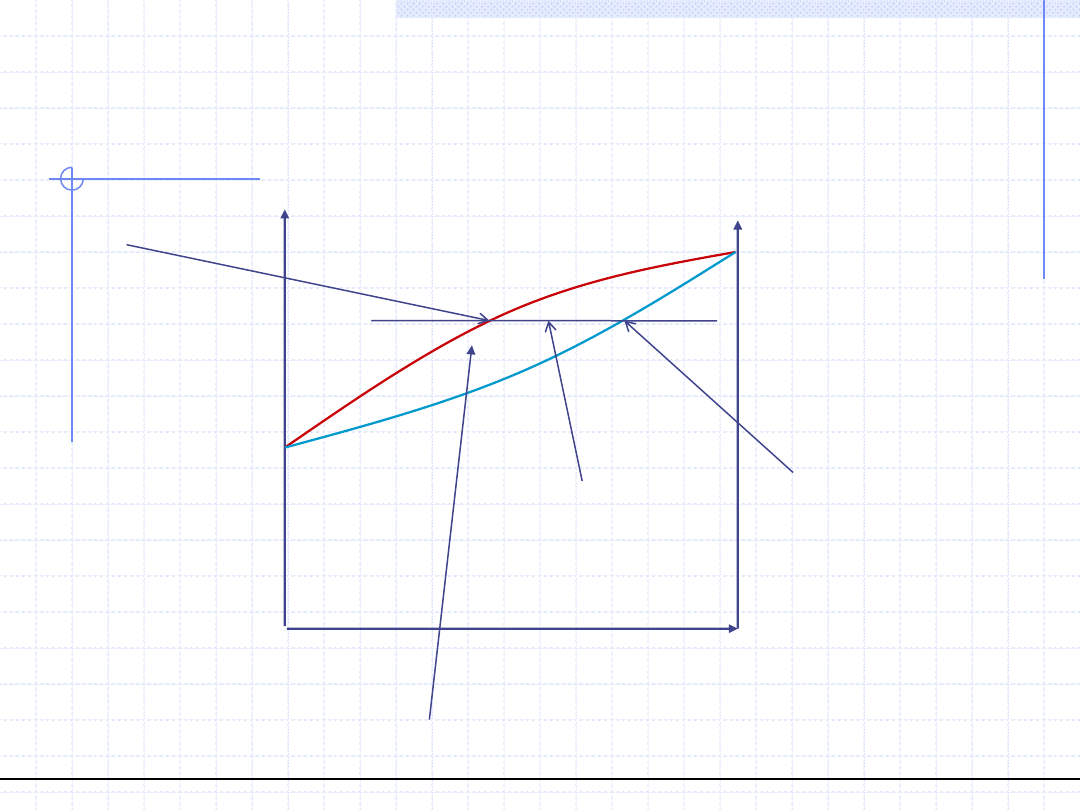
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
14
Wykresy równowagowe p – (x,y)
dla T=const.
0
,
2 n
p
0
,
1 n
p
x=x
1
=0
y=y
1
=0
x=x
1
=1
y=y
1
=1
Ciecz przechłodzona
Para przegrzana
Obszar dwufazowy (ciecz nasycona + para nasycona)
Punkt skraplania
pary przy ciśnieniu p
Punkt wrzenia cieczy przy
ciśnieniu p
y
*
>x, K>1, α>1
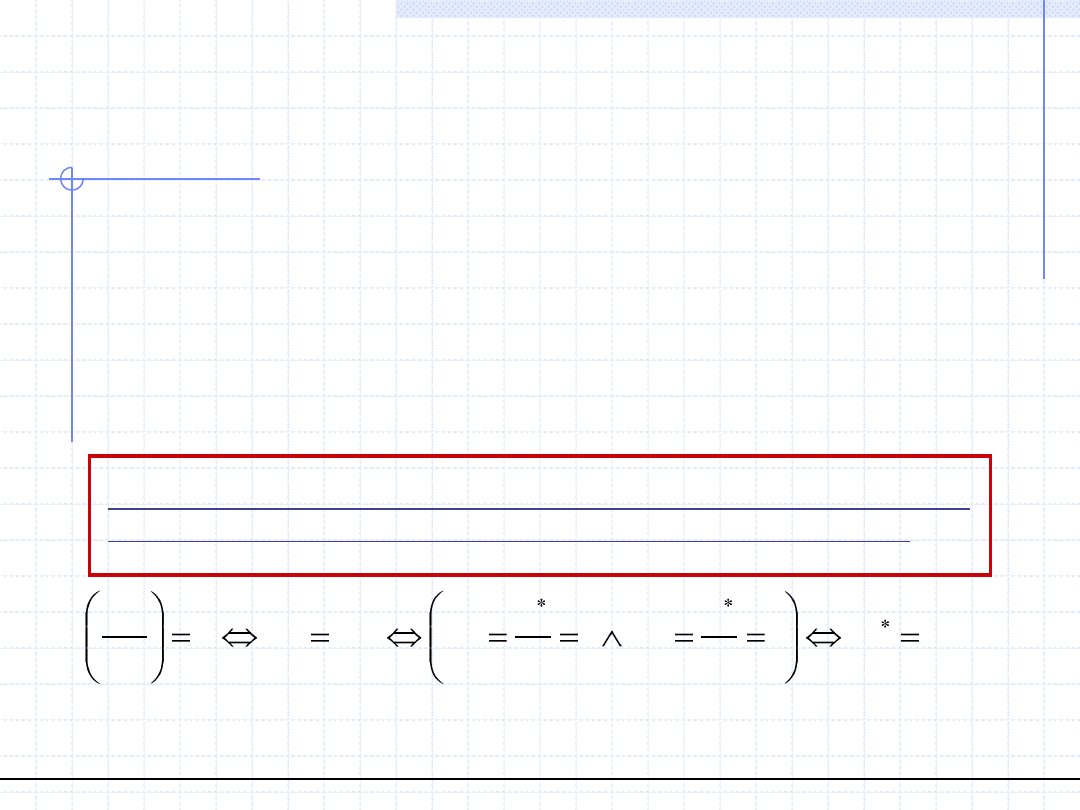
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
15
Układy azeotropowe
Krzywa p(x) dla układów z odchyleniami od prawa Raoulta może przebiegać
w różny sposób. W szczególności może ona wykazywać ekstrema:
maksimum dla odchyleń dodatnich i minimum dla odchyleń ujemnych.
Układ, w którym występuje ekstremum nazywamy układem azeotropowym
a konkretny skład roztworu, w którym mamy ekstremum składem
azeotropowym. Zgodnie z rodzajem odchyleń od prawa Raoulta mamy
azeotropy dodatnie i ujemne.
Fundamentalna o ogromnym znaczeniu własność roztworów azeotropowych
dotyczy stałej równowagi w punkcie azeotropowym.
Można wykazać że w punkcie azeotropowym układu dwuskładnikowego
stała równowagi obydwu składników wynosi 1 co oznacza że skład
równowagowy fazy parowej jest taki sam jak skład cieczy.
Z powyższego faktu wynika, że roztworu o składzie azeotropowym nie można
rozdzielić za pomocą destylacji.
)
(
1
1
)
(
0
2
2
2
1
1
1
1
1
a
a
a
x
y
x
y
K
x
y
K
x
x
dx
dp
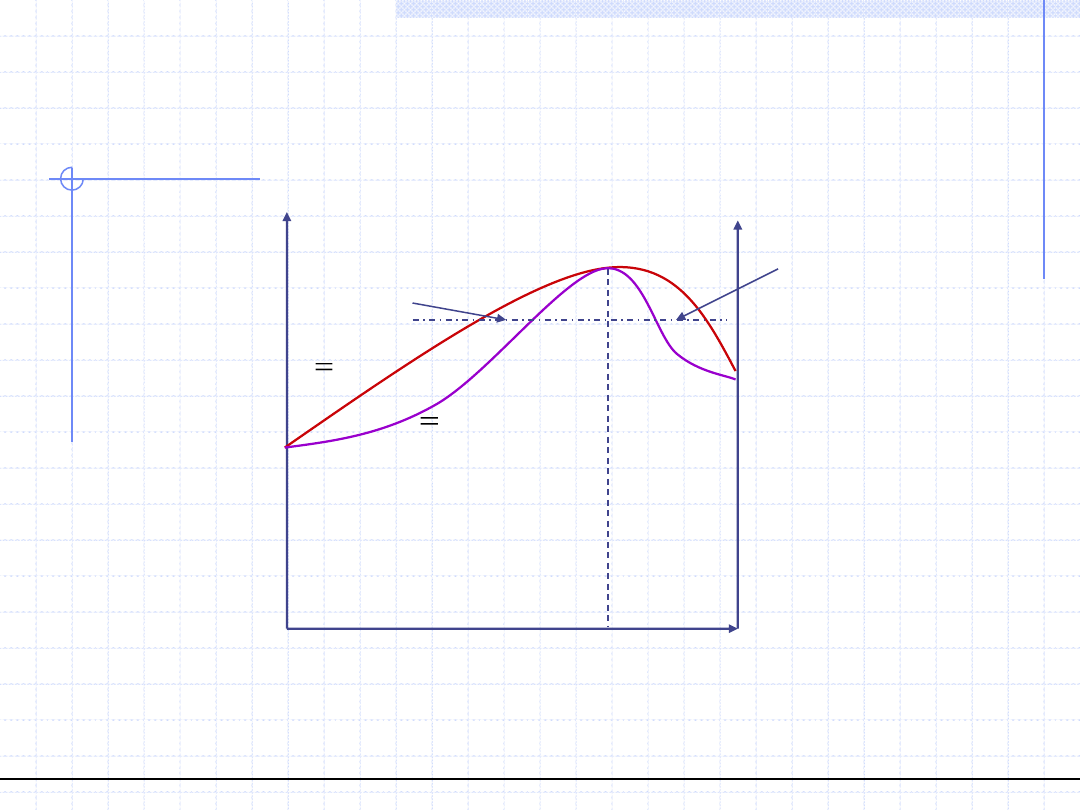
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
16
Wykresy równowagowe p – (x,y) dla
układów azeotropowych (T=const.)
)
(x
f
p
0
,
2 n
p
0
,
1 n
p
x=x
1
=0
y=y
1
=0
x=x
1
=1
y=y
1
=1
x
1
=x
a
)
( y
f
p
y
*
>x, K>1
y*<x, K<1
Dodatnie odchylenia od prawa Raoulta
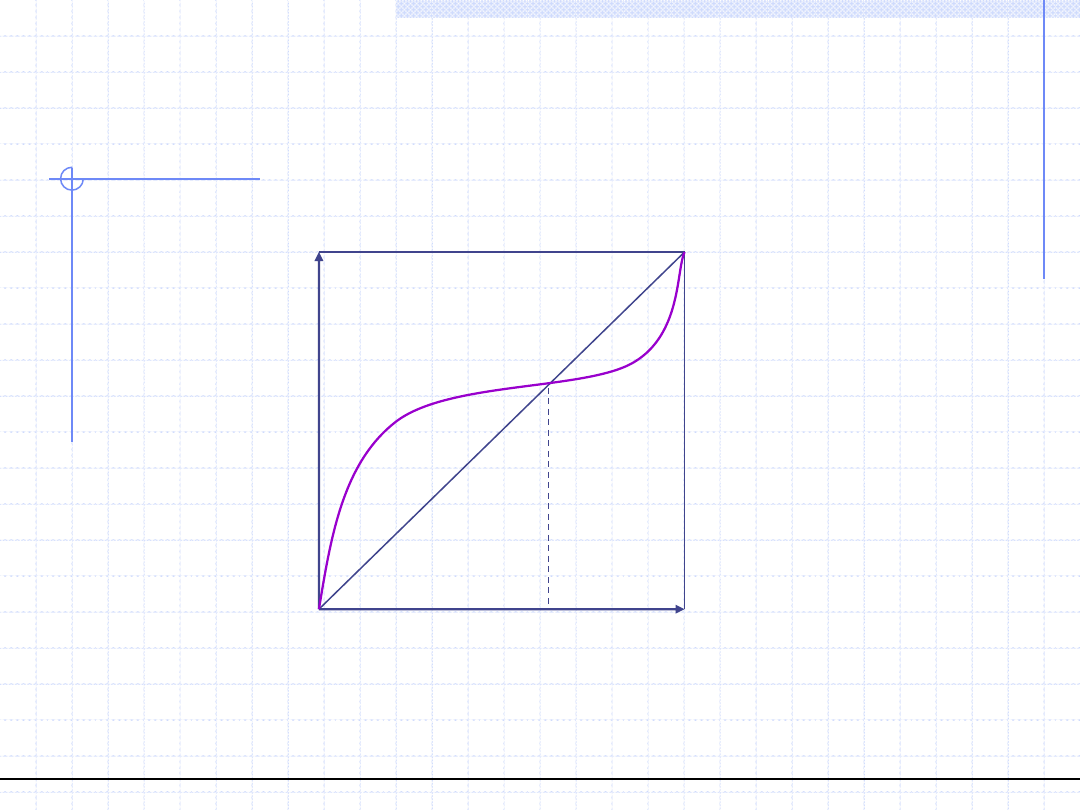
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
17
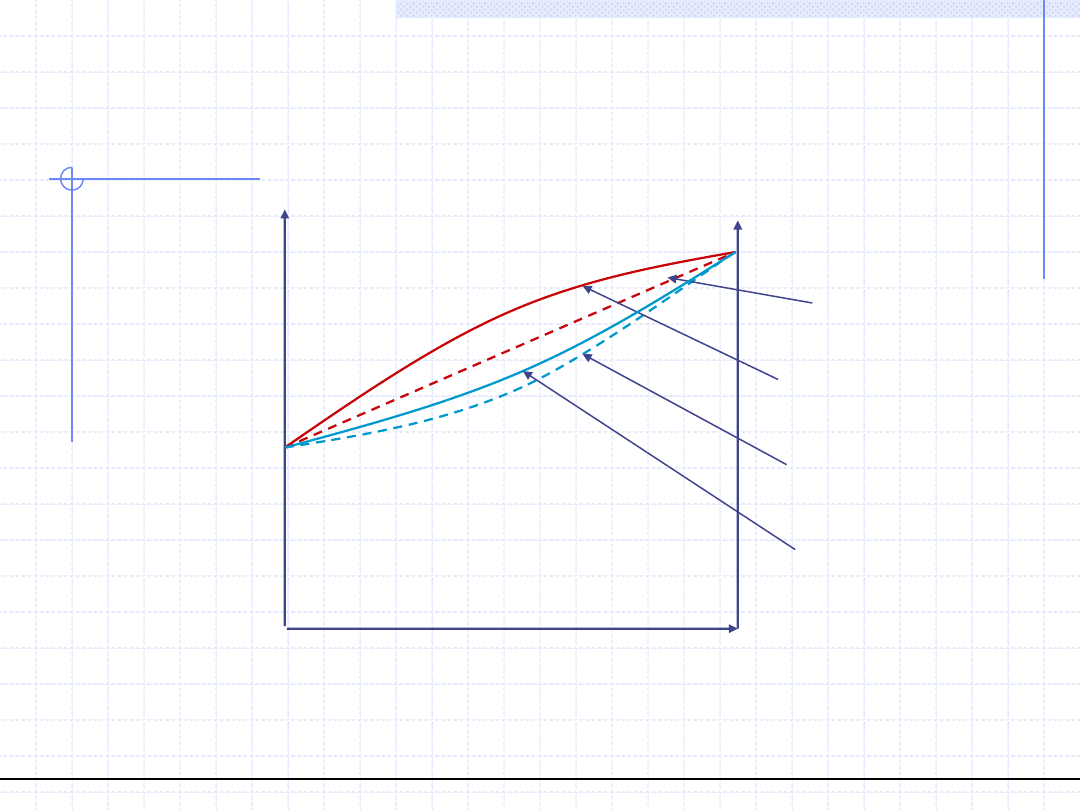
Wykres równowagowy y – x dla
układów azeotropowych (T=const.)
x
1
=x
y
1
*
=y
x
1
=x
a
=y
a
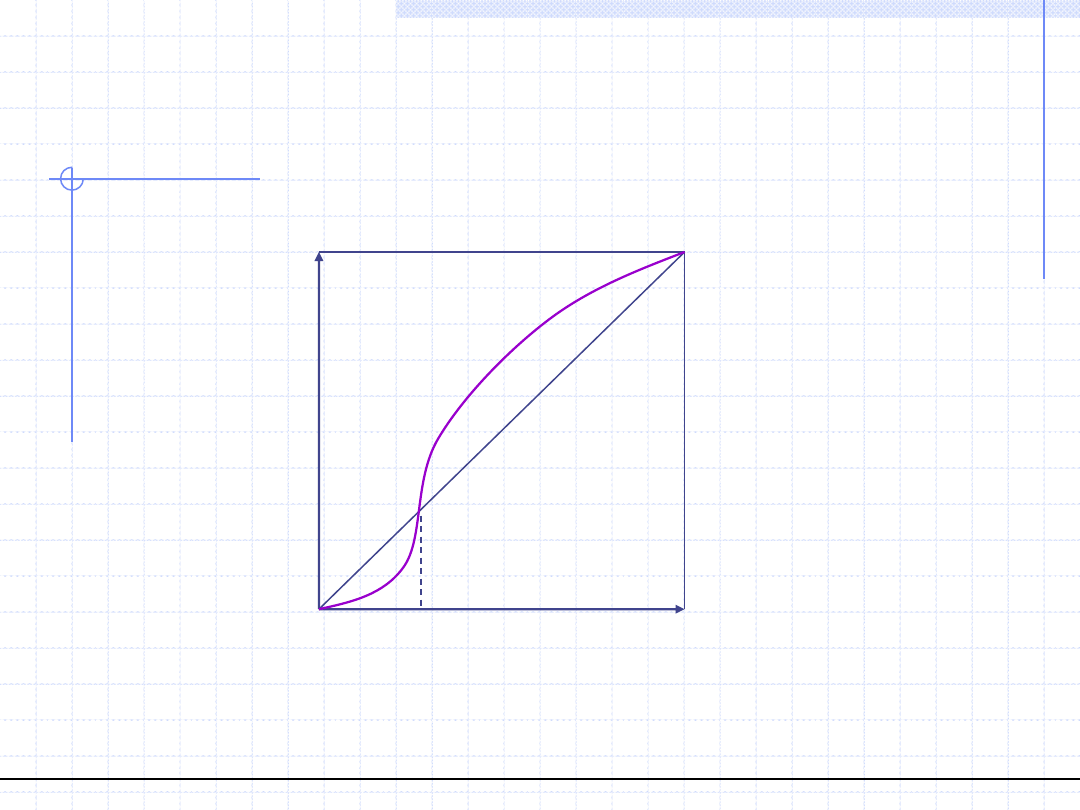
Azeotrop dodatni
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
18
Wykresy równowagowe p – (x,y) dla
układów azeotropowych (T=const.)
)
(x
f
p
0
,
2 n
p
0
,
1 n
p
x=x
1
=0
y=y
1
=0
x=x
1
=1
y=y
1
=1
x
1
=x
a
)
( y
f
p
y
*
<x, K<1
y*>x, K>1
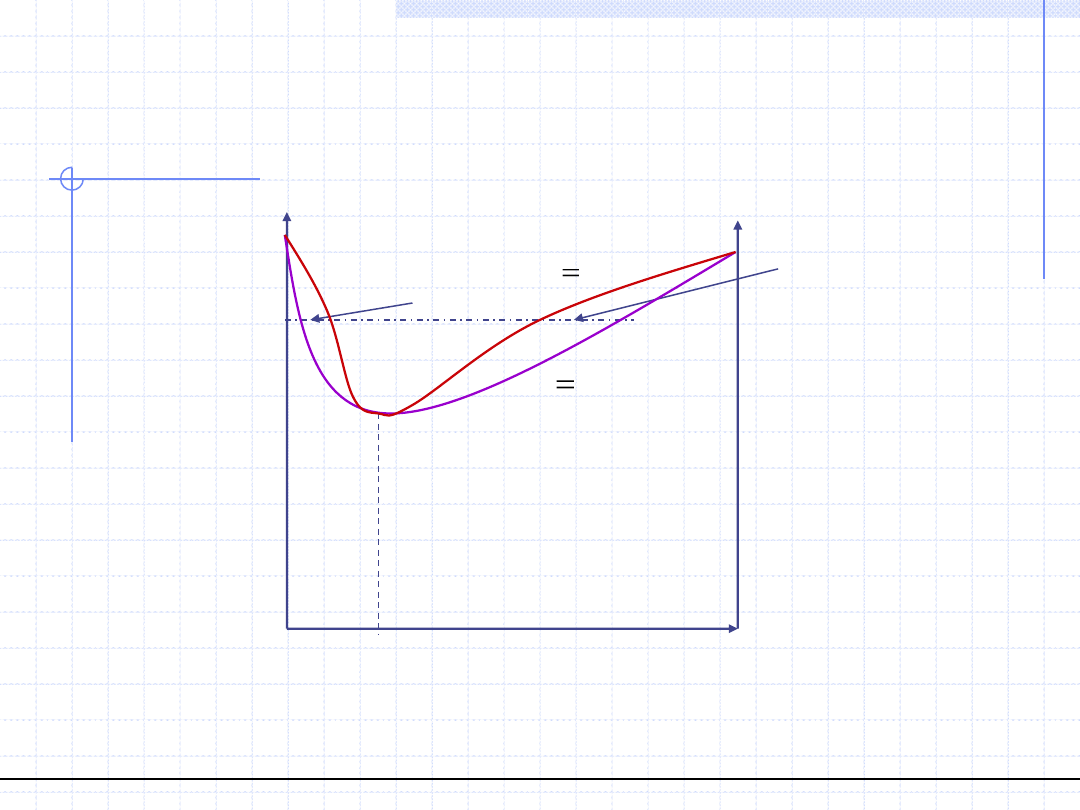
Ujemne odchylenia od prawa Raoulta
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
19
Wykres równowagowy y – x dla
układów azeotropowych (T=const.)
x
1
=x
y
1
*
=y
x
1
=x
a
=y
a
Azeotrop ujemny
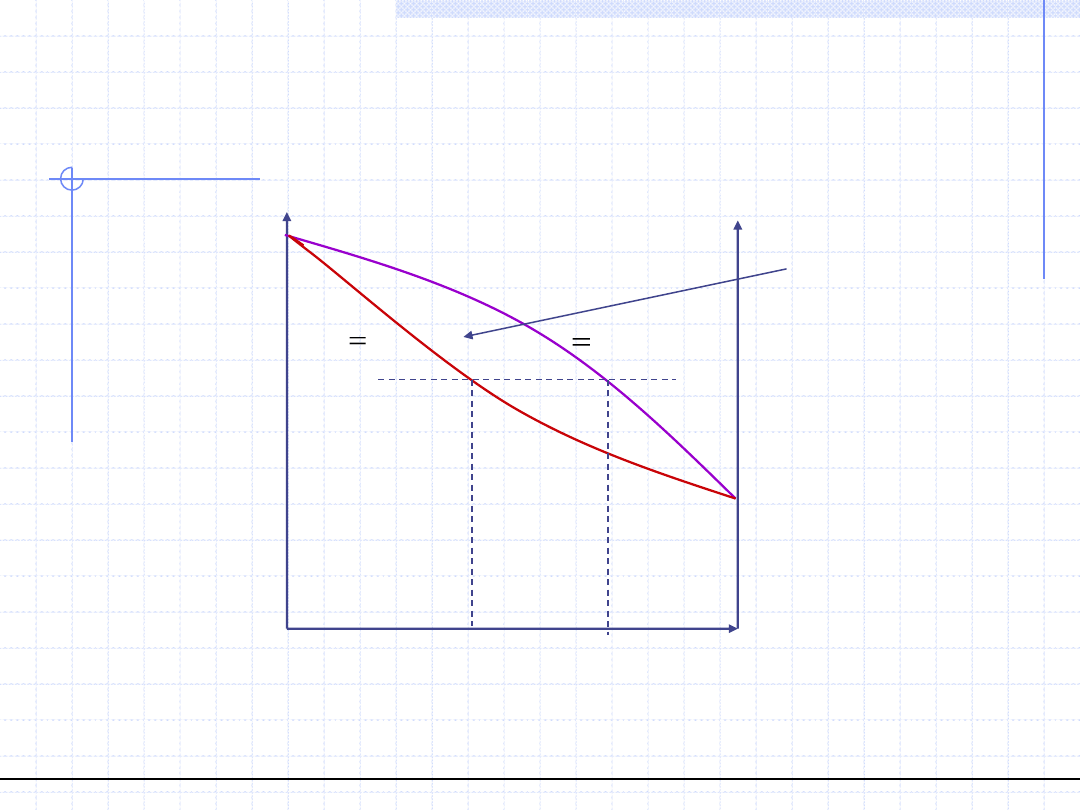
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
20
Wykresy równowagowe T – (x,y)
(p=const.)
)
(x
f
T
0
.
,
2 wrz
T
0
.
,
1 wrz
T
x=x
1
=0
y=y
1
=0
x=x
1
=1
y=y
1
=1
)
( y
f
T
x
1
=x
y
*
Ciecz przechłodzona
Para przegrzana
Ciecz nasycona +
para nasycona
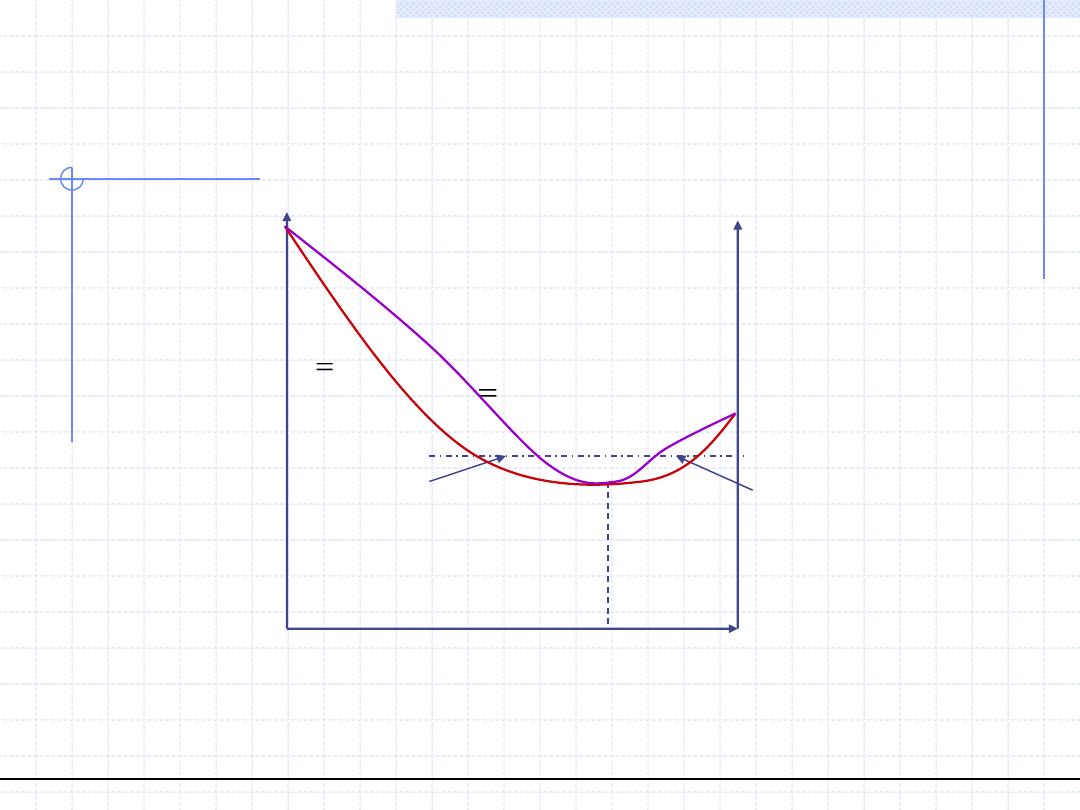
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
21
Wykresy równowagowe T – (x,y) dla
układów azeotropowych (p=const.)
)
(x
f
T
0
.
,
2 wrz
T
0
.
,
1 wrz
T
x=x
1
=0
y=y
1
=0
x=x
1
=1
y=y
1
=1
x
1
=x
a
)
( y
f
T
y
*
>x, K>1, α>1
y*<x, K<1, α<1
Dodatnie odchylenia od prawa Raoulta
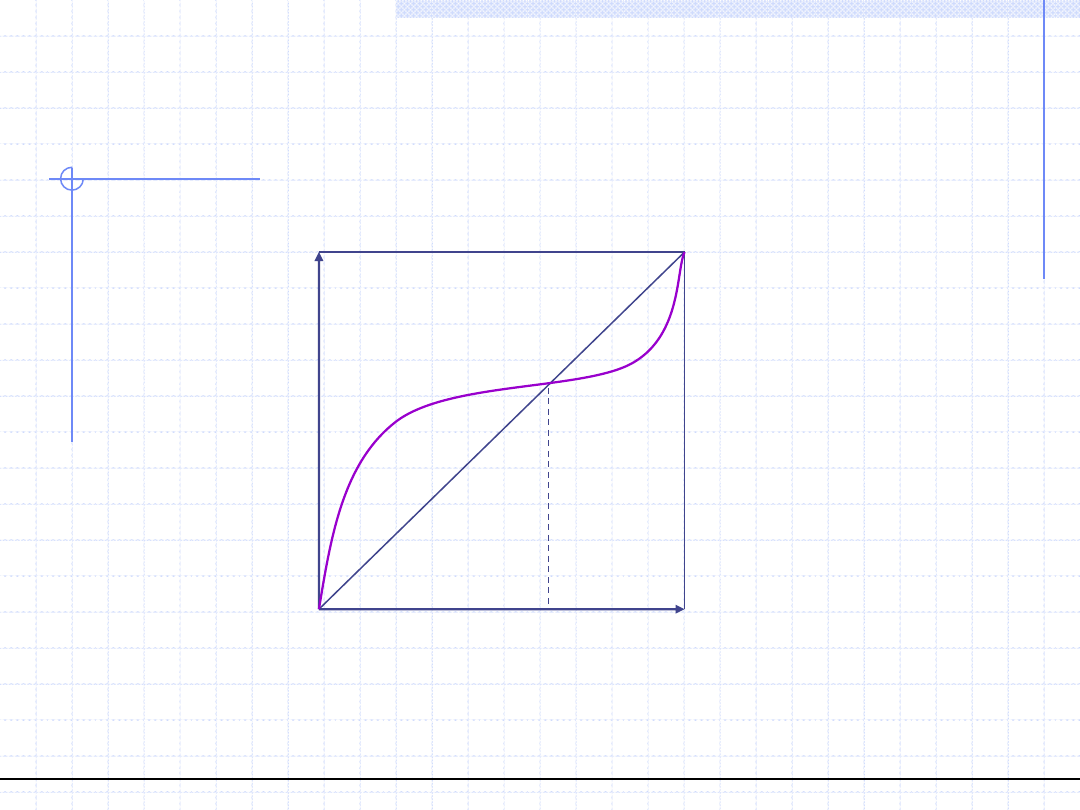
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
22
Wykres równowagowy y – x dla
układów azeotropowych (p=const.)
x
1
=x
y
1
*
=y
x
1
=x
a
=y
a
Azeotrop dodatni
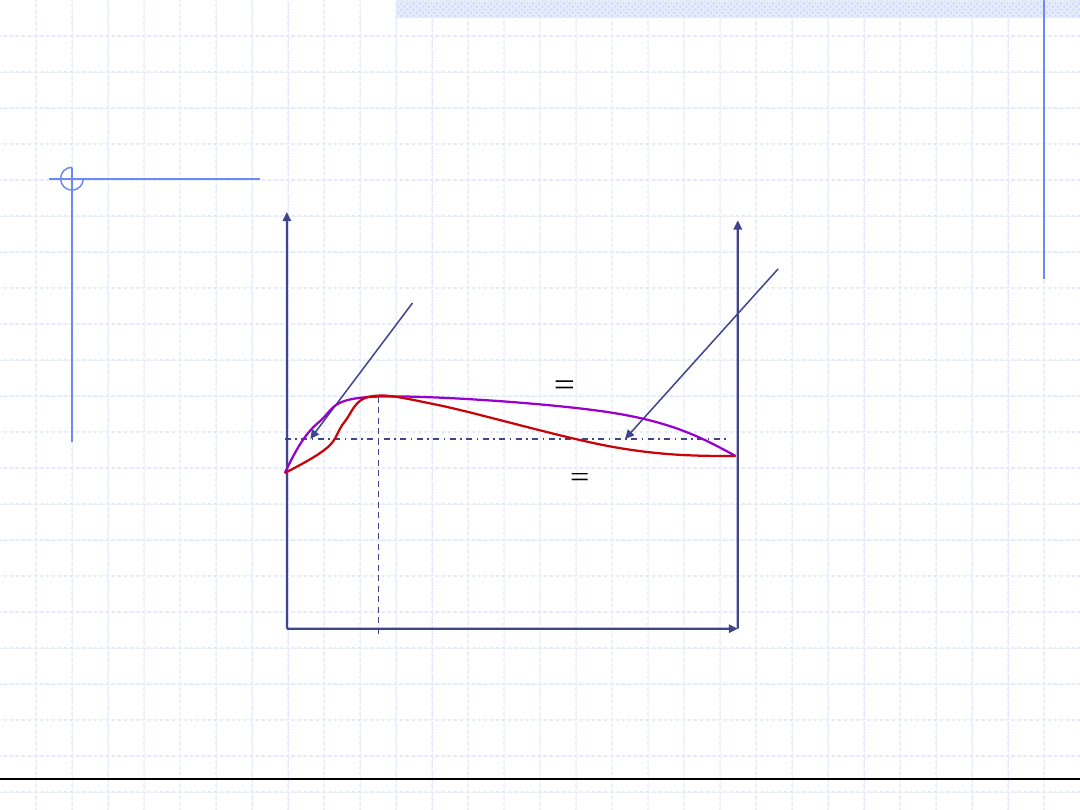
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
23
Wykresy równowagowe T – (x,y) dla
układów azeotropowych (p=const.)
)
(x
f
T
0
.
,
2 wrz
T
0
.
,
1 wrz
T
x=x
1
=0
y=y
1
=0
x=x
1
=1
y=y
1
=1
x
1
=x
a
)
( y
f
T
y
*
<x, K<1, α<1
y*>x, K>1, α>1
Ujemne odchylenia od prawa Raoulta
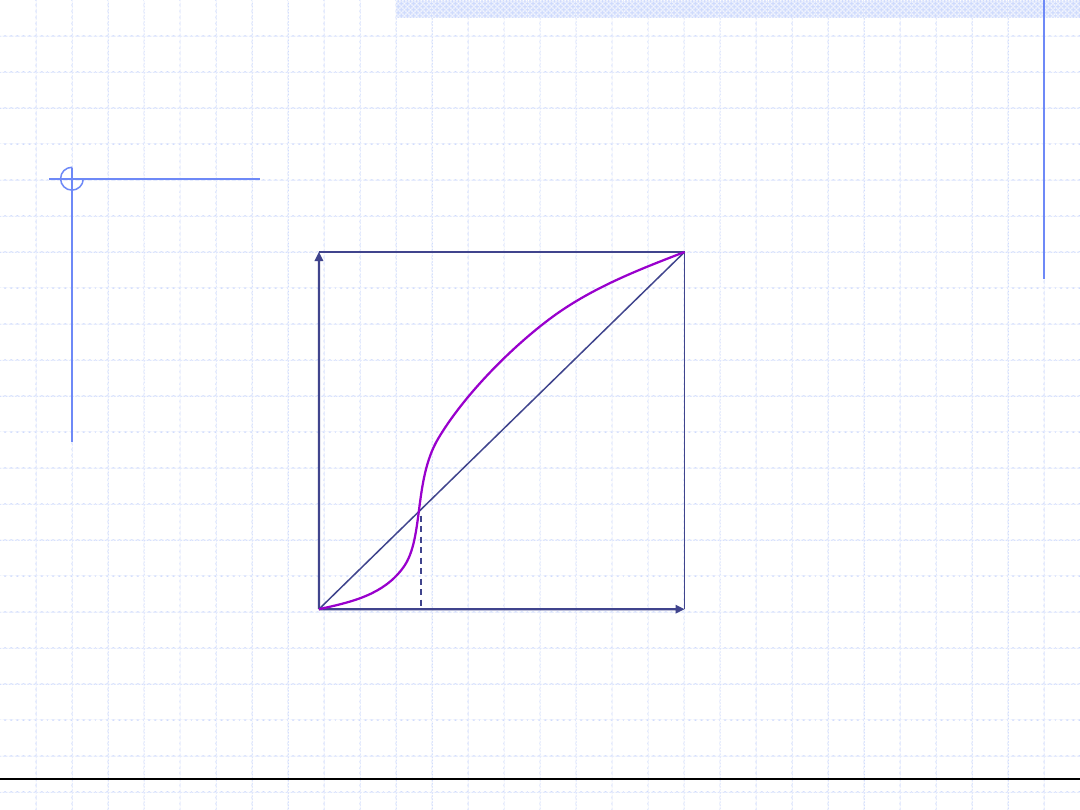
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
24
Wykres równowagowy y – x dla
układów azeotropowych (p=const.)
x
1
=x
y
1
*
=y
x
1
=x
a
=y
a
Azeotrop ujemny
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
25
Na tym kończymy wykłady z „Termodynamiki
procesowej i technicznej”. Dziękuję bardzo Państwu
za uwagę i życzę powodzenia na egzaminie,
który odbędzie się:
27.01.2014 godz. 10.15 – 12.00 s. B1 F4 termin „0”
07.02.2014 godz. 8.00 - 10.00 s. 310 A2 I termin
17.02.2014 godz. 9.00 – 11.00 s. B1 F4 II termin
Wyszukiwarka
Podobne podstrony:
Term proc i tech WYKLAD III
Term proc i tech W X
Term proc i tech W XII
Term proc i tech W XI
Term proc i tech W VIII
Elem. proc.tech, silniki spalinowe
Odlewnictwo Projekt, MBM, elnia, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc.tech, odlew
Narzędzia formierskie, MBM, elnia, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc.tech, odl
Spawalnictwo [1], MBM, uczelnia, VI semestr, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc
Proces technlogiczny, Proc. tech.wału.
Adiuw XIII
wyklad3 tech bad
Sztuka romańska w Europie Zachodniej (X XIII w 2
Kapitał proc
A dane,inf,wiedza,uj dyn stat proc inf w zarz 2008 9
wyklad 29 i 30 tech bad
Wyk12 term
Wyk4 term
Sp asp proc kom cz VII 2010
więcej podobnych podstron