© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
TERMODYNAMIKA
PROCESOWA I TECHNICZNA
Wykład X
Wyznaczanie wielkości cząstkowych
Równania stanu dla roztworów
Fugatywność w roztworach
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
2
Komunikat
Egzamin z „Termodynamiki procesowej i technicznej”
w semestrze zimowym 2013/14 odbędzie się
w terminach:
PN 27.01.2014 10.15 – 12.15 s. B-1 F-4 termin „0”
PT 7.02.2014
8.00 – 10.00 s. 310 A-2 I termin
PN 17.02.2014 9.00 – 11.00 s. B-1 F-4 II termin
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wielkości cząstkowe cd.
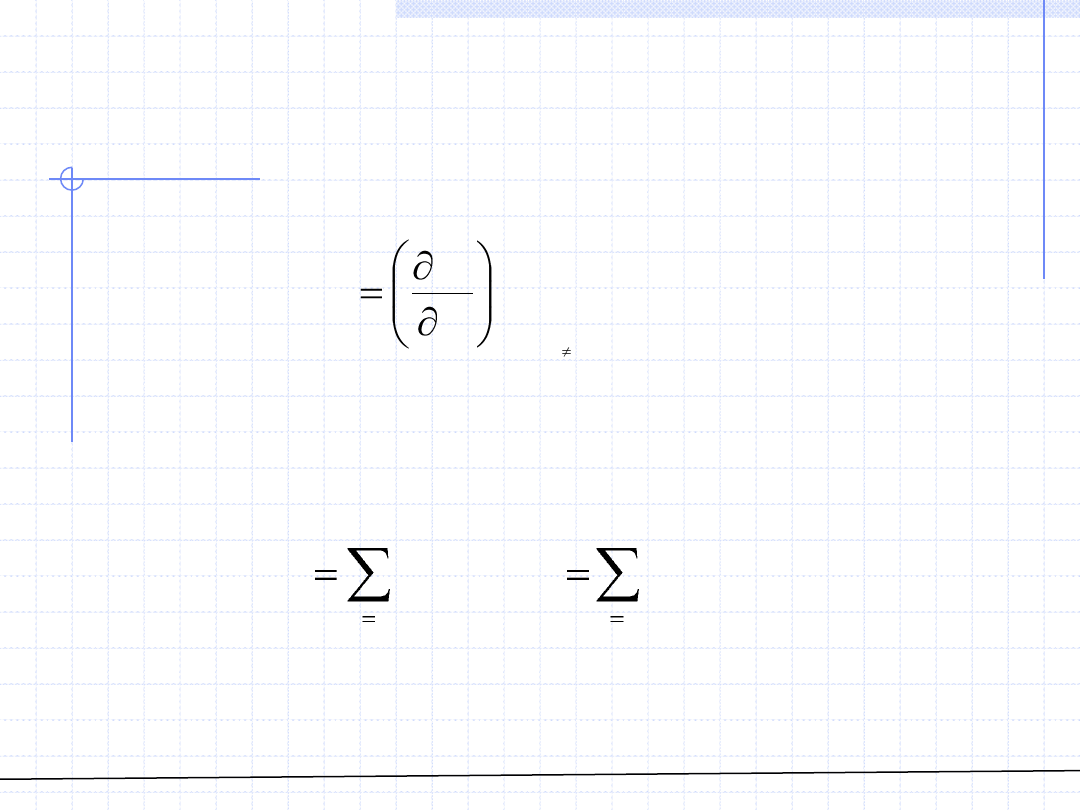
Przypomnijmy wzór definicyjny określający wielkości cząstkowe:
i
j
n
p
T
i
i
n
W
w
,
,
Znajomość wielkości cząstkowych i składu roztworu pozwala na obliczenie
danej wielkości ekstensywnej:
k
i
i
i
k
i
i
i
w
x
w
w
n
W
1
1

© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wielkości cząstkowe cd.
Wielkości cząstkowe zależą od ciśnienia i temperatury a także od składu
danego roztworu. Są również ściśle związane z wielkościami właściwymi
czystych składników. Dla ustalonego ciśnienia i temperatury można napisać:
)
,...,
,...,
,
,
(
2
1
0
k
i
i
i
x
x
x
x
w
f
w
Funkcja powyższa musi spełniać własności graniczne:
i
i
x
i
i
x
w
w
w
w
i
i
)
(
)
(
lim
lim
0
0
1
Wartość „w
i
∞
” oznacza tzw. wielkość cząstkową w roztworze nieskończenie
rozcieńczonym.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych
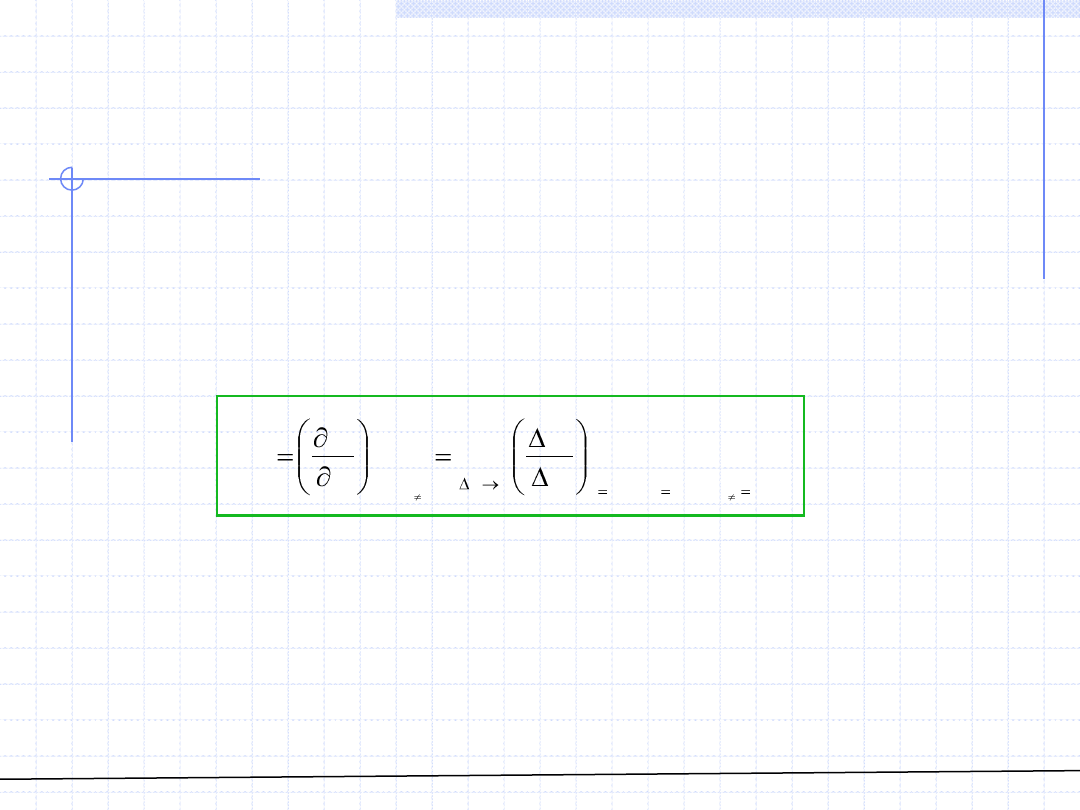
W przypadku gdy daną wielkość W można wyznaczyć eksperymentalnie, istnieje
możliwość określenia wielkości cząstkowych bezpośrednio za pomocą doświadczeń
oraz wzoru definicyjnego:
.
.,
.,
0
,
,
lim
const
n
const
p
const
T
i
n
n
p
T
i
i
i
j
i
i
j
n
W
n
W
w
gdzie ΔW oznacza zmierzony eksperymentalnie przyrost wartości W po dodaniu
do roztworu składnika „i” w ilości Δn
i
.
Metodę tę można stosować np. do wyznaczania objętości cząstkowych.
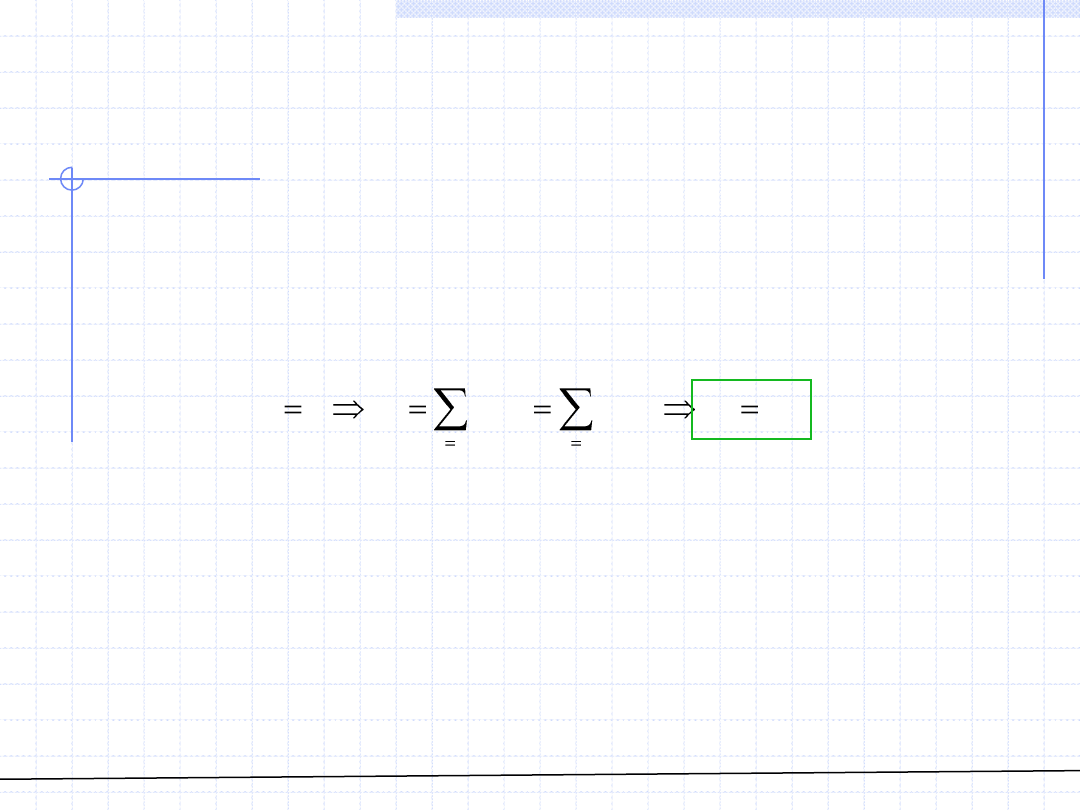
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych
W szczególnych sytuacjach gdy dana wielkość mieszania jest równa 0, wielkości
cząstkowe są równe wielkościom właściwym czystych składników i nie zależą
od składu roztworu:
0
0
1
1
0
k
k
M
i
i
i
i
i
i
i
i
W
W
n w
n w
w
w
Sytuacja taka ma miejsce w przypadku objętości, entalpii i energii wewnętrznej
roztworów idealnych.
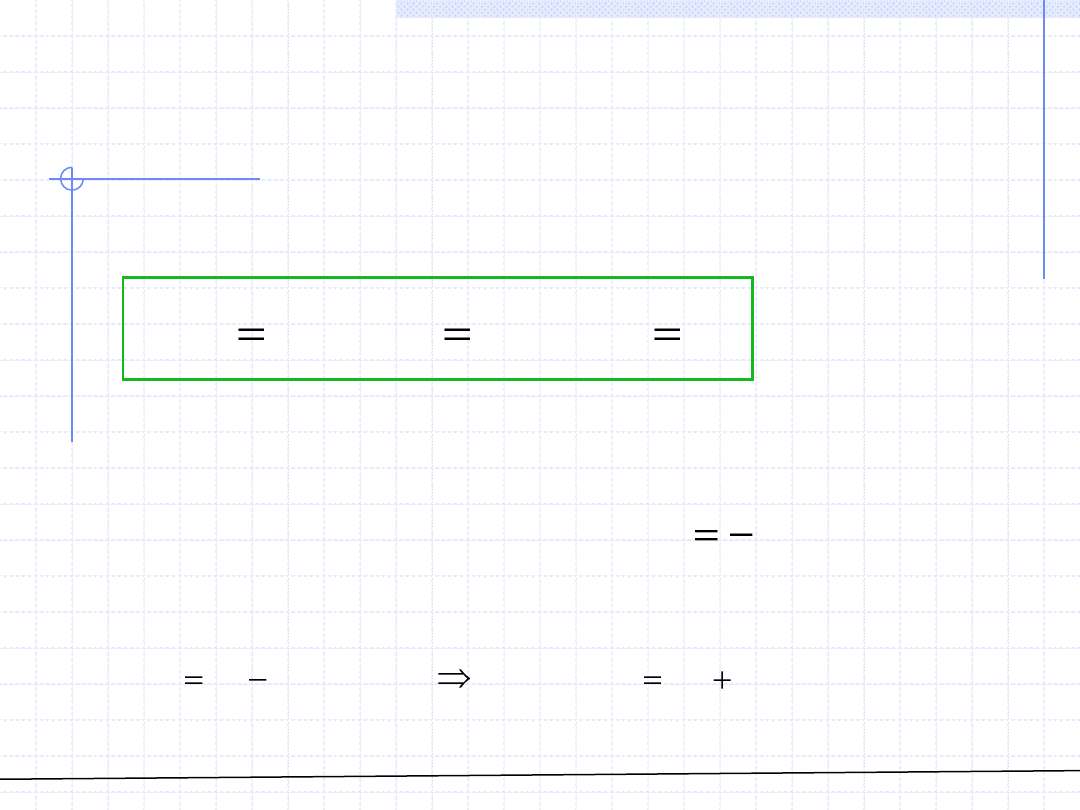
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych
Dla roztworów idealnych wyznaczanie wielkości cząstkowych jest stosunkowo
proste. Mamy bowiem:
0
0
0
RI
RI
RI
i
i
i
i
i
i
v
v
h
h
u
u
W przypadku entropii, energii swobodnej i entalpii swobodnej należy
skorzystać ze wzorów określających entropię mieszania roztworów idealnych
podanych na poprzednim wykładzie:
,
ln( )
M RI
i
i
i
s
x R
x
Znajomość cząstkowej wielkości mieszania oraz wielkości właściwej czystego
składnika pozwala na obliczenie danej wielkości cząstkowej:
0
i
i
M
i
w
w
w
0
M
i
i
i
w
w
w
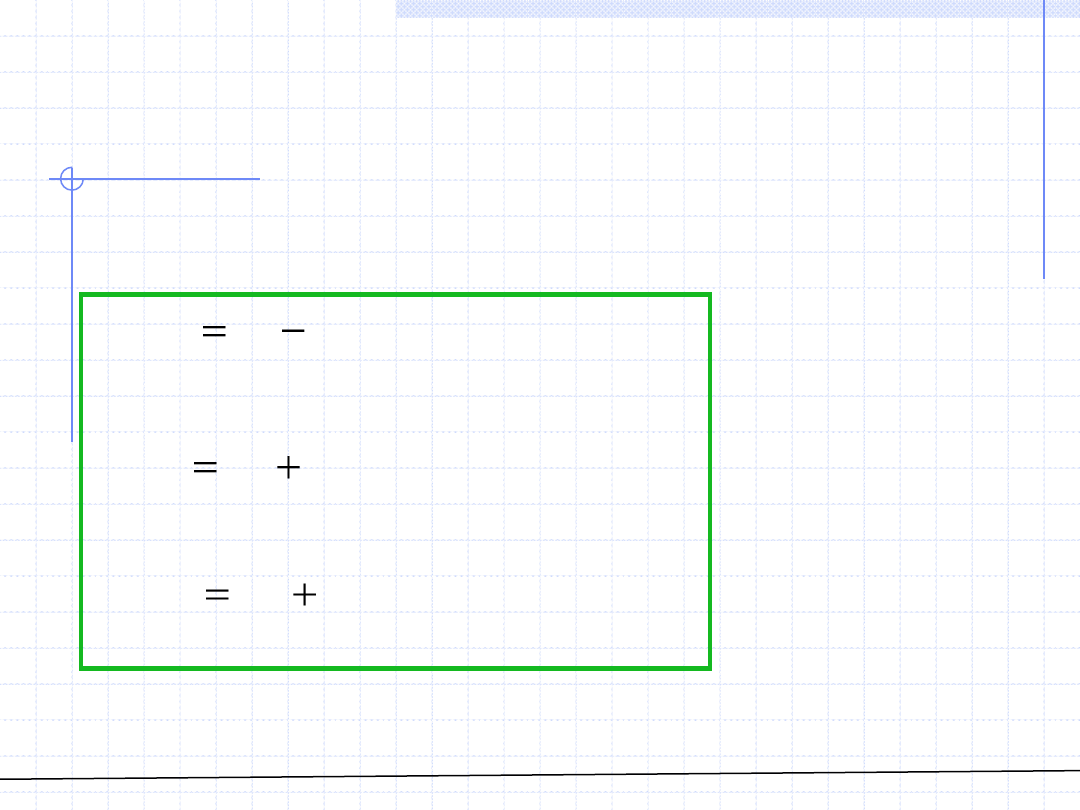
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych
Mamy zatem wzory określające kolejne wielkości cząstkowe dla
roztworów idealnych:
0
ln( )
RI
i
i
i
i
s
s
x R
x
0
ln( )
RI
i
i
i
i
a
a
x RT
x
0
ln( )
RI
i
i
i
i
g
g
x RT
x
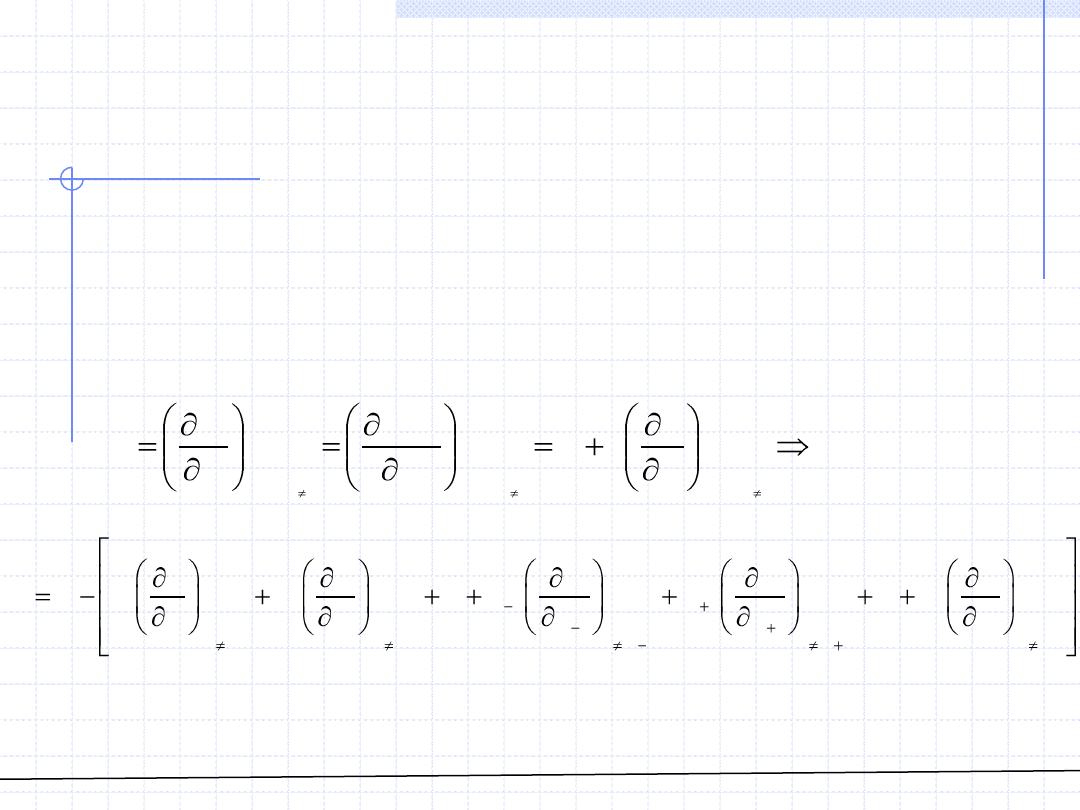
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych cd.
W przypadku roztworów rzeczywistych często wyznaczanie wielkości cząstkowych
za pomocą wzoru definicyjnego jest trudne. Można natomiast na ogół bez problemu
wyznaczać wielkości właściwe roztworu jako funkcje składu. Okazuje się, że
na podstawie znajomości wielkości właściwych roztworu można obliczyć wszystkie
wielkości cząstkowe. Wychodząc ze wzoru definicyjnego i stosując zasady
rachunku różniczkowego można otrzymać:
i
j
i
j
i
j
n
p
T
i
n
p
T
i
n
p
T
i
i
n
w
n
w
n
nw
n
W
w
,
,
,
,
,
,
)
(
1
2
1
1
, ,
, ,
, ,
, ,
, ,
1
2
1
1
,1
,2
, 1
, 1
,
...
...
j
j
j
j
j
i
i
i
k
p T x
p T x
p T x
p T x
p T x
i
i
k
j i
j i
j i i
j i i
j i k
w
w
w
w
w
w
w
x
x
x
x
x
x
x
x
x
x
Otrzymany wzór można zapisać w zwartej postaci:
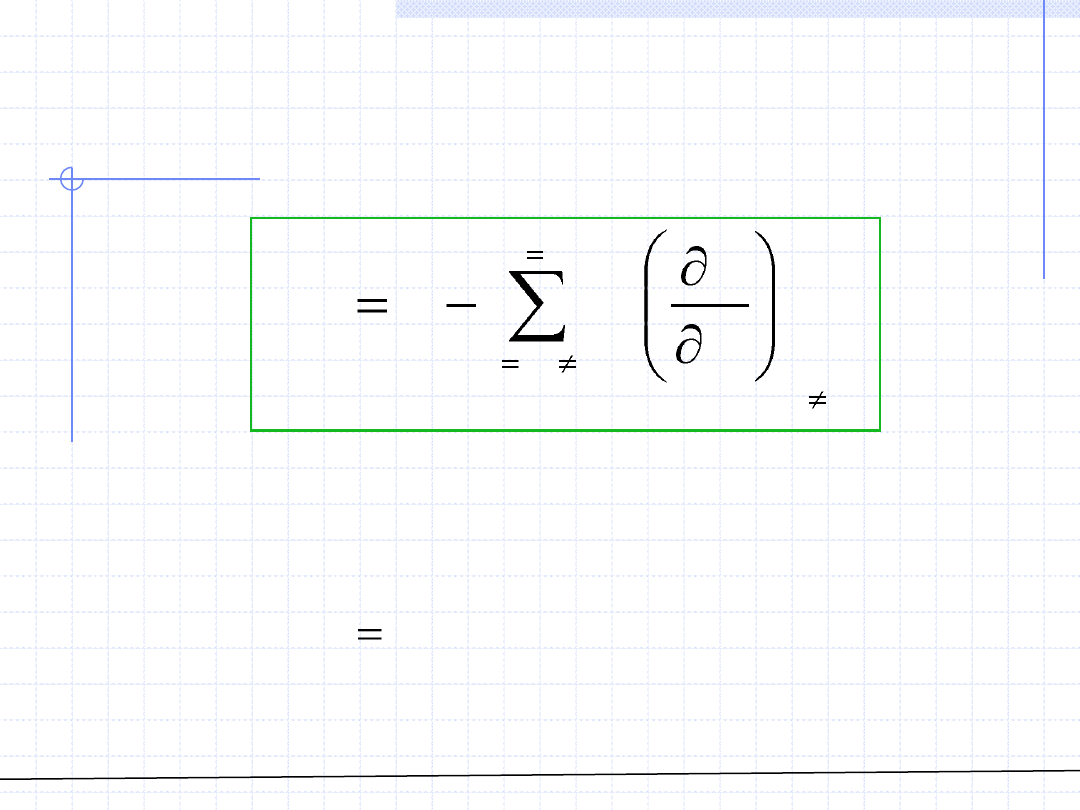
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych cd.
)
,...,
,...,
,
(
2
1
k
i
x
x
x
x
f
w
Aby skorzystać z powyższego wzoru należy dysponować zależnością wielkości
właściwej „w” od składu roztworu wyrażonego za pomocą ułamków molowych:
k
r
i
r
r
r
i
j
x
T
p
r
r
i
j
x
w
x
w
w
,
1
,
,
,
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych dla
roztworów 2 - składnikowych
)
(
'
)
1
(
)
(
)
1
(
1
1
1
1
1
1
2
2
,
2
2
1
x
w
x
x
w
dx
dw
x
w
dx
dw
x
w
x
w
x
w
w
i
T
p
)
(
'
)
(
2
1
1
1
1
1
1
1
,
1
1
2
x
w
x
x
w
dx
dw
x
w
dx
dw
x
w
x
w
x
w
w
i
T
p
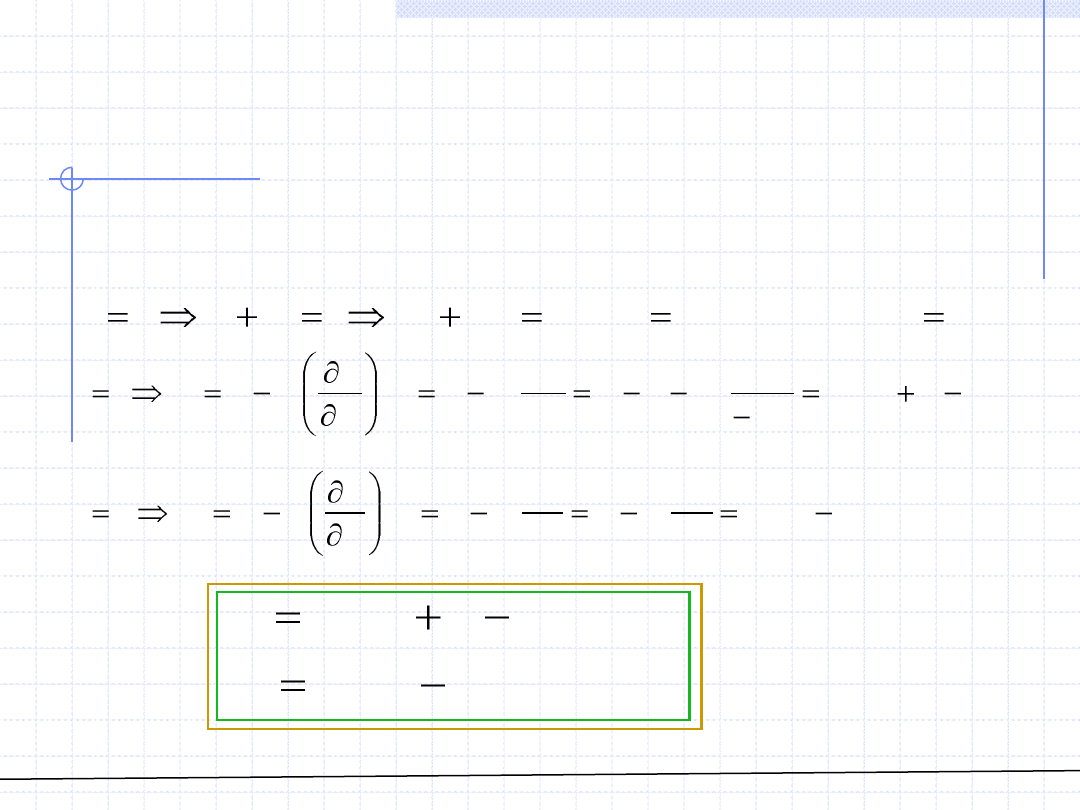
Otrzymany wzór znajduje często zastosowanie w przypadku roztworów
2 – składnikowych (binarnych), dla których k=2, i=1,2
'
/
)
(
0
1
2
1
1
2
1
2
1
w
dx
dw
x
f
w
dx
dx
x
x
k
)
(
'
)
(
)
(
'
)
1
(
)
(
1
1
1
2
1
1
1
1
x
w
x
x
w
w
x
w
x
x
w
w
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych dla
roztworów 2 - składnikowych
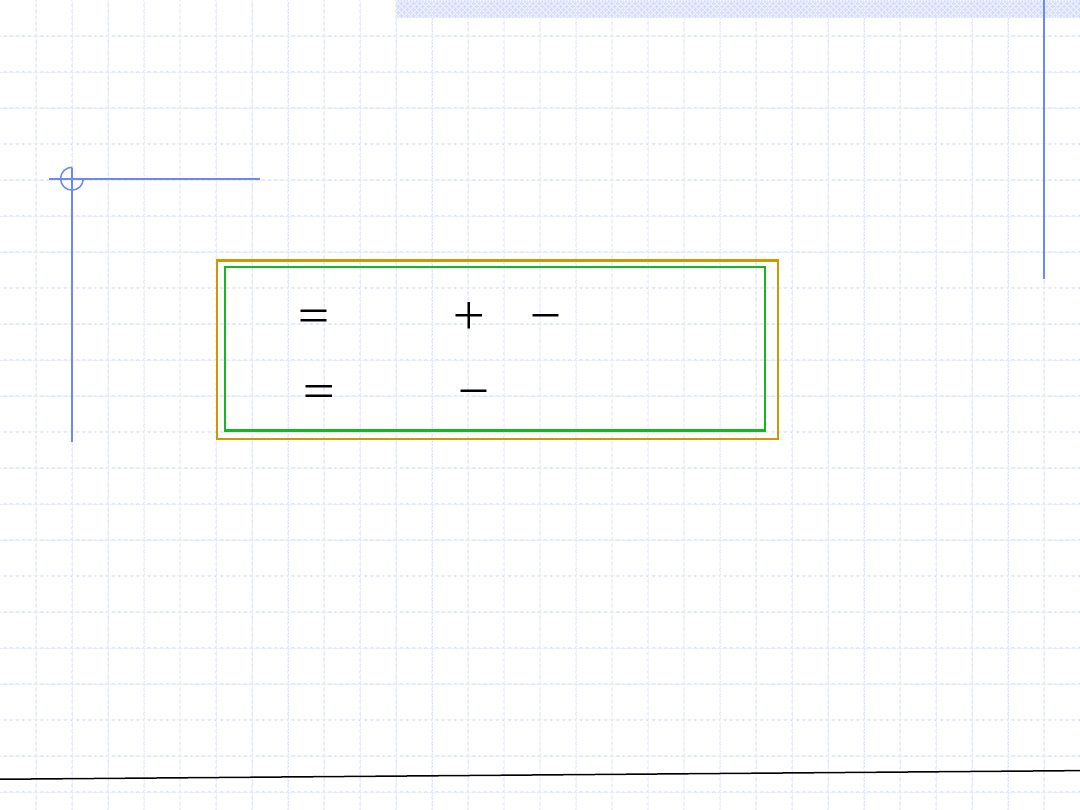
Zastosowanie powyższych wzorów wymaga znajomości funkcji danej wielkości
właściwej w zależności od składu w tym przypadku wyrażonego za pomocą
ułamka molowego składnika 1.
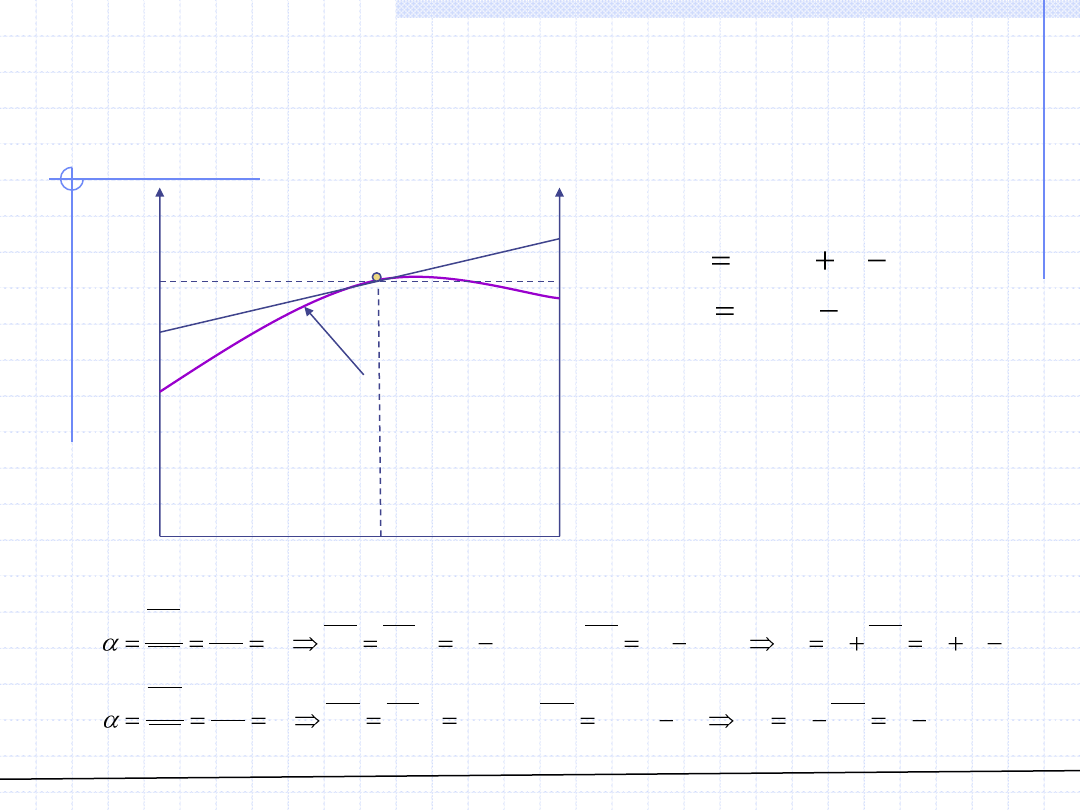
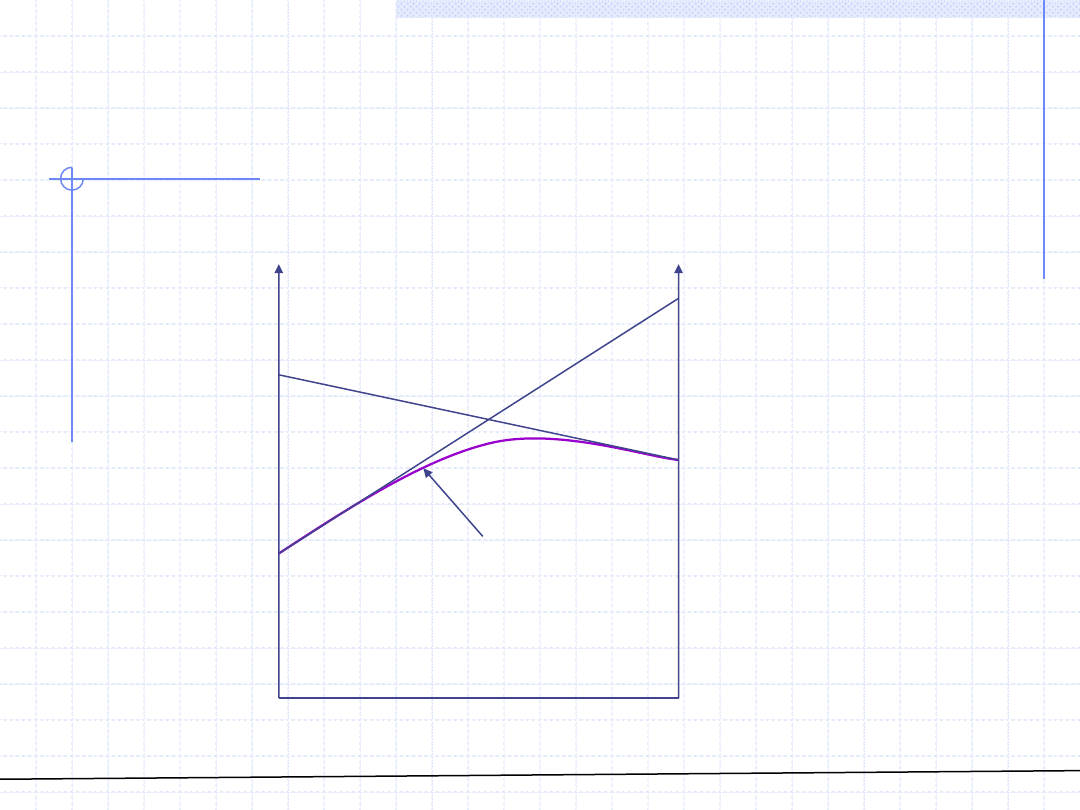
W przypadku gdy zależność ta jest podana w postaci graficznej istnieje
możliwość graficznego wyznaczenia wielkości cząstkowych.
)
(
'
)
(
)
(
'
)
1
(
)
(
1
1
1
2
1
1
1
1
x
w
x
x
w
w
x
w
x
x
w
w
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych dla
roztworów 2 – składnikowych cd.
'
)
1
(
)
(
'
)
1
(
'
'
tan
1
1
1
1
1
1
w
x
w
BC
w
w
x
w
w
BC
w
x
w
AB
BC
w
dx
dw
AB
BC
'
)
(
'
'
'
tan
1
2
2
1
1
1
w
x
w
DE
w
w
w
x
w
DE
w
x
w
DA
DE
w
dx
dw
DA
DE
x
1
=0
x
2
=1
x
2
=0
x
1
=1
x
1
->
w(x
1
)
w
w
1
0
w
1
w
2
0
w
2
A
B
C
D
E
w(x
1
)
α
)
(
'
)
(
)
(
'
)
1
(
)
(
1
1
1
2
1
1
1
1
x
w
x
x
w
w
x
w
x
x
w
w
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY –
Wyznaczanie wielkości cząstkowych dla
roztworów 2 – składnikowych cd.
x
1
=0
x
2
=1
x
2
=0
x
1
=1
x
1
->
w(x
1
)
w
1
0
w
1
∞
w
2
0
w
2
∞
Metodą wykreślną można również wyznaczyć wielkości cząstkowe w roztworach
nieskończenie rozcieńczonych w
1
∞
i w
2
∞
.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Równania stanu
0
)
,...,
,
,
,
,
(
2
1
k
n
n
n
V
T
p
F
Zależności między najważniejszymi parametrami układu będącego roztworem
opisuje równanie stanu roztworu, którego ogólna postać jest następująca:
Dla układów zamkniętych o ustalonym składzie wygodnie jest stosować
postać, w której występują objętość właściwa i ułamki molowe:
0
)
,...,
,
,
,
,
(
2
1
k
x
x
x
v
T
p
F
Jeżeli chodzi o konkretne postacie równań stanu dla roztworów, to na ogół
stosuje się takie same równania jak dla składników czystych. Podstawowym
problemem są tutaj metody wyznaczania parametrów. Parametry te najczęściej
wyznacza się na podstawie parametrów czystych składników za pomocą tzw.
reguł mieszania.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
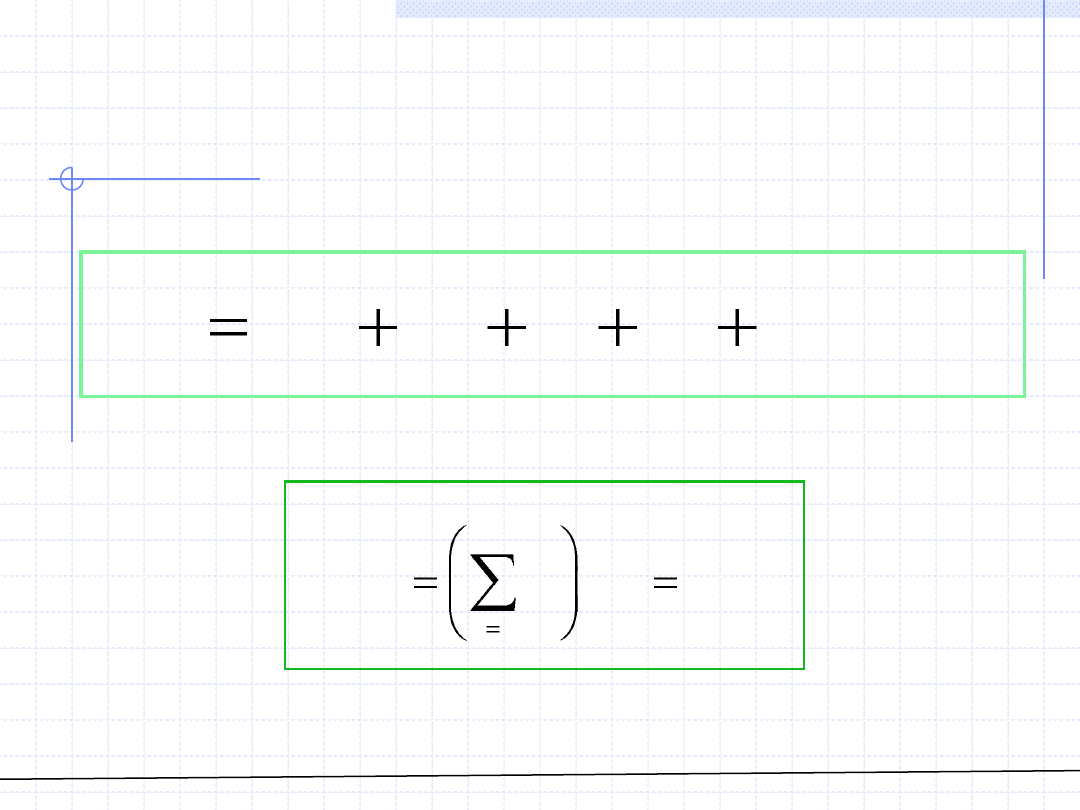
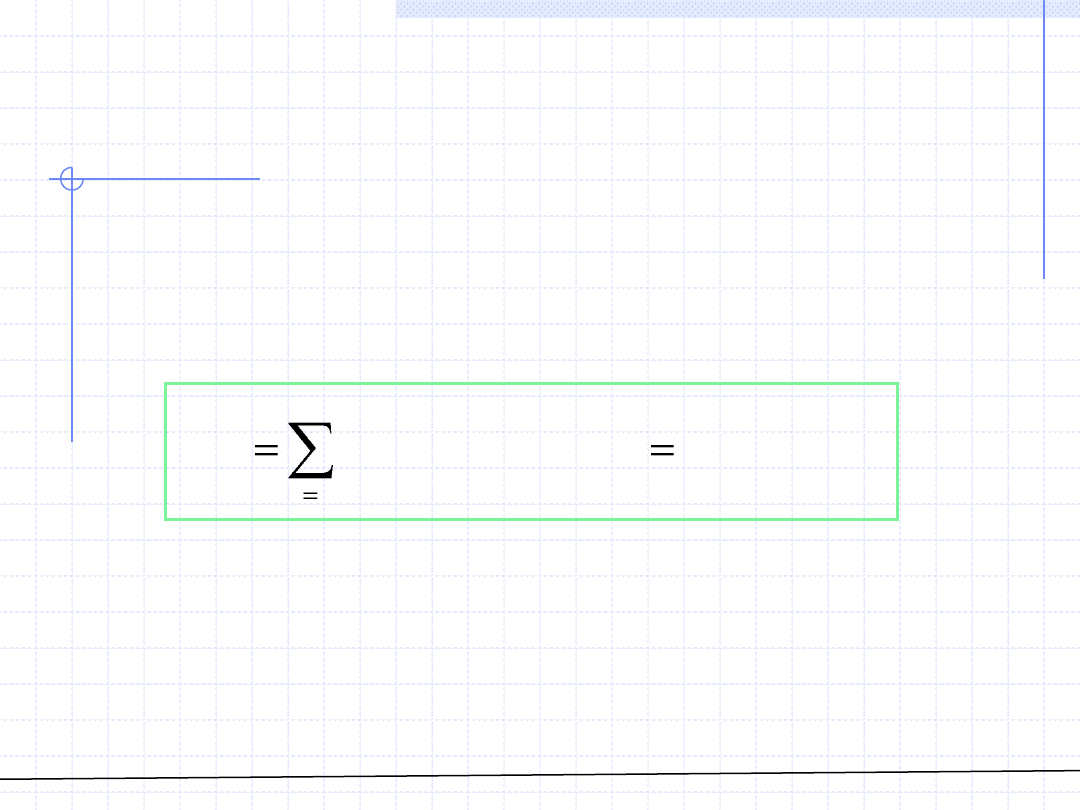
ROZTWORY – Równania stanu cd.
1
2
(
...
... )
i
k
pV
n
n
n
n RT
Dla roztworu gazów doskonałych oczywiście obowiązuje RSGD:
1
k
i
i
pV
n RT
nRT
Równanie to można zapisać w zwartej postaci:
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Równania stanu cd.
Dla roztworów spełniających prawo Amagata można w zasadzie zastosować
dowolne równanie stanu czystych składników, pod warunkiem, że równanie
to będzie rozwiązane względem objętości:
)
,
,
(
1
0
0
0
T
p
n
f
V
gdzie
V
V
i
k
i
i
i
i
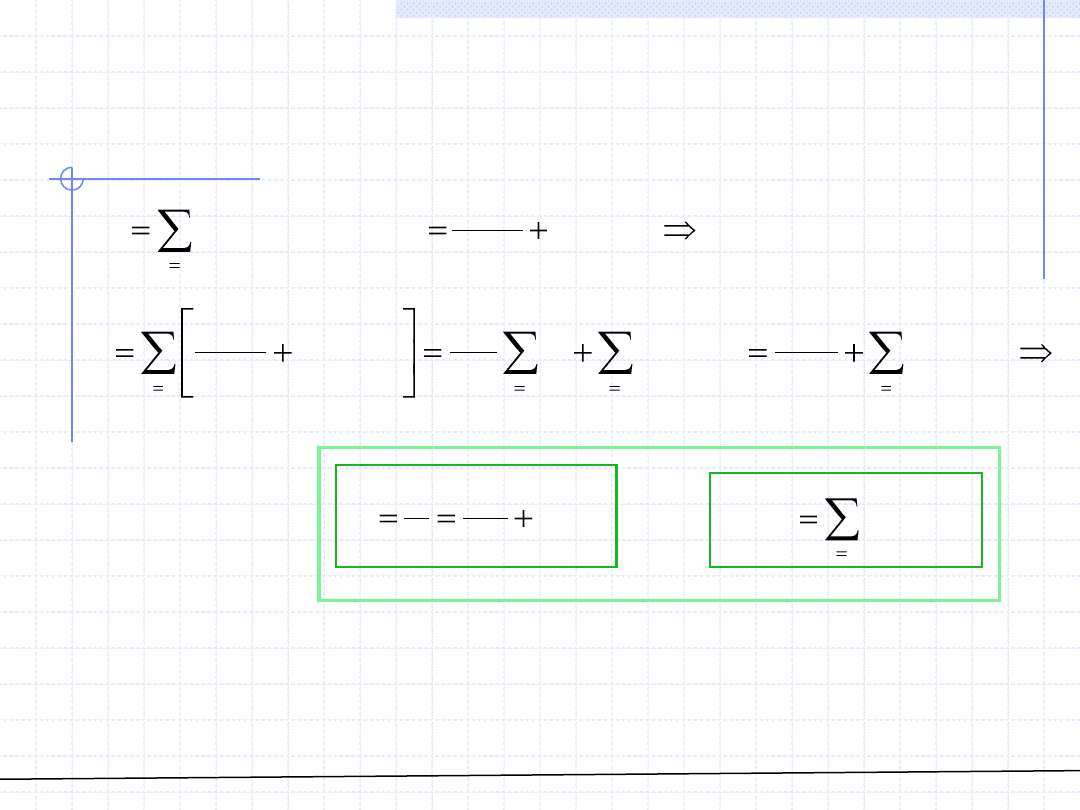
Przykładem takiego postępowania może być zastosowanie równania
wirialnego obciętego po drugim wyrazie:
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Równania stanu cd.
)
(
0
1
0
0
T
B
n
p
RT
n
V
gdzie
V
V
i
i
i
k
i
i
i
Wzór określający drugi współczynnik wirialu B(T) dla roztworu jest właśnie
przykładem prostej reguły mieszania. Niestety to proste rozwiązanie
ma dosyć ograniczone zastosowanie do obszarów w których można
stosować obcięte równania wirialne z dodatkowym założeniem stosowalności
prawa Amagata.
)
(
)
(
)
(
0
1
1
0
1
1
0
T
B
n
p
nRT
T
B
n
n
p
RT
T
B
n
p
RT
n
V
i
k
i
i
k
i
i
k
i
i
i
k
i
i
i
i
)
(T
B
p
RT
n
V
v
k
i
i
i
T
B
x
T
B
gdzie
1
0
)
(
)
(
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Równania stanu cd.
)
)(
(
)
(
)
,
(
2
1
b
v
b
v
T
a
b
v
RT
T
v
p
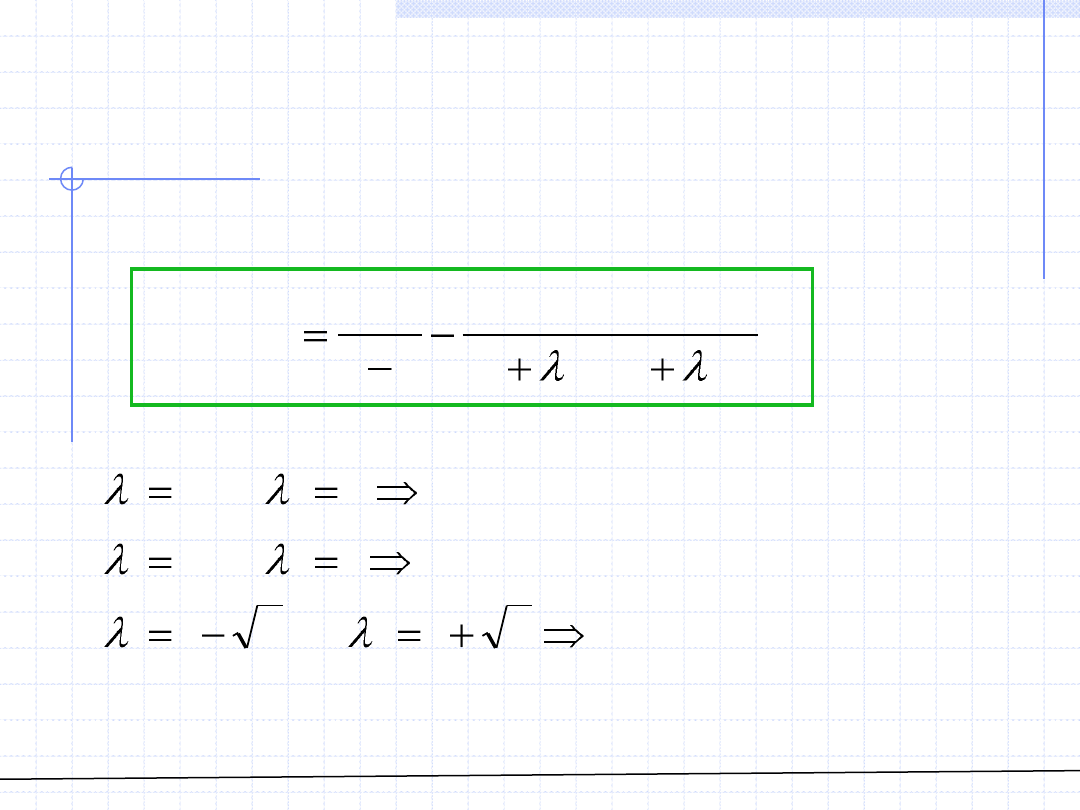
Równania 3 – go stopnia wywodzące się z równania van der Waalsa można
zapisać w ogólnej postaci:
gdzie λ
1
i λ
2
są to stałe bezwymiarowe liczby charakteryzujące dane równanie.
PR
równanie
SRK
i
RK
równanie
Waalsa
der
van
równanie
2
1
2
1
1
0
0
0
2
1
2
1
2
1

© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Równania stanu cd.
)
,...,
,
,
,...,
,
(
)
,...,
,
,
,...,
,
(
)
(
2
1
0
0
2
0
1
2
1
0
0
2
0
1
k
k
k
k
x
x
x
b
b
b
f
b
x
x
x
a
a
a
f
T
a
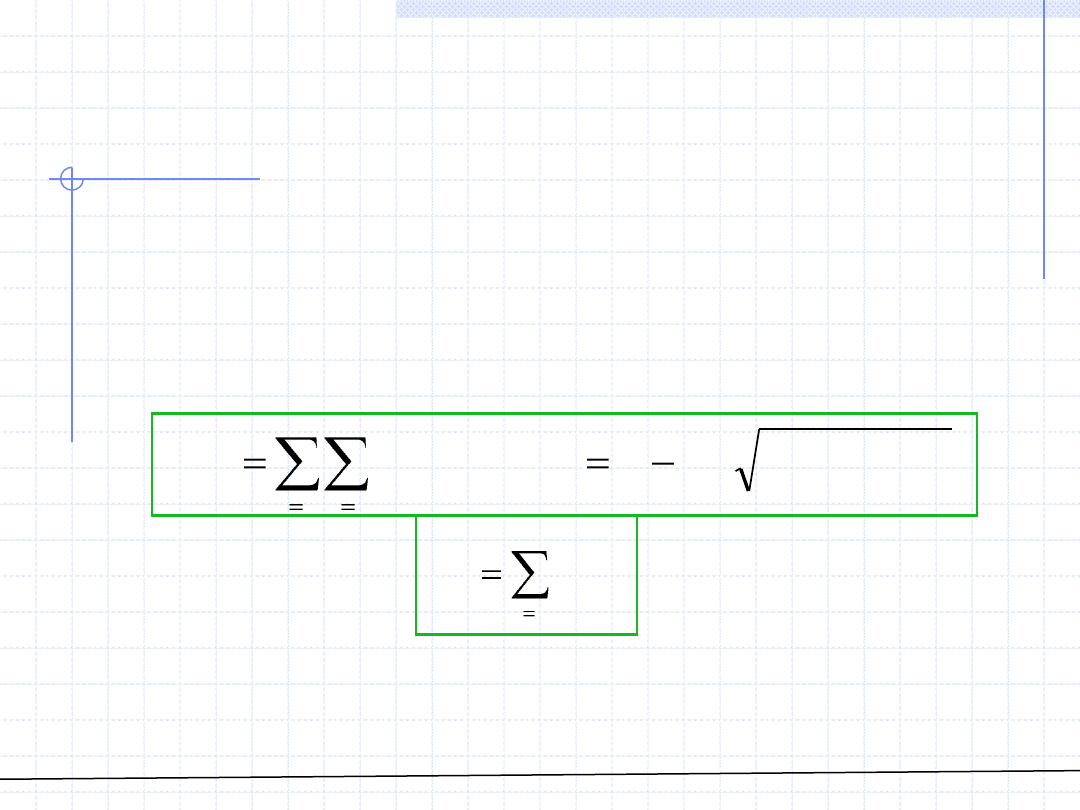
W przypadku roztworów kluczowym problemem jest określenie parametrów
a(T) i b. W ogólnej sytuacji parametry te zależą od odpowiednich parametrów
czystych substancji i składu roztworu:
Konkretne postacie tych zależności nazywamy regułami mieszania.
Zależności te powinny spełniać warunki graniczne:
0
0
1
1
lim
lim
i
i
i
i
i
i
x
x
a x
a
b x
b
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Równania stanu cd.
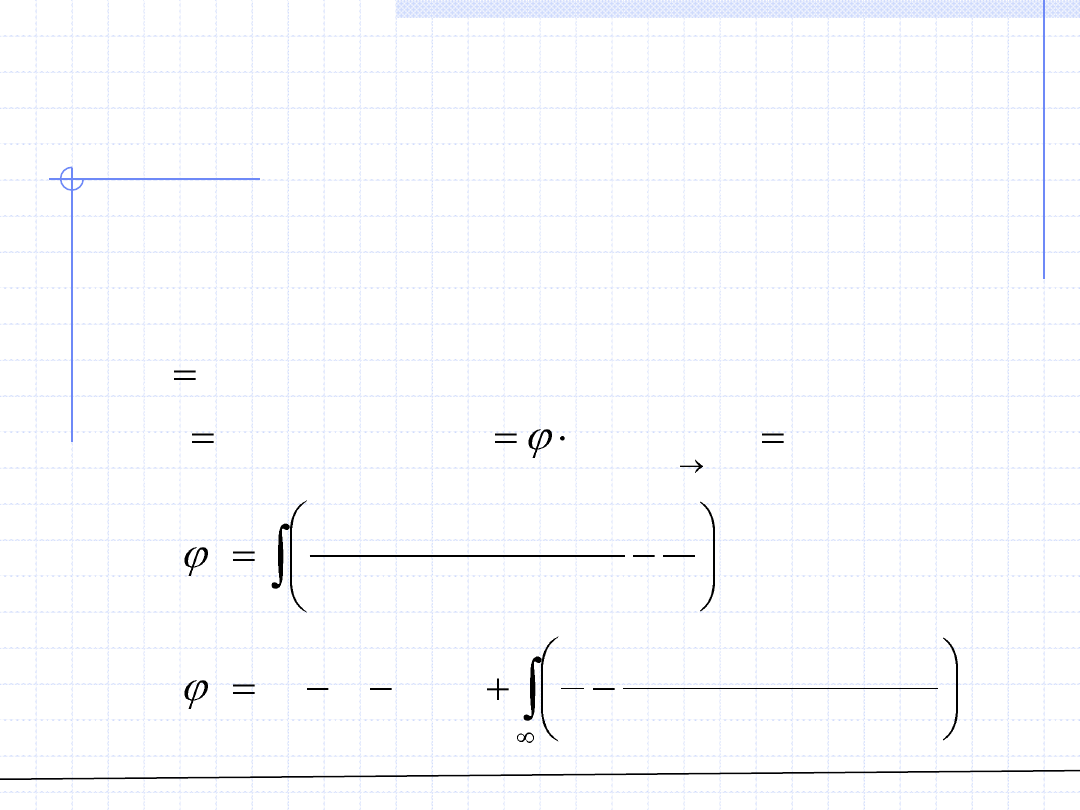
Najczęściej w przypadku równań 3 – go stopnia stosowane są tzw.
kwadratowe reguły mieszania nazywane też regułami van der Waalsa:
k
i
k
j
j
i
ij
ij
ij
j
i
T
a
T
a
k
a
a
x
x
T
a
1
1
0
0
)
(
)
(
)
1
(
)
(
k
i
i
i
b
x
b
1
0
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
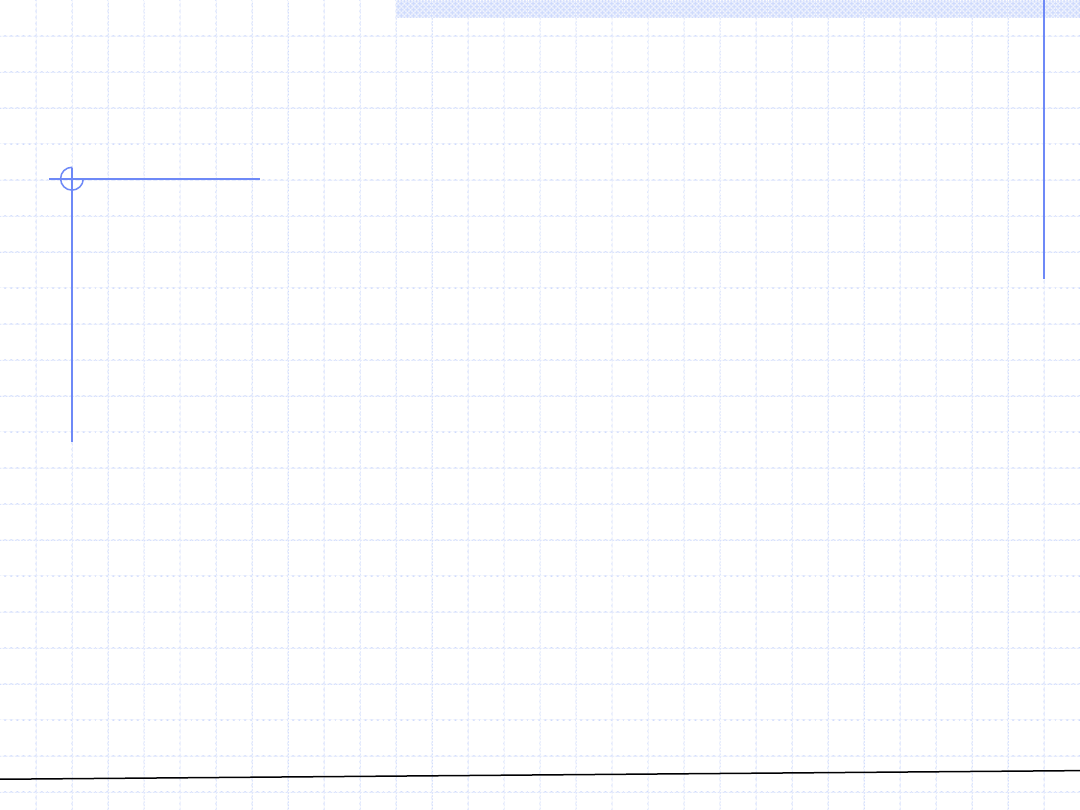
ROZTWORY – Fugatywność roztworu
Pojęcie fugatywności odnosi się również do roztworów, gdzie definiuje się
dwie wielkości określane nazwą „fugatywność”. Pierwsza wielkość to
fugatywność całego roztworu, którą będziemy oznaczać jako „f”. Definicja
tej fugatywności jest analogiczna jak dla czystych substancji:
v
k
p
k
p
RT
x
x
x
T
v
p
v
z
z
dp
p
RT
x
x
x
T
p
v
p
f
p
f
f
RTd
dg
const
T
)
,...,
,
,
,
(
1
)
ln(
)
1
(
)
ln(
1
)
,...,
,
,
,
(
)
ln(
lim
)
ln(
.
2
1
0
2
1
0
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
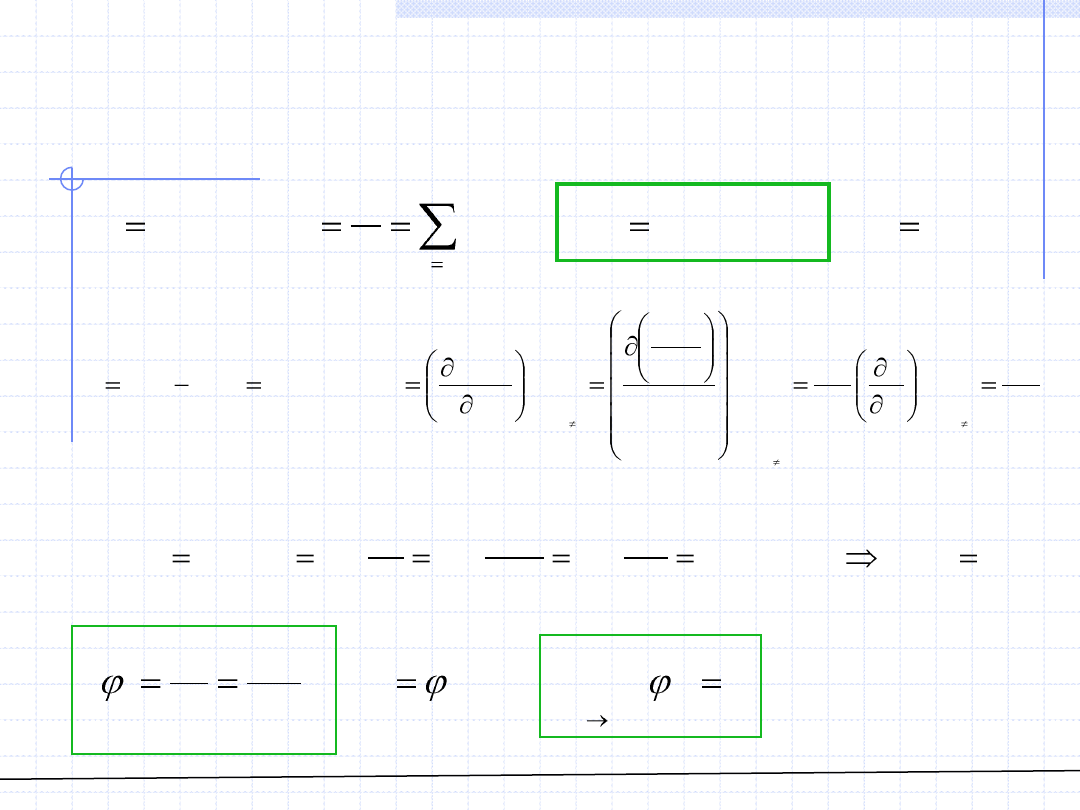
ROZTWORY – Fugatywność
składnika w roztworze
Znacznie ważniejszym pojęciem jest fugatywność składnika w
roztworze.
Wielkość ta odgrywa kluczową rolę w rozważaniach dotyczących
równowag fazowych. Definicja tej wielkości jest analogiczna do definicji
fugatywności roztworu, z tym że tutaj podstawą jest cząstkowa entalpia
swobodna składnika „i”.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Fugatywność
składnika w roztworze
.
)
ln(
.
1
const
x
f
RTd
dg
g
x
n
G
g
const
T
i
i
i
k
i
i
i
p
RT
n
n
p
RT
n
p
nRT
n
V
v
dp
v
dT
s
dp
v
dg
i
j
i
j
i
j
n
T
p
i
n
T
p
i
n
T
p
i
GD
GD
i
i
i
i
i
,
,
,
,
,
,
)
(
)
(
i
GD
i
i
i
i
i
i
GD
i
GD
i
p
f
p
RTd
p
dp
RT
py
dpy
RT
p
dp
RT
dp
v
dg
)
(
)
(
)
(
)
ln(
1
)
(
lim
0
i
p
i
i
i
i
i
i
i
i
p
x
f
p
x
f
p
f
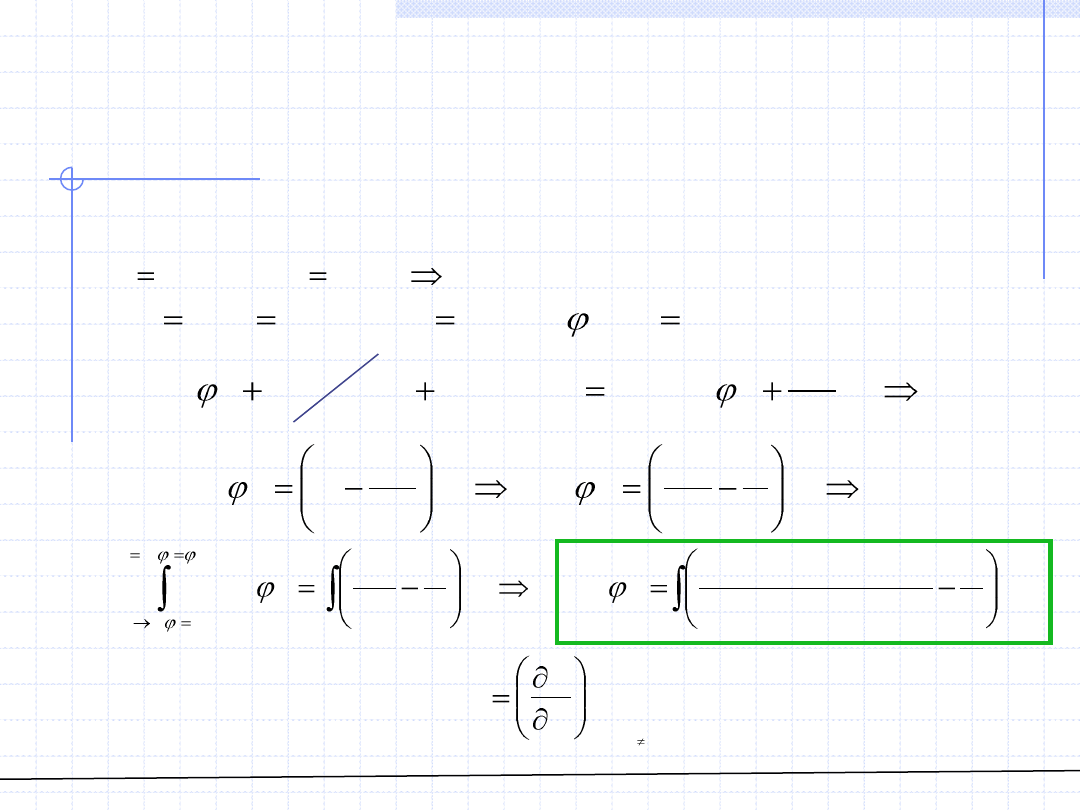
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Fugatywność
składnika w roztworze cd.
Wychodząc z definicji wyprowadzamy ważny wzór roboczy określający
współczynnik fugatywności składnika w roztworze:
.
.
const
x
const
T
i
)
ln(
)
ln(
p
x
RTd
f
RTd
dp
v
dg
i
i
i
i
i
dp
p
RT
RTd
p
RTd
x
RTd
RTd
i
i
i
)
ln(
)
ln(
)
ln(
)
ln(
dp
p
RT
v
d
dp
p
RT
v
RTd
i
i
i
i
1
)
ln(
)
ln(
p
k
i
p
p
p
p
i
i
i
dp
p
RT
x
x
x
T
p
v
dp
p
RT
v
d
i
i
i
0
2
1
,
1
,
0
0
1
)
,...,
,
,
,
(
)
ln(
1
)
ln(
i
j
n
T
p
i
k
i
n
V
x
x
x
T
p
v
gdzie
,
,
2
1
)
,...,
,
,
,
(
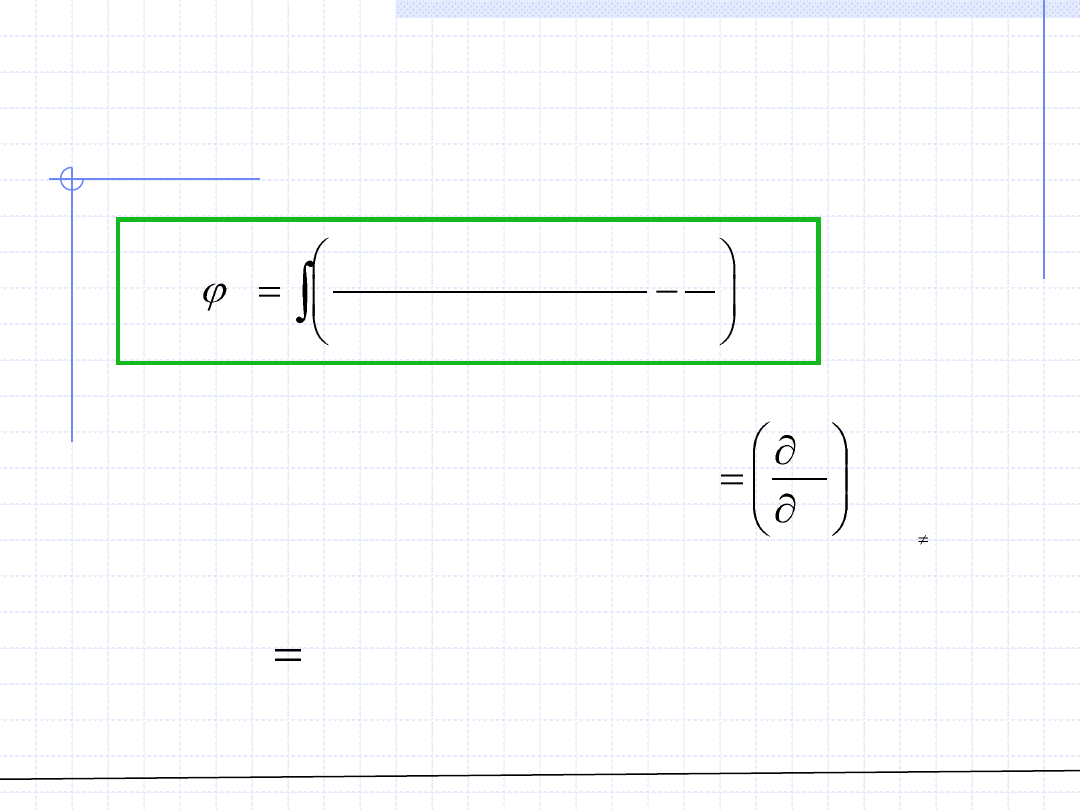
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Fugatywność
składnika w roztworze cd.
1
2
0
( , , ,
,...,
)
1
ln( )
p
i
k
i
v p T x x
x
dp
RT
p
i
j
n
T
p
i
k
i
n
V
x
x
x
T
p
v
gdzie
,
,
2
1
)
,...,
,
,
,
(
1
2
( , , ,
,..., ,...,
)
i
k
V
f p T n n
n
x
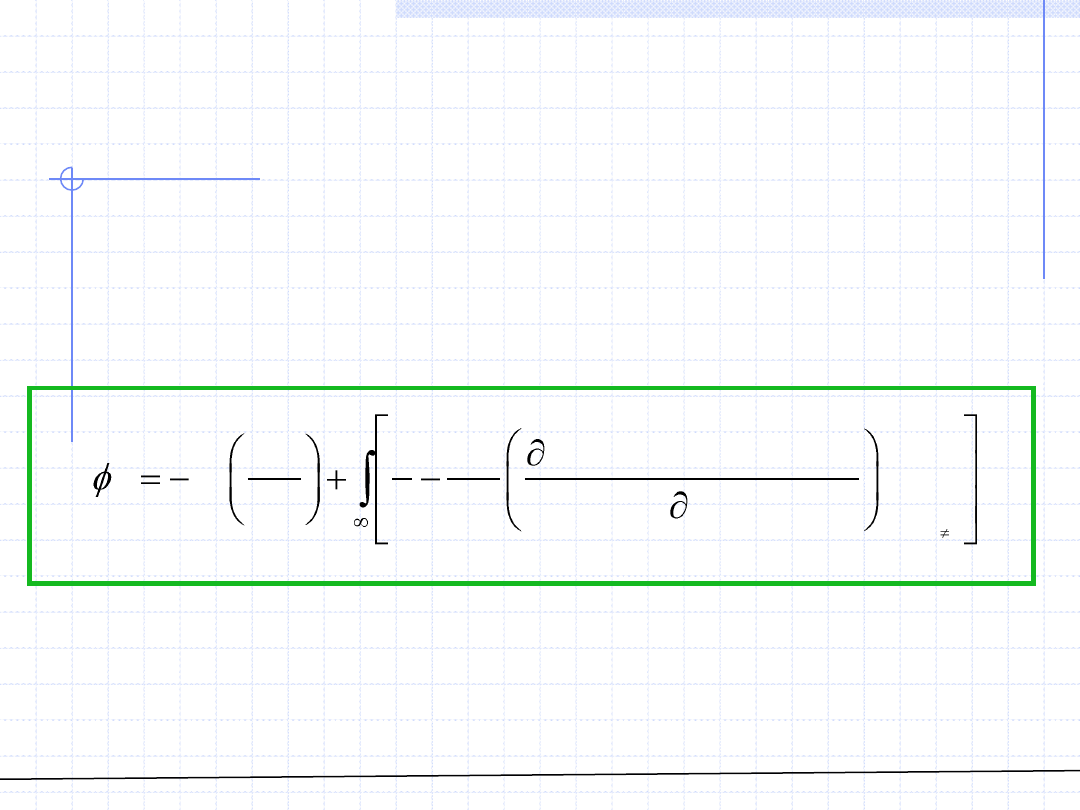
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
ROZTWORY – Fugatywność
składnika w roztworze cd.
W przypadku gdy roztwór jest opisany za pomocą równania rozwiązanego
względem ciśnienia wzór całkowy określający współczynnik fugatywności
składnika w roztworze wymaga przekształcenia w celu zamiany zmiennych.
W rezultacie tego przekształcenia otrzymujemy:
1
2
, ,
( , , , ,
,...,
)
1
ln( )
ln
j i
v
k
i
i
T V n
p V n T n n
n
pv
n
dv
RT
v
RT
n
W celu zastosowania powyższego wzoru należy do równania stanu wprowadzić
objętość ogólną V oraz ułamki molowe zastąpić stosunkami liczności.
Następnie oblicza się pochodną cząstkową i z powrotem wprowadza się
objętość właściwą względem której wyznacza się całkę oznaczoną.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
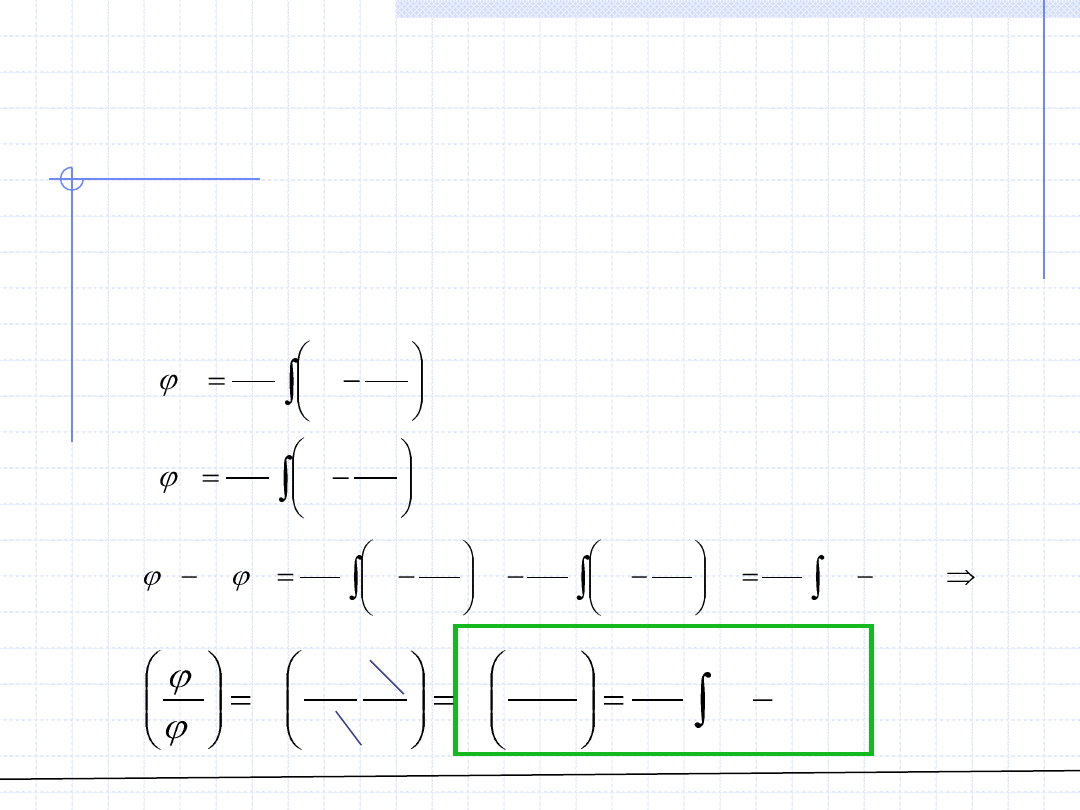
Zależność między fugatywnością składnika w
roztworze a fugatywnością czystego składnika
Fugatywność składnika w roztworze można powiązać z fugatywnością tego
samego składnika w stanie czystym pod tym samym ciśnieniem i w tej
samej temperaturze. Dla obydwu wielkości można napisać odpowiednie
wzory:
p
i
i
p
i
i
roztwór
dp
p
RT
v
RT
czysty
dp
p
RT
v
RT
0
0
0
0
1
)
ln(
1
)
ln(
p
i
i
p
i
p
i
i
i
dp
v
v
RT
dp
p
RT
v
RT
dp
p
RT
v
RT
0
0
0
0
0
0
)
(
1
1
1
)
ln(
)
ln(
p
i
i
i
i
i
i
i
i
i
i
dp
v
v
RT
f
x
f
f
p
p
x
f
0
0
0
0
0
)
(
1
ln
ln
ln
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
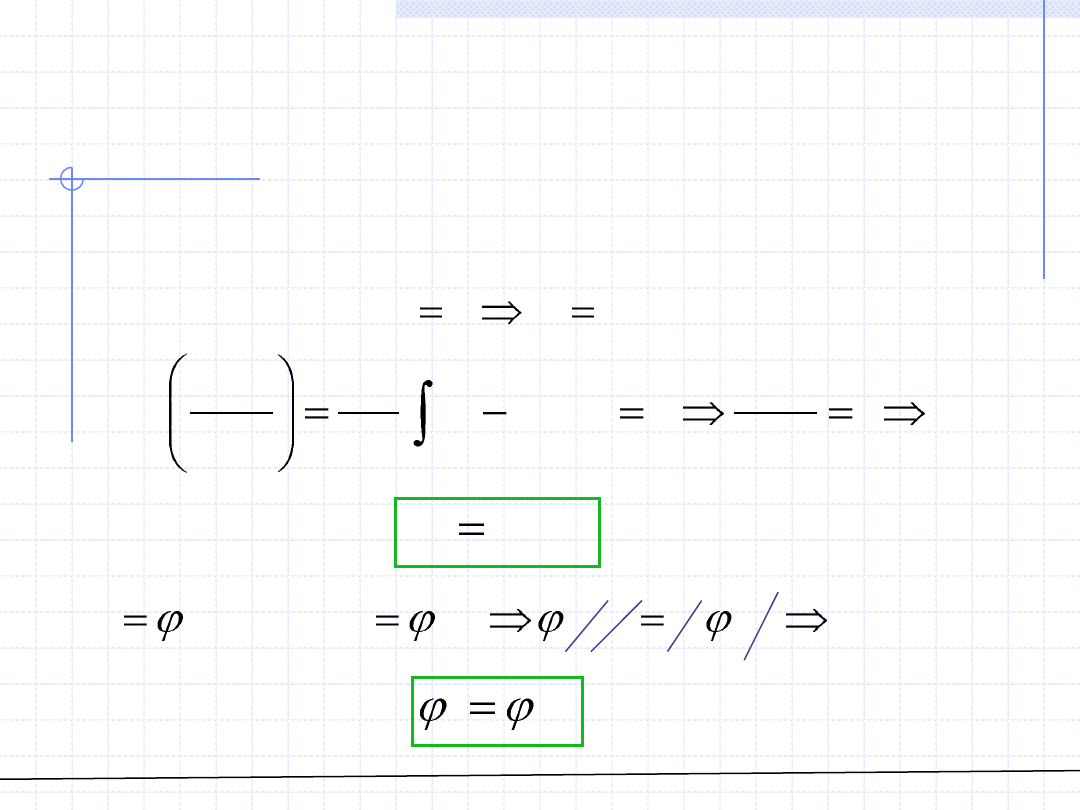
Reguła Lewisa - Randalla
Dla roztworu stosującego się do prawa Amagata obowiązuje bardzo prosta
zależność między obydwoma fugatywnościami znana jako tzw.
reguła Lewisa – Randalla:
0
0
i
i
M
v
v
V
1
0
)
(
1
ln
0
0
0
0
i
i
i
p
i
i
i
i
i
f
x
f
dp
v
v
RT
f
x
f
0
i
i
i
f
x
f
p
x
p
x
p
f
p
x
f
i
i
i
i
i
i
i
i
i
0
0
0
0
i
i
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
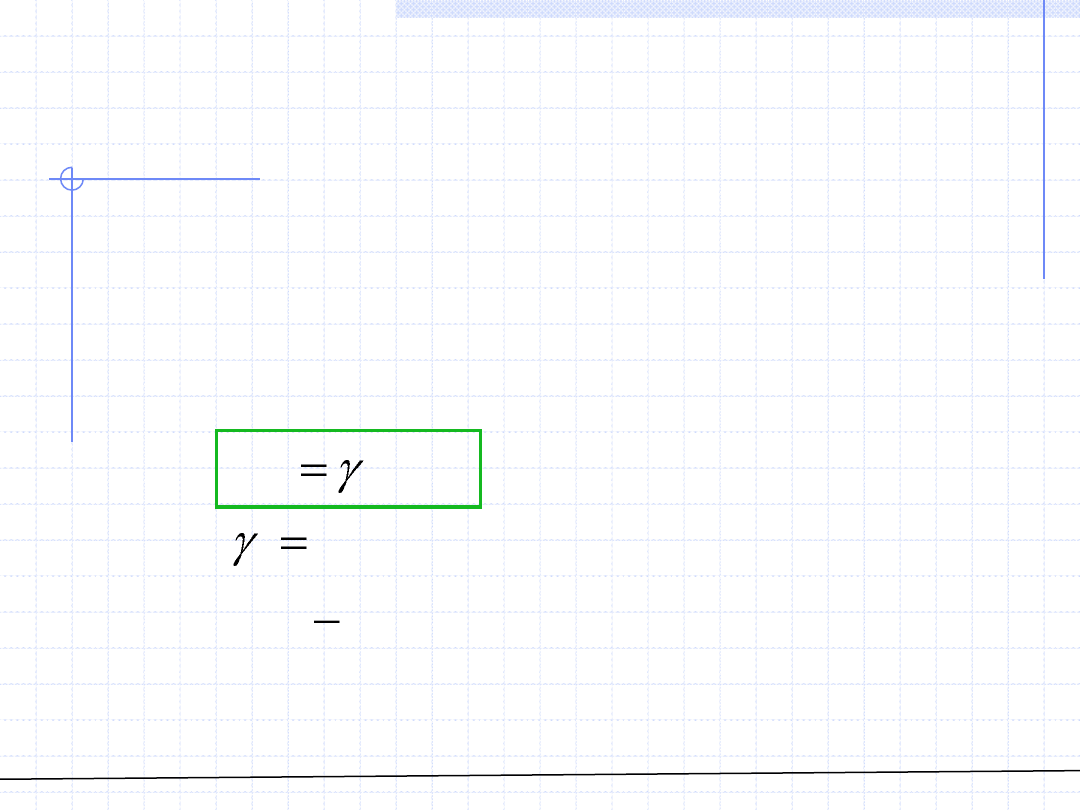
Fugatywność składnika w roztworach ciekłych
Jeżeli potrafimy opisać ciecz za pomocą równania stanu, wtedy w zasadzie
niezależnie od tego jaka to jest faza możemy korzystać z poprzednio
wyprowadzonych wzorów. Jednakże ze względu na duże trudności w takim
opisie rozwinęła się metoda opisu fugatywności w cieczy za pomocą
tzw. współczynników aktywności. Metoda ta jest powszechnie stosowana
przede wszystkim do opisu odstępstwa układów rzeczywistych od praw
opisujących roztwory idealne. Zgodnie z tą metodą fugatywność składnika
w roztworze ciekłym jest określona za pomocą wzoru:
L
i
k
i
i
L
i
i
i
L
i
f
x
x
x
T
p
f
gdzie
f
x
f
0
1
0
)
,...,
,...,
,
,
(
Współczynnik aktywności
składnika „i” w roztworze
Fugatywność czystego składnika „i” w fazie ciekłej pod tym
samym ciśnieniem i w tej samej temperaturze. Wzór
określający tą wielkość wyprowadziliśmy wcześniej.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
Fugatywność składnika w roztworach ciekłych
cd.
Poyntinga
czynnik
RT
p
p
v
Po
gdzie
Po
p
f
n
i
L
i
i
i
n
i
V
n
i
L
i
0
,
0
0
0
0
,
0
,
0
(
exp
)
(
)
(
Czynnik Poyntinga uwzględnia wpływ ciśnienia na fugatywność czystej cieczy.
Często przyjmuje się wartość tego czynnika równą 1.
Wartość z kolei współczynnika fugatywności pary nasyconej można albo
przyjmować równą 1 (dla niskich wartości p
n
) albo obliczać na postawie
równania wirialnego lub innych równań stanu.
Kluczową wielkością jest współczynnik aktywności, którego obliczanie jest
osobnym zagadnieniem. Porównując wzór definicyjny z regułą Lewisa – Randalla
możemy zauważyć, że w przypadku roztworów idealnych współczynniki aktywności
wszystkich składników muszą być równe 1.
k
i
RI
i
,...,
2
,
1
1
)
(
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
32
Na tym kończymy dzisiejszy
wykład
Dziękuję bardzo Państwu za
uwagę !
Z okazji zbliżających się Świąt
oraz Nowego 2014 Roku
składam Państwu serdeczne
życzenia wszystkiego najlepszego
!!!
Wyszukiwarka
Podobne podstrony:
Term proc i tech WYKLAD III
Term proc i tech W XII
Term proc i tech W XI
Term proc i tech W VIII
Term proc i tech W XIII
Elem. proc.tech, silniki spalinowe
Odlewnictwo Projekt, MBM, elnia, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc.tech, odlew
Narzędzia formierskie, MBM, elnia, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc.tech, odl
Spawalnictwo [1], MBM, uczelnia, VI semestr, odbytki, oup, ppt, skrawanie karta, Choroszy, Proj.proc
Proces technlogiczny, Proc. tech.wału.
wyklad3 tech bad
Kapitał proc
A dane,inf,wiedza,uj dyn stat proc inf w zarz 2008 9
wyklad 29 i 30 tech bad
Wyk12 term
Wyk4 term
Sp asp proc kom cz VII 2010
H Bankowość ele platnosci ele proc inf w zzarz 2008 9
info tech geodeta (1)(1)
więcej podobnych podstron