
Właściwości lecznicze chmielu zwyczajnego
(Humulus lupulus L.)
The medicinal properties of Humulus lupulus L.
Katedra Biochemii Ogólnej, Uniwersytet Łódzki
Kierownik Katedry: prof. dr hab. Barbara Wachowicz
WSTĘP
Chmiel zwyczajny (Humulus lupulus
L.) jest byliną dwupienną, należącą do rodziny konopiowatych
(Cannabinaceae)
. To roślina wieloletnia, wytwarzająca podziemne kłącza z rozłogami. Sugeruje się,
że kolebką chmielu są Chiny, ponieważ na ich terytorium znaleziono wszystkie gatunki Humulus (1).
Obecnie chmiel występuje w północnych regionach świata o klimacie umiarkowanym, jak również w
niektórych rejonach Australii, Afryki Południowej i Ameryki Południowej. Dla celów przemysłowych
uprawia się wyłącznie rośliny żeńskie, w celu utrzymania genetycznie konsekwentnego produktu.
Szyszki chmielowe, czyli owocostany chmielu (Strobili Lupuli
) stanowią cenny surowiec zarówno w
przemyśle browarniczym, jak i w lecznictwie. Żeńskie kwiatostany są baziami podobnymi do szyszek,
które określa się mianem strobili. Na powierzchni szyszek przy podstawie przylistków występują włoski
gruczo
łowe, wypełnione żywiczną substancją – lupuliną, która też ma zastosowanie w lecznictwie (2).
Związki chemiczne występujące w szyszkach chmielu przedstawiono w tabeli 1.
Tabela 1.
Średnia zawartość składników w suszonych szyszkach chmielu (4).
Związki
Zawartość procentowa (w/w)
a-Kwasy
2-17
b-Kwasy
2-10
Polifenole
3-6
Olejki eteryczne
0,5-3 (v/w)
Monosacharydy
2
Aminokwasy
0,1
Białka
15
Lipidy i kwasy tłuszczowe
1-5
Pektyny
2
Sole
10
Celuloza
– ligniny
40-50
Woda
8-12
Szyszki chmielowe są bogate w drugorzędowe metabolity roślin. Głównymi związkami
występującymi w dojrzałych żeńskich kwiatostanach Humulus lupulus są kwasy goryczowe
chmielowe, terpeny i chalkony. Zawierają one również glikozydy flawonolowe (rutynę, kemferol,
kwercetynę, kwercytrynę) i katechiny (galusan katechiny, galusan epikatechiny) (2). W skład olejku
eterycznego chmielu wchodzi wiele lotnych sk
ładników, w tym monoterpeny (myrcen) oraz
seskwiterpeny (β-kariofilen, farnezen, humulon), które razem stanowią 57-82% całej zawartości.
Różnice w ilości tych związków chemicznych są zależne od odmiany uprawnej oraz metod detekcji
(3).
Kwasy goryczowe chmi
elu obejmują α-kwasy (humulony) i β-kwasy (lupulony) (ryc. 1). Związki te
są prenylowymi pochodnymi floroglucyny. Występują w postaci bladożółtych olejów lub żywic łatwo
rozpuszczalnych w rozpuszczalnikach organicznych. W zależności od bocznego łańcucha acylowego
rozróżnia się pięć analogów: n-, ko-, ad-, pre-, posthumulony/lupulony. Głównym elementem
składowym α-kwasów są analogi: n-humulonu (35-70% α-kwasów), kohumulonu (20-65% α-kwasów) i
adhumulonu (10-
15% α-kwasów). β-Kwasy w porównaniu do α-kwasów mają dodatkową grupę
prenylową. Poza tym lupulony występują w dwóch różnych wzorach enolizacji. Przeważające analogi
β-kwasów występujące w chmielu to: lupulony (20-55% β-kwasów), kolupulony (20-55% β-kwasów),
adlupulony (10-
15% β-kwasów). Główna rola α-kwasów w przemyśle browarniczym polega na ich
izomeryzacji do odpowiednich gorzkich izo-
α-kwasów podczas gotowania brzeczki.
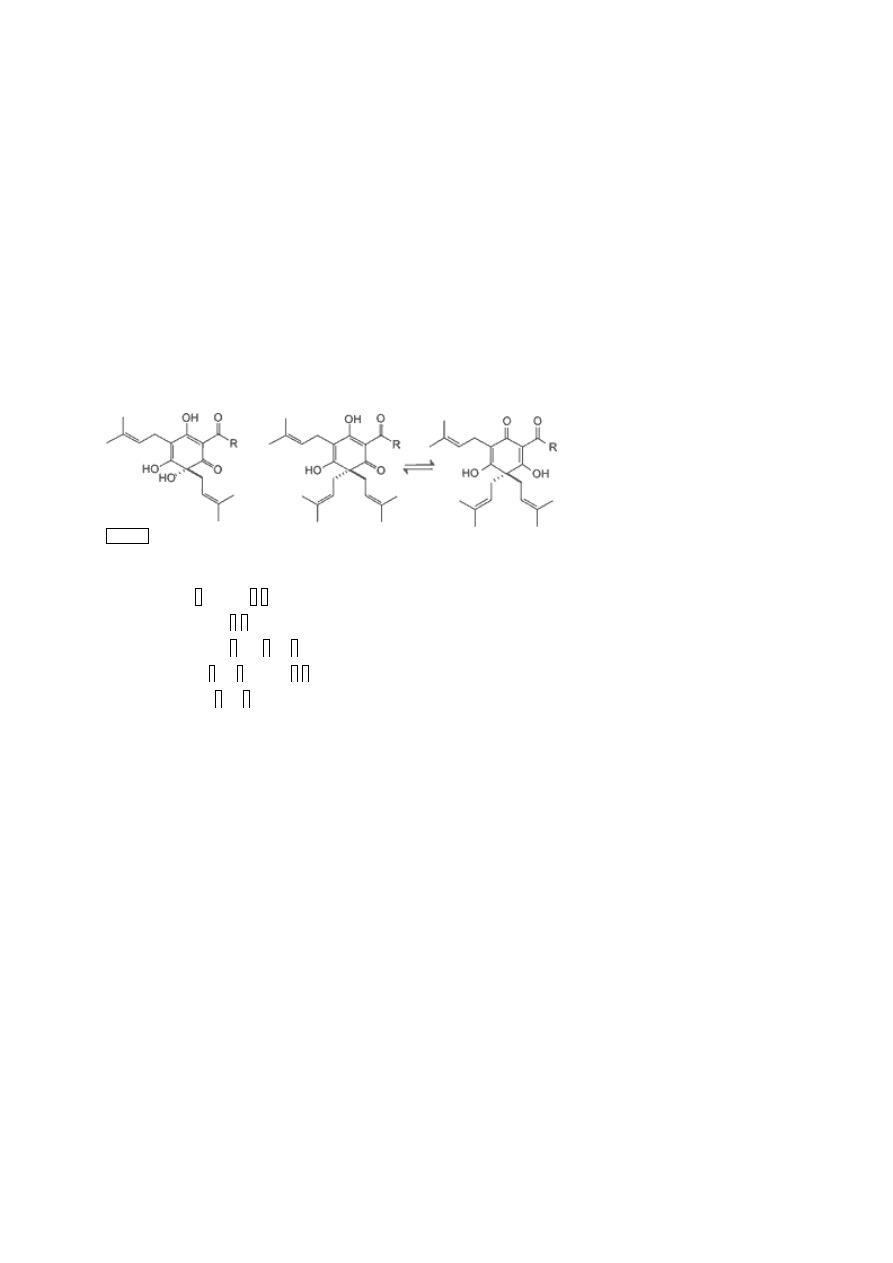
Ryc. 1.
Struktura chemiczna występujących w szyszkach chmielu α-kwasów i β-kwasów (4).
a-
Kwasy (humulony) β-Kwasy (lupulony)
n-: R = CH
2
CH(CH
3
)
2
ko-: R = CH(CH
3
)
2
ad-: R = CH(CH
3
)CH
2
CH
3
pre-: R = CH
2
CH
2
CH(CH
3
)
2
post-: R = CH
2
CH
3
Drugą ważną grupą drugorzędowych metabolitów szyszek chmielu są polifenole, obejmujące wiele
prenylowych chalkonów, takich jak ksantohumol (X) i desmetyloksantohumol (DMX), które są
prekursorami dla izomercznych flawanonów, odpowiednio: izoksantohumolu (IX) i 8-
prenylonaryngeniny (8-PN) (ryc. 2) (4).
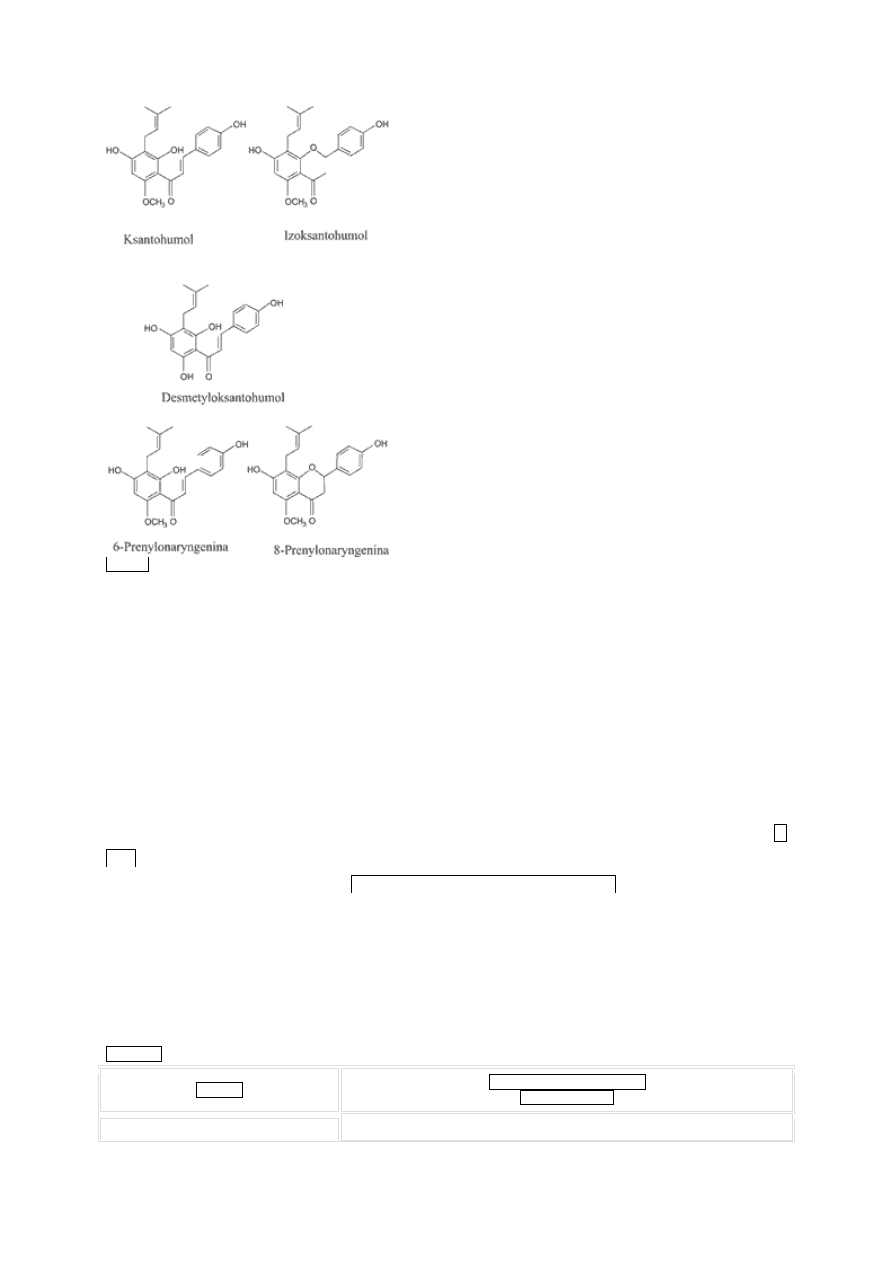
Ryc. 2.
Struktura chemiczna prenylowanych flawonoidów występujących w chmielu (2).
Badania dotyczące biologicznej aktywności związków występujących naturalnie w chmielu
skoncentrowane są na testowaniu ksantohumolu, α- i β-kwasów i 8-prenylonaryngeniny. Stwierdzono,
że związki te wykazują różnorodną aktywność biologiczną: przeciwbakteryjną, antyoksydacyjną,
ant
ykolagenazową,
estrogenną,
chemoprewencyjną,
przeciwzapalną,
apoptotyczną,
antyproliferacyjną wobec różnych linii komórek rakowych (np. wpływają na enzymy i czynniki
transkrypcyjne zaangażowane w karcynogenezę), obniżają też poziom cholesterolu oraz wykazują
właściwości przeciwwrzodowe (2, 4-6).
WŁAŚCIWOŚCI ANTYOKSYDACYJNE EKSTRAKTU Z SZYSZEK CHMIELU
Ze względu na szeroki zakres działania biologicznego związków zawartych w chmielu, są one
badane także jako potencjalne antyoksydanty. Yamaguchi i wsp. (7) wykazali w warunkach in
vitro
właściwości antyoksydacyjne dla kwasów goryczowych chmielu i ksantohumolu. W badaniach
tych zastosowano metodę ORAC (Oxygen Radical Absorbance Capacity – zdolność pochłaniania
wolnych rodników tlenowych) wykorzystywaną powszechnie do oceny zdolności antyoksydacyjnej w
próbkach biologicznych i żywności. Najwyższa wartość ORAC odpowiada najwyższej aktywności
antyoksydacyjnej. Jako kontroli o najwyższej wartości ORAC spośród jadalnych roślin użyto
polifenonu 60 (zawierającego katechiny z zielonej herbaty) i zaobserwowano, że całkowita wartość
ORAC dla ksantohumolu była porównywalna do polifenonu 60 i znacznie wyższa niż dla witaminy E i
C (tab. 2).
Tabela 2.
Wartość ORAC dla wybranych związków chemicznych występujących w szyszkach chmielu (7).
Związki
Całkowita wartość ORAC
(μmol troloksu)
Humulony
1,20

Lupulony
1,90
Ksantohumol
4,20
Witamina C
1,40
Witamina E
0,75
Polifenon 60
4,20
Autorzy zbadali również wartość SOAC, określającą zdolność wygaszania tlenu singletowego
(Singlet Oxygen Absorbance Capacity
), który powstaje w wyniku wzbudzenia cząsteczek tlenu i jest
wysoce reaktywny. W białkach tlen singletowy (
1
O
2
)
w największym stopniu uszkadza reszty
aminokwasowe metioniny, cysteiny, histydyny i tryptofanu. Spośród składników kwasów nukleinowych
najbardz
iej podatne na działanie
1
O
2
są reszty pirymidynowe, purynowe oraz guanina (8). Tlen
singletowy jest też zaangażowany w patogenezę wielu chorób skórnych, takich jak trądzik, atopowe
zapalenie skóry czy procesy starzenia skóry. W opisywanych badaniach dla ksantohumolu otrzymano
wartość SOAC 8-15-krotnie wyższą niż dla witaminy E czy polifenonu 60. Wyniki tych badań wskazują
jednoznacznie, że ksantohumol jest jednym z najlepszych naturalnie występujących antyoksydantów
pod względem zdolności zmiatania tlenu singletowego (tab. 3) (7).
Tabela 3.
Wartość SOAC dla wybranych związków występujących w szyszkach chmielu (7).
Związki chemiczne
SOAC
μmol troloksu
Humulony
0,75
Lupulony
0,80
Ksantohumol
14,10
Witamina E
1,00
Polifenon 60
1,80
W innych badaniach nad kwasami goryczowymi chmielu wykazano hamowanie przez humulony
hemolizy erytrocytów indukowanej nadtlenkiem wodoru. Odnotowano również inhibicję peroksydacji
lipidów, zarówno w przypadku α-kwasów, jak i β-kwasów, a związki chmielu wykazały nawet silniejsze
działanie niż α-tokoferol czy kwas askorbinowy (4).
WŁAŚCIWOŚCI ANTYBAKTERYJNE I PRZECIWGRZYBICZNE EKSTRAKTU Z SZYSZEK
CHMIELU
Coraz więcej drobnoustrojów chorobotwórczych wytwarza oporność wobec stosowanych do tej
pory antybiotyków. Poszukując nowych leków i związków wspomagających leczenie wielu chorób,
naukowcy intensywnie badają różne ekstrakty roślinne, w tym również chmiel. W badaniach
prowadzonych w warunkach in vitro
wykazano silną aktywność hamującą lupulonów i ksantohumolu
w
obec bakterii indukujących powstawanie trądziku (Propionibacterium acnes, Staphylococcus
epidermidis, Staphylococcus aureus, Streptococcus pyogenes i Kocuria rhizophila
). Niskie wartości
minimalnych stężeń hamujących związków chmielu są porównywalne do antybiotyków najczęściej
stosowanych do leczenia trądziku (erytromycyna i klindamycyna) (7).
W innych badaniach wykazano, że ksantohumol jest związkiem o szerokim spektrum działania
przeciwko bakteriom Gram-dodatnim (Streptococcus mutans i Staphylococcus aureus), grzybom
(Trichophyton
spp.) i wirusom (wirus zakaźnej biegunki bydła BVDV, wirus opryszczki pospolitej typ 1 i

2, cytomegalowirus, HIV-
1). Wykazano również silne hamowanie replikacji zarodźca malarii,
wywołującego malarię u ludzi (5). Ponadto, badania w układzie modelowym in vitro nad
współdziałaniem lupulonów i ksantohumolu z niektórymi antybiotykami w hamowaniu rozwoju
drobnoustrojów, wykazały pozytywne współdziałanie związków chmielu z polimyksyną, tobramycyną i
cyprofloksacyną.
Nie zbadano jednak d
otąd mechanizmów odpowiadających za to zjawisko. Sugeruje się, że
antybakteryjne działanie związków występujących w chmielu oparte jest na zmianie właściwości i
przepuszczalności błony komórkowej drobnoustrojów. Połączenie terapii antybiotykowej z ekstraktem
z chmielu mogłoby spowodować obniżenie potrzebnej ilości antybiotyku, a tym samym zmniejszenie
prawdopodobieństwa rozwoju oporności oraz zmniejszenie toksyczności leku dla osoby leczonej.
Należy jednak pamiętać, że te badania mają charakter in vitro, a związki występujące w ekstrakcie z
chmielu nie mogą być używane ogólnoustrojowo, gdyż ich przeciwdrobnoustrojowe działanie w
surowicy krwi jest znacznie niższe (9).
WŁAŚCIWOŚCI ESTROGENNE EKSTRAKTU Z SZYSZEK CHMIELU
W celu łagodzenia symptomów klimakterium często stosuje się hormonalną terapię zastępczą
(HTZ). Dostępne dane wskazują na powiązanie stosowania HTZ ze zwiększonym ryzykiem
wystąpienia choroby zakrzepowo-zatorowej. Zjawisko to powoduje zmniejszenie liczby pacjentek
korzystających z HTZ (6). Wzrasta natomiast zainteresowanie wykorzystaniem ziołowych preparatów
uważanych powszechnie za bezpieczne. Ponadto, wiadomo jest, że rośliny zawierają substancje
fitoestrogenne, które dają efekt podobny do działania estrogenu. Pomimo, że ich chemiczna struktura
nie jest powiązana ze steroidami, związki te mogą wiązać się z receptorami estrogenu (ER) (10).
Najsilniejszą aktywność estrogenną w chmielu wykazuje 8-prenylonaryngenina (8-PN), która
powstaje przez izomeryzację prekursorowego chalkonu – desmetyloksantohumolu (11). 8-PN może
powstawać również jako produkt demetylacji izoksantohumolu u ludzi dzięki aktywności mikroflory
jelitowej. Konwersja ta (do 80%) ma miejsce jedynie w dystalnym odcinku okrężnicy (12). Dodatkowo
w wyniku cyklizacji indukowanej przez kw
as solny w żołądku ksantohumol może być przekształcony
do izoksantohumolu. Wszystkie te procesy wpływają na poziom estrogennej 8-prenylonaryngeniny in
vivo (13).
Schaefer i wsp. (18) wykazali, że substancja ta jest najsilniejszym roślinnym agonistą ERα, tj. około
10 razy silniejszym związkiem niż koumestrol i około 100-krotnie silniejszym niż genisteina. Ponadto
stwierdza się, że in vitro 8-PN wykazuje ponad dwa razy większe powinowactwo do ERα niż do ERβ.
Warto też zauważyć, że in vivo estrogenna działalność tej prenylowej pochodnej naryngeniny jest
około 20 000 razy słabsza w porównaniu do 17β-estradiolu (14). W badaniach zapewniających
losowość wyboru osób objętych badaniem, kontrolę przez placebo i wykorzystanie standaryzowanego
na 8-
PN (100 albo 250 μg) ekstraktu chmielowego, wykazano pozytywne działanie w odniesieniu do
objawów naczynioruchowych i innych dolegliwości związanych z menopauzą. W szczególności
zmniejszenie uderzeń gorąca przez podawanie wyciągu z chmielu było znaczące. Nie wykazano
natomiast związku pomiędzy dawką a efektem leczniczym, ponieważ wyższa dawka (250 μg) była
tylko niewiele bardziej skuteczna od placebo. Natomiast dawka 100 μg wykazywała wysoką
efektywność. Jak sugerują autorzy, mogło to być spowodowane niewystarczającym wchłanianiem
większych ilości 8-PN przez organizm. Pomimo to prenylowe flawonoidy chmielu mogą być
skutecznym dodatkiem do alternatywnego leczenia objawów menopauzy (15).
AKTYWNOŚĆ CHEMOPREWENCYJNA EKSTRAKTU Z SZYSZEK CHMIELU
Celem chemoprewenc
ji jest zapobieganie procesowi nowotworowemu dzięki stosowaniu
naturalnych lub syntetycznych związków hamujących pojawienie się zmian przednowotworowych.
Substancje te, głównie pochodzenia roślinnego, przejawiają nieznaczącą toksyczność (16). Według
dostępnych danych główne prenylowe flawonoidy chmielu wykazują w różnym stopniu właściwości
chemoprewencyjne. Rozwój wielu chorób nowotworowych (m.in. raka śluzówki macicy, sutka, prostaty
i okrężnicy) zależny jest od poziomu estrogenów. Zarówno żeńskie hormony płciowe, jak też ich
metabolity, mogą indukować wolnorodnikowe uszkodzenia DNA oraz niestabilność genetyczną (17).
Ksantohumol, izoksantohumol i 8-
PN w badaniach z użyciem komórek Sk-Br-3 raka piersi
hamowały aktywność aromatazy, odpowiadającej za syntezę estrogenów. Ponadto związki te
indukowały apoptozę i zmniejszały proliferację komórek rakowych. Hamowanie namnażania się
komórek można wyjaśnić przynajmniej częściowo przez niedostateczną dostępność estrogenu
spowodowaną zmniejszoną aktywnością aromatazy, gdyż w obecności 17β-estradiolu następuje
przywrócenie proliferacji (18). Ksantohumol również w przypadku badań in vitro prowadzonych nad
białaczką okazał się skuteczny. Po inkubacji chalkonu z limfocytami, pochodzącymi od pacjentów
chorujących na limfocytową białaczkę B-komórkową, odnotowano zależne od dawki indukowanie
śmierci komórek (19). Wykazano też, że w przypadku raka prostaty substancje X, 6-PN, 8-PN i IX
wykazują aktywność antyproliferacyjną (20). Ksantohumol i jego utleniona pochodna – ksantoaurenol
(XAL), indukują apoptozę zależną od dawki, zarówno w komórkach hyperplazji (BPH-1), jak też
złośliwego raka prostaty (PC3). Komórki BPH-1 były bardziej wrażliwe na działanie XN niż komórki
PC-
3. Dlatego też skuteczność działania substancji XN i XAL ograniczona jest do wczesnej
karcynogenezy lub hiperplazji prostaty.
Nowotwory człowieka odznaczają się również konstytutywną aktywacją czynnika transkrypcji NFκB
prowadzącą do nadekspresji genów kodujących cytokiny zapalne, cząsteczki adhezyjne, czynniki
wzr
ostu i białka antyapoptotyczne. Wykazano, że związki X i XAL hamują działanie NFκB jedynie w
komórkach hiperplazji prostaty, ale nie w złośliwym nowotworze (21). Ponadto właściwości
antymutagenne związków chmielu są niezwykle ważne dla chemoprewencji. Kac i wsp. (22) stwierdzili
antymutagenną aktywność X przed mutacjami indukowanymi 2-amino-3-metyloimidazo (4,5-f)
chinozolem (IQ), zarówno dla bakteryjnych komórek Salmonella typhimurium TA98, jak i ludzkich
komórek wątrobiaka HepG2. Komórki HepG2 są bardzo dobrym wskaźnikiem przy badaniu
antymutagenów żywieniowych, gdyż utrzymują działalność wielu enzymów metabolizujących leki w
formie indukowalnej, a genotoksyczność wielu karcynogenów m.in. IQ zależy od ich metabolicznej
aktywacji do reaktywnych mediatorów. Wykazano natomiast, że sam X nie wpływa na zdolności
przeżyciowe komórek HepG2 i nie indukuje uszkodzeń DNA. Wyniki tych badań potwierdzają silnie
ochronną aktywność X przed genotoksycznością pożywienia na przykładzie rakotwórczego IQ.
Różnorodne działanie chemoprewencyjne ksantohumolu przedstawiono na rycinie 3.
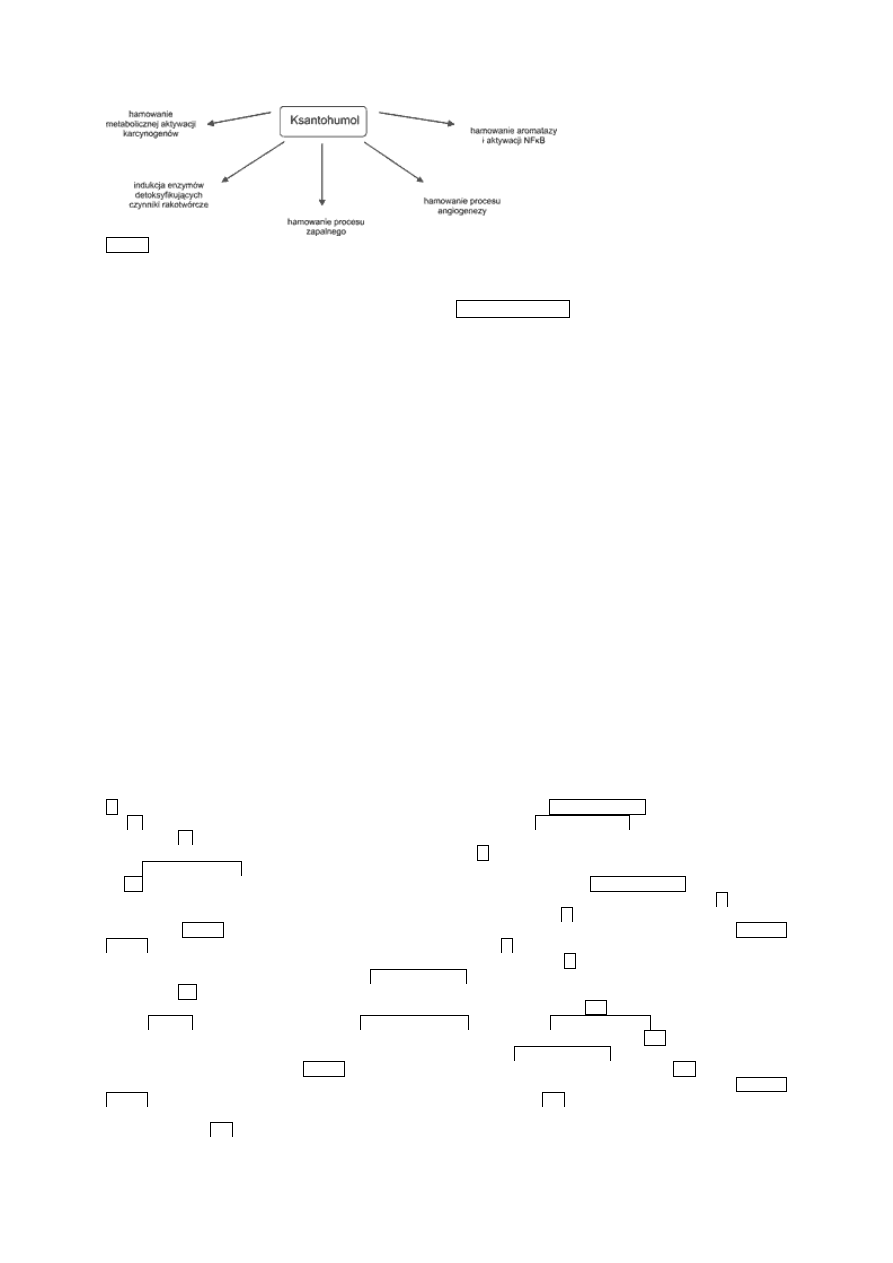
Ryc. 3.
Ksantohumol jako związek chemoprewencyjny o szerokim spektrum działania (22).
WŁAŚCIWOŚCI USPOKAJAJĄCE EKSTRAKTU Z SZYSZEK CHMIELU
Połączenie terapii z zastosowaniem ekstraktu z Humulus lupulus z innymi ekstraktami ziołowymi
jest od dawna stosowane w p
ostaci środka uspokajającego i nasennego. Ziołowe mieszanki nie
pozwalają jednakże ocenić potencjalnej skuteczności klinicznej chmielu zażywanego osobno.
Początkowo uważano, że substancją odpowiedzialną za działanie uspokajające i nasenne chmielu
jest 2-metylo-3-buten-2-
ol, produkt reakcji degradacji kwasów goryczowych, ale zawartość procentowa
tego alkoholu w świeżym chmielu wynosi jedynie 0,012-0,042%. Jest zatem zbyt niska, aby ten
związek chemiczny mógł odgrywać główną rolę w aktywności uspokajającej.
S
chiller i wsp. (23) badali konsekwencje do ustnego podawania szczurom zarówno etanolowego
ekstraktu chmielowego, jak i ekstraktu uzyskanego w warunkach nadkrytycznych z wykorzystaniem
dwutlenku węgla. Obydwa ekstrakty z chmielu redukowały spontaniczną aktywność motoryczną,
wydłużyły czas snu indukowanego kolejno: ketaminą i eterem oraz obniżyły temperaturę ciała,
potwierdzając uspokajającą aktywność chmielu. Jednak największą aktywność wykazano dla
ekstraktu zawierającego głównie α-kwasy (25 mg/kg).
Nie można jednak wykluczyć, że chmiel może zawierać dodatkowe czynne substancje o aktywności
uspokajającej (23). W badaniach z wykorzystaniem zwierząt, doustne podawanie lupulonów
spowodowało obniżenie efektu nasennego pentobarbitalu, nasilenie drgawek indukowanych
pikrotoksyną i wzmożoną motorykę. Wyniki te sugerują antagonistyczny wpływ β-kwasów na
neurotrasmisję GABAergiczną, zmniejszając prawdopodobieństwo udziału tej frakcji kwasów
goryczowych we właściwościach uspokajających chmielu (24).
Piśmiennictwo
1. Murakami A, Darby P, Javornik B i wsp. Molecular phylogeny of wild hops, Humulus lupulus L. Heredity 2006; 97:66-
74. 2. Zanoli P, Zavatti M. Pharmacognostic and pharmacological profile of Humulus lupulus L. J Ethnopharmacol 2008;
116:383-96. 3. Chadwick LR, Pauli GF, Farnsworth NR. The pharmacognosy of Humulus lupulus L. (hops) with an
emphasis on estrogenic properties. Phytomed 2006; 13:119-31. 4. Van Cleemput M, Cattoor K, De Bosscher K i wsp.
Hop (Humulus lupulus)
– derived bitter acids as multipotent bioactive compounds. J Nat Prod 2009; 72:1220-
30. 5.
Gerhäuser C. Broad spectrum antiinfective potential of xanthohumol from hop (Humulus lupulus L.) in comparison
with activities of other hop constituents and xanthohumol metabolites. Mol Nutr Food Res 2005; 49:827-31. 6.
Dębski R.
Hormonalna terapia zastępcza a rak sutka. Post Nauk Med 2008; 4:240-5. 7. Yamaguchi N, Satoh-Yamaguchi K,
Mitsunori O. In vitro evaluation of antibacterial, anticollagenase, antioxidant activities of hop components ( Humulus
lupulus) addressing acne vulgaris. Phytomed 2009; 16:369-76. 8. Puzanowska-Tarasiewicz H, Starczewska B,
Kuźmicka L. Reaktywne formy tlenu. Bromat Chem Toksykol 2008; 41:1007-15. 9. Natarajan P, Katta S, Andrei I i wsp.
Positive antibacterial co-action between hop (Humulus lupulus) constituents and selected antibiotics. Phytomed 2008;
15:194-201. 10.Kretzschmar G, Zierau O, Wober J i wsp. Prenylation has a compound specific effect on the
estrogenicity of naringenin and genistein. J Steroid Biochem Mol Biol 2010; 118:1-6. 11. Overk CR, Guo J, Chadwick LR
i wsp. In vivo estrogenic comparisons of Trifolium pratense (red clover), Humulus lupulus (hops), and the pure
compounds isoxanthohumol and 8-prenylnaringenin. Chem-Biol Interactions 2008; 176:30-9. 12. Possemiers S, Bolca
S, Grootaert C i wsp. The prenylflavonoid isoxanthohumol from hops (Humulus lupulus L.) is activated into the potent
phytoestrogen 8-prenylnaringenin in vitro and in the human intestine. J Nutr 2006; 136:1862-7. 13. Nikolic D, Li Y,
Chadwick LR i wsp. Metabolism of xanthohumol and isoxanthohumol, prenylated flavonoids from hops ( Humulus
lupulus L.), by human liver microsomes. J Mass Spectrom 2005; 40:289-99. 14.
Schaefer O, Hümpel M, Fritzemeier K i
wsp. 8-Prenylnaringenin is a potent ER
α selective phytoestrogen present in hops and beer. J Steroid Biochem Mol Biol
2003; 84:359-60. 15. Heyerick A, Vervarcke S, Depypere H i wsp. A first prospective, randomized, double-blind,
placebo-controlled study on the use of a standardized hop extract to alleviate menopausal discomforts. Maturitas 2006;
54:164-75. 16. Wolanin K, Piwocka K. Kurkumina
– od medycyny naturalnej do kliniki. Kosmos 2008; 1-2:53-
65. 17.
Makowski M, Połać I, Pertyński T. Estrogeny a rak sutka. Przegl Menopauz 2007; 3:150-4. 18. Monteiro R, Faria
A, Azevedo I i wsp. Modulation of breast cancer cell survival by aromatase inhibiting hop ( Humulus lupulus L.)
flavonoids. J Steroid Biochem Mol Biol 2007; 105: 124-30. 19. Lust S, Vanhoecke B, Janssens A i wsp. Xanthohumol
kills B-chronic lymphocytic leukemia cells by an apoptotic mechanism. Molecul Nutr Food Res 2005; 49:844-
50. 20.
Delmulle L, Bellahcène A, Dhooge W i wsp. Anti-proliferative properties of prenylated flavonoids from hops
(Humulus lupulus L.) in human prostate cancer cell lines. Phytomed 2006; 13:732-4. 21. Colgate EC, Miranda CL,
Stevens JF i wsp. Xanthohumol, a prenylflavonoid derived from hops induces apoptosis and inhibits NF-kappaB
activation in prostate epithelial cells. Canc Let 2007; 246:201-9. 22.
Kac J, Plazar J, Mlinarič A i wsp. Antimutagenicity of
hops (Humulus lupulus L.): bioassay-directed fractionation and isolation of xanthohumol. Phytomed 2008; 15:216-
20. 23. Schiller H, Forster A, Vonhoff C i wsp. Sedating effects of Humulus lupulus L. extracts. Phytomed 2006; 13:535-
41. 24. Zanoli P, Zavatti M, Rivasi M i wsp. Evidence that the
β-acids fraction of hops reduces central GABAergic
neurotransmission. J Ethnopharmacol 2007; 109:87-92.
Wyszukiwarka
Podobne podstrony:
Właściwości lecznicze chmielu zwyczajnego
Chmiel zwyczajny, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwoś
Fasola zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwoś
Karczoch zwyczajny, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciw
Tatarak zwyczajny, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwo
Kminek zwyczajny, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwoś
Cebula zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwoś
Pietruszka zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własc
Len zwyczajny, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwości
Bukwica zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwo
Sosna zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwośc
Babka zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwośc
Wrzos zwyczajny, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwośc
Dziurawiec zwyczajny, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własc
Pokrzywa zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciw
Kasztanowiec zwyczajny, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - wła
Szanta zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwoś
Fasola zwyczajna, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwoś
Por, Zdrowie, diety, porady, Rośliny lecznicze cz I.jpg, Zioła leczą, Zioła - własciwości lecznicze
więcej podobnych podstron