CHEMIA KLINICZNA - WYKŁAD 1 2.10.2008
Równowaga kwasowo-zasadowa
- wykładniki laboratoryjne RKZ
- kliniczne postacie zaburzeń RKZ
Utrzymanie prawidłowego stanu rk-z zależne jest od działania następujących czynników:
układów buforowych krwi i tkanek
zewnątrzkomórkowych
wewnątrzkomórkowych
buforowania narządowego przez:
nerki
układ oddechowy
układ kostny
buforowania komórkowego
Układy buforowe krwi
kwas węglowy/ wodorowęglan (53%)
H2CO3/ HCO3-
CO2 rozp./ HCO3-
hemoglobina/ hemoglobinian // oksyhemoglobina/ oksyhemoglobinian (35%)
HHb/Hb-// HHbO2 / HbO2-
białko/ białczany (7%)
HPr/ Pr-
fosforany jednozasadowe/ dwuzasadowe (5%)
H2PO4-/ HPO42-
Bufor wodorowęglanowy
Układ buforowy CO2/ HCO3- zależy od dwóch procesów:
- uwodnienia CO2
- dysocjacji H2CO3
CO2 + H2O ↔ H2CO3 ↔H+ + HCO3-
Działanie buforu opisuje równanie Hendersona - Hasselbalcha
pH= pK + log ![]()
pH = pK + ![]()
![]()
a - współczynnik rozpuszczalności Bunsena = 0,03
pK - ujemny log K H2CO3
pH = ![]()
Bufor hemoglobinianowy
pH = ![]()
dla hemoglobiny zredukowanej
pH = ![]()
dla oksyhemoglobiny
Bufor białczanawy
pH = ![]()
dla ładunków ujemnych
pH = ![]()
dla ładunków dodatnich
Bufor fosforanowy
pH = 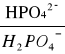
Komórkowa regulacja RKZ
Wymiana jonów wodorowych i jonów potasowych pomiedzy przestrzenią pozakomorkową i komórkową
Kwasica → hiperkaliemia
Zasadowica → hipokaliemia
Hiperkaliemia → kwasica metaboliczna
Hipokaliemia → zasadowica metaboliczna
Rola nerek w utrzymaniu rk-z organizmu
Nerki aktywnie eliminują H+ i regenerują ![]()
poprzez następujące mechanizmy:
- resorpcje zwrotna wodorowęglanów
- amoniogeneze
- tzw. Kwaśność miareczkową moczu
Nerkowa regulacja RK-Z
Nerka spełnia swą funkcje regulacyjną poprzez następujące mechanizmy:
wchłanianie zwrotne HCO3-, w takiej postaci w jakiej są przesączone w kłębuszkach nerkowych, odbywa się w kanaliku bliższym nerki i odpowiada za wchłanianie ok. 20% HCO3- .
wchłanianie zwrotne wodorowęglanów, wytwarzanych w komórkach kanalika nerkowego, któremu towarzyszy buforowanie powstałych jednocześnie jonów H+ przez HCO3- przesączany w kłębuszkach i znajdujący się w świetle kanalika, ten mechanizm zachodzi w:
kanaliku bliższym
kanaliku dalszym
kanaliku zbiorczym
W wyniku mechanizmów 1 i 2 w kanaliku bliższym wchłania się 80-85 % HCO3- . Reszta (15-20%) wchłania się w kanaliku dalszym i zbiorczym w wyniku mechanizmu 2.
Wchłanianie zwrotne HCO3- tworzonych w komórkach kanalika nerkowego, któremu towarzyszy buforowanie powstałych jednocześnie jonów H+ przez niewodorowęglanowe zasady buforowe w świetle kanalika (głównie HPO42- i NH3)
Ten proces buforowania zachodzi głównie w kanaliku dalszym i zbiorczym nerki.
Wzajemna zależność pomiędzy ilościa wchłanianych zwrotnie HCO3- i Cl-.
↑ wchłaniania HCO3- => ↓ wchłaniania Cl- → hipochloremia
W zasadowicy metabolicznej
W kwasicy oddechowej (wyrównanej)
Kwaśność miareczkowa
HPO42- + H+ → H2PO4-
H2PO4- w moczu określa się mianem kwaśności miareczkowej ( TA, ang. titratable acidity )
Oznacza się miareczkując mocz mocną zasadą do pH 7,40.
TA obejmuje nie tylko H2PO4- , ale także inne kwasy występujące w moczu:
- kreatynina (pK ok. 4,9)
- cytryniany kwaśne (pK ok. 5,3)
- kwas β-hydroksymasłowy (pK ok. 4,7)
Ze względu na ich małe stężenie działanie ich jest ograniczone.
Ocena wydalania jonów wodorowych przez nerki na podstawie badań laboratoryjnych
Kwaśność „netto” = TA + NH4+ - HCO3-
TA ≈ 30 mmol/24h (10-30)
NH4+ ≈ 40 mmol/24h (30-50)
HCO3- ≈ praktycznie bez znacznia (<1)
H+ wyd. 50-70 mmol/24h (30-80)
Efektywność regulacji nerkowej w zależności od potrzeb
Przy małym pH moczu (≈5) największy udział w wydalaniu jonów H+ ma NH4+ (pK NH4+ = 9).
Układ buforowy H2PO4-/ HPO42- wydaje się być najbardziej zbliżony do idealnego dla moczu o umiarkowanie kwaśnym odczynie (pK H2PO4- = 6,8).
W przypadku większego pH moczu (pH8) stosunek stężeń HCO3-/ CO2 ulega przesunięciu na korzyść HCO3-.
Układ odechowy
Wymiana gazowa w płucach zależy od:
wentylacji płucnej
perfuzji naczyń włosowatych, przepływ krwi przez naczynia włosowate pęcherzyków płucnych
dyfuzje gazów przez ściany pęcherzyków płucnych
prawidłowego stosunku wielkości wentylacji do wielkości perfuzji (0.90)
Rola układu kostnego w utrzymaniu RK-Z
Proces osteogenezy ma tendencję do zakwaszania, a osteolizy - do alkalizacji organizmu.
Parametry laboratoryjne do oceny komponentu metabolicznego
- aktualne stężenie wodorowęglanów
- standardowe stężenie wodorowęglanów
- zasady buforowe
- nadmiar zasad
- standardowy nadmiar zasad
- luka anionowa
Aktualne stężenie wodorowęglanów - oznaczenie przy aktualnym pCO2
Parametr zależny od pCO2
pCO2
↑↓
CO2 rozp + H2O ↔ H2CO3 ↔ H+ + HCO3-
Stężenie CO2 rozp. jest w równowadze z jego ciśnieniem cząstkowym
↑ pCO2 powoduje ↑ CO2 rozp. → ↑ HCO3-
Zmiany komponentu oddechowego (pCO2) muszą wpływać na aktualne stężenie HCO3-
Standardowe stężenie wodorowęglanów
Oznacza ich stężenie w osoczu krwi całkowicie utlenowanej i wysycanej CO2 przy ciśnieniu parcjalnym 40 mmHg w temperaturze 37o C.
Jest to dobry miernik komponentu nieoddechowego, precyzyjnie określający udział tego komponentu w zaburzeniu lub w kompensacji. Jednakże, obejmując część zasad buforowych nie dają one odpowiedzi na pytanie o ilościowy udział komponentu nieoddechowego w zaburzeniu RK-Z.
Aby spełnic powyższe wymagania wprowadzono pojęcie zasady buforowe.
Zasady buforowe (BB) i normalne zasady buforowe (NBB)
BB stanowi sumę wszystkich zasad buforowych, zarówno wodorowęglanowych, jak i niewodorowęglanowych, oznaczonych we krwi całkowicie utlenowanej.
Parametr ten jest nie zależny od pCO2
HBuf
↑↓
pCO2 Buf
↑↓ +
CO2 rop. + H2O ↔ H2CO3 ↔ H+ + HCO3-
↑ pCO2 → ↑ HCO3-
↑ HCO3- → ↓ Buf
(zasady buforowe niewodoroweglanowe)
SUMA STĘŻEŃ WSZYSTKICH ZASAD BUFOROWYCH POZOSTANIE STAŁA
Zasady buforowe (BB) można określić dla osocza (BBp)
Oraz dla pełnej krwi (BBb)
BBp = 41,7 mmol/l = NBBp
(prawidłowe - normalne zasady buforowe)
BB w masie krwiakowej - 55,7 mmol/l
NBBb = 41,7 + 0,42 x HGB w g/dl
dla HGB = 15 g/dl
NBBb = 41,7 + 0,42 x 15 = 48 mmol/l
NBBb = 41,7 + 0,42 x 12 = 46,7 mmol/l
NBBb = 41,7 + 0,42 x 16 = 48, 4 mmol/l
Fakt, że prawidłowa wartość NBBb zależy od prawidłowego stężenia HGB, stanowi pewną niedogodność, gdyż oznacza, że każdy badany ma własną normę dla tego parametru. W tym celu wprowadzono pojęcie nadmiaru zasad.
Nadmiar zasad (BE)
Oznacza liczbę mmol mocnego kwasu (przy właściwym nadmiarze zasad) lub mocnej zasady (przy deficycie zasad), która dodana do 1 litra krwi przy pCO2 - 40 mmHg i w temp. 40 st. C doprowadzi pH osocza tej krwi do prawidłowej wartości 7,40
BE-BB-NBB
Powodem tego zjawiska jest fakt, że jony wodorowęglanowe są drobnocząsteczkowe i swobodnie dyfunduja do przestrzeni śródmiąższowej, w przeciwieństwie do białek (HGB).
Wobec tego wprowadzono pojęcie standardowy nadmiar zasad.
Standardowy nadmiar zasad (SBE)
Wartość zasad buforowych odczytywana jest nie przy aktualnym stężeniu HGB, lecz przy takim stężeniu, jakie wykazywało by HGB, gdyby penetrowała do całej przestrzeni pozakomórkowej, której objętość wynosi ok. 12,5 l.
Z kalkulacji wynika:
Przyjmując HGB = 15 g/dl krwi oraz objętość krwi 5 l, stężnie HGB w przestrzeni pozakomórkowej wynosiło by 6 g/dl. Przy takim więc stężeniu HGB zalecono odczytywać wartości BE. Jest to SBE
Luka anionowa
[Na+] + ∑NK = ([CT] + [HCO3-]) + ∑NA
∑NA - ∑NK = [Na+] - ([CT] + [HCO3-])
∑NA - ∑NK = LA
LA = [Na+] - ([CT] + [HCO3-])
LA = 12 ± 4 mEq/l
LA = [Na+] + [K+] - ([CT] + [HCO3-])
LA = 16,5 ± 4 mEq/l
Luka osmolalna (LO)
LO = osmolalność oznaczona - osmolaność obliczona
Osmolalność = 2 x [Na+] + [glukoza] + [mocznik] (mmol/l)
LO< 10 mmol/kg H2O
↑ LO => zatrucie metanolem, itd.
Parametry laboratoryjne do oceny czynności oddechowej
pCO2 i pO2 - oznacza się bezpośrednio
SO2 - oznacza się bezpośrednio jak i kalkulacyjnie
P50 - kalkulacyjnie
ctO2 - zawartość tlenu we krwi
ctCO2 - zawartość dwutlenku węgla we krwi
Miernikiem komponentu oddechowego jest pCO2
pO2 nie jest dobrym miernikiem komponentu oddechowego ze względu na stosunkowo dużą różnicę pO2 we krwi tetniczej 90-100 mmHg i żylnej w przybliżeniu 40 mmHg.
Jednak pO2 stanowi ważny parametr pozwalający na wczesne wykrycie niewydolności oddechowej, gdy nie powoduje ona jeszcze zmniejszenia SO2.
Wysycenie hemoglobiny tlenem (saturacja)
Procentowa zawartość oksyhemoglobiny wobec hemoglobiny jako całości
SO2 = ![]()
X 100
Zawartość tlenu we krwi
ctO2 = O2 związany z Hb + O2 rozp. Fizycznie
O2 rozp. Fizycznie = pO2 X α
Prawie cała ilość tlenu zawartego we krwi jest związana z hemoglobiną (90%). Nawet bardzo wysokie ciśnienie cząsteczkowe tlenu nie zwiększy w istotny sposób zawartości tego gazu we krwi, gdyż transport tlenu we krwi zależy prawie wyłącznie od Hb, ta zaś ma określona pojemność tlenową której nie może przekroczyć, bez względu na ciśnienie cząsteczkowe tlenu.
Nowe możliwości w ocenie zaburzeń oddechowych
analizator RK-Z
pH, pCO2, pO2 (parametry zmierzone)
oksymetr
tHb, COHb, MetHb, SO2 (parametry zmierzone)
parametry wprowadzone
- temperatura pacjenta
- ciśnienie powietrza
- zawartość tlenu w powietrzu wdychanym
Parametry: px, cx, Qx
px - ciśnienie ekstrakcyjne tlenu
cx - stężenie ekstrakcyjne tlenu
Qx - wskaźnik kompensacji tlenowej
Te nowe parametry zastępują dotychczasowe pO2 i SO2.
Przydatne w ocenie dostępności tlenu do tkanek.
Program komputerowy OSA (Oxygen Status Algorithm)
Uzyskuje się:
- px,cx, Qx
- P50, 2,3 - DPG
- ciśnienie parcjalne tlenu w powietrzu pęcherzykowym (pO2A)
- ciśnienie parcjalne tlenu w powietrzu wdychanym (pO2I)
- shunt - wskaźnik przecieku tlenowego w płucach (domieszka krwi żylnej we krwi tetniczej)
- stężenie efektywnej Hb (ceHb)
Etapy przemiany tlenowej
Ładowanie krwi tlenem - zależy od:
- pO2I
- pO2A
- shunt
Transport tlenu przez krew zależy od:
- ctO2 - stężenie tlenu we krwi tętniczej, które zależy od stężenia Hb efektywnej
ceHb= ctHb (1-FCOHb - FMetHb)
ctO2= ceHb x SO2 + pO2 x α
Ładowanie tlenu do tkanek
Zależy od powinowactwa Hb do tlenu (krzywa dysocjacji oksyhemoglobiny)
- P50
- 2,3-DPG, pH, pCO2, temp.
- px, cx, Qx
ZAKRESY WARTOŚCI REFERENCYJNYCH PODSTAWOWYCH PARAMETRÓW RK-Z
KREW KAPILARNA |
|
pH |
7,35 -7,45 (45-35 mmol/l H+) |
pCO2 |
35,0 - 45,0 mmHg (4,67 - 6,00kPa) |
pO2 |
65 - 95 mmHg (11,33 - 13,33 kPa) |
[HCO3-] (akt.) |
21-27 mmol/l |
[HCO3-] (stęż.) |
22-26 mmol/l |
BB |
48 mmol/l |
BE |
0 ± 2,5 mEq/l |
SBE |
0 ± 2,5 mEq/l |
Sat O2 |
70 - 95 % |
ctO2 |
19,0 - 21,0 ml/dl |
ctCO2 |
20 ml/dl |
Kwasice metaboliczne
KM na skutek zwiększonego wytwarzania nielotnych kwasów w organizmie (kwasice addycyjne).
ketonowa
- cukrzycowa
- głodowa
- poalkoholowa
mleczowa
- typ A - wywołane bezwzględnym lub względnym niedotlenieniem tkanek z wyraźnymi cechami hipoksji
- typ B - bez wyraźnych cech hipoksji
o innej etiologi
- w zatruciach glikolem etylenowym, salicylanami
KM na skutek zmniejszonego wydalania jonów H+ z organizmu (kwasice retencyjne).
Nekowe kwasice kanalikowe.
Ostra niewydolność nerek oraz przewlekła niewydolnośc nerek (GRF < 20-30 ml/ minutę)
KM na skutek utraty wodorowęglanów z wydalinami (kwasice subtrakcyjne).
Biegunki, przetoki jelitowe, trzustkowe
Choroby nerek przebiegających z utratą HCO3-
KM na skutek przemieszczenia się jonów H+ z przestrzeni wewnątrzkomórkowej do pozakomórkowej (kwasice dystrybucyjne) np. w hiperkaliemi.
Diagnostyka laboratoryjna KM
Gazometria
pH
HCO3-
pCO2
Jonogram
K
Cl
Badania biochemiczne krwi
- Kratyniana, BUN
- glukoza, mleczny, ciała ketonowe
- LA, LO
Badania moczu
pH, TA, NH4+
Diagnostyka różnicowa kwasicy metabolicznej
Kwasica metaboliczna
↓ ↓
LA - prawidłowa LA - ↑
↓ ↓
- utrata HCO3- przez przewód pokarm - kwasica ketonowa
- kwasica kanalikowa proksymalna - kwasica mleczanowa
- kwasica kanalikowa dystalna - zatrucia
- wczesny okres niewydolności nerek - niewydolność nerek
Elektrolity
[Cl-] >[Na+] + [K+] → utrata HCO3- przez przewód pokarmowy
[Cl-] <[Na+] + [K+] → nerkowe pochodzenie kwasicy metabolicznej
Zasadowice metaboliczne
ZM na skutek:
Utraty jonów H+ (zasadowice subtrakcyjne)
wymioty
odsysanie treści żołądkowej
z moczem
Nadmiernej podaży zasad (zasadowice addycyjne)
NaHCO3, mlecznu sodowego, cytrynianu sodowego, węglanu wapnia.
Niedostatecznego poboru lub nadmiernej utraty potasu (zasadowice dystrybucyjne)
Niedostateczna podaż potasu w pokarmach.
Utrata z kałem (nadużywanie środków przeczyszczających).
Nadmierna produkcja mineralokrtykosteroidów (pierwotny hiperaldosteronizm).
Nadmiar kortyzolu i mineralokortykosteroidów (zespoł Cushinga, ekotopowa produkcja ACTH).
Diagnostyka laboratoryjna ZM
gazometria
pH ↑
HCO3- ↑
pCO2 N/↑
jonogram
K ↓
Cl ↓
Kwasice oddechowe
KO są następstwem hiperkanii wywołanej:
uszkodzeniem nerwowej regulacji oddechowej
uszkodzeniem lub porażeniem centralnego układu nerwowego
- barbiturany
- pochodne morfiny
- alkohol etylowy
- urazy
- udar mózgu
- infekcje
uszkodzeniem lub porażeniem nerwów motorycznych w rdzeniu kręgowym lub nerwów obwodowych mięśni oddechowych (maystenia gratis, poliomyelitis )
ograniczeniem ruchomości klatki piersiowej
zmiany w układzie kostnym lub mięśniowym (sklerodermia, skolioza, nadmierna otyłość)
chorobami płuc
choroby restrykcyje miąższu płuc (ciężkie zapalenie, rozedma, obrzęk)
choroby obturacyjne oskrzeli (astma, zapalenie oskrzeli)
obecność płynu, krwi lub powietrza w jamie opłucnej
Diagnostyka laboratoryjna KO
gazometria
pH ↓
HCO3- ↑
pCO2 N/↑
jonogram
K ↑
Cl ↓ (kompensacja)
Zasadowice oddechowe
ZO są następstwem hiperwentylacji wywołanej stymulacja ośrodka oddechowego, której przyczyną mogą być:
silne bodźce nerwowe o podłożu psychogennym, jak histeria, nerwica, niepokój, strach
uszkodzenie lub drażnienie centralnego układu nerwowego
gorączka
toksyny egzogenne (bakteryjne) lub endogenne (amoniak)
przedawkowanie leków (teofilina, salicylany)
hipoksja
przewlekłe choroby płuc, obrzęk płuc
mechaniczna hiperwentylcja
Diagnostyka laboratoryjna ZO
gazometria
pH ↑
HCO3- ↓
pCO2 N/↓
jonogram
K ↓
Cl ↑ (kompensacja)
Mechanizmy obronne po wystąpieniu zaburzeń RK-Z
Buforowanie
- bufory tkankowe i buforowanie narządowe
Kompensacja
- reakcja ze strony zmiennej zależnej czyli wtórnej, której zmiana zachodząca w tym samym kierunku co zmiana zmiennej niezależnej (pierwotnej) będzie ograniczać zmianę wartości pH
Korekcja
- reakcja organizmu mająca na celu usunięcie nadmiaru nagromadzonych kwasów lub zasad lub uzupełnienia ich niedoborów (często skuteczna korekcja wymaga interwencji lekarza)
Mechanizmy obronne organizmu
buforowanie pozakomórkowe
bufory płynu pozakomórkowego: minuty
buforowanie komórkowe
wymiana jony K+/ Na+ na jon H+ pomiędzy płynem pozakomórkowym i wewnątrzkomórkowym, minuty-godziny
kompensacja narządowa - wtórny mechanizm wyrównawczy
kompensacja oddechowa
- w pierwotnym zaburzeniu metabolicznym
- regulacja wydalania CO2 przez płuca
kompensacja metaboliczna
- w pierwotnym zaburzeniu oddechowym
- regulacja wydalania H+ przez nerki: godziny-dni
Fazy cyklu badania laboratoryjnego
Na cykl każdego badania laboratoryjnego składają się trzy fazy:
- przedlaboratoryjna
- laboratoryjna (analityczna)
- polaboratoryjna
Nadzór laboratorium powinien obejmować cały obszar działań determinujących jakość wyniku RK-Z
System zapewnienia jakości wyników badań obejmuje proces:
- pobierania i dostarczania materiału do laboratorium oraz
- analizy, transmisji wyniku do lekarza i interpretacji
Faza przedlaboratoryjna
W badaniach RK-Z błędy występujące w fazie przedlaboratoryjnej sA spowodowane:
- niewłaściwym przygotowaniem pacjenta do badania RK-Z
- niewłaściwym pobraniem i przechowywaniem próbek krwi
Faza laboratoryjna
W fazie laboratoryjnej błędy mogą być spowodowane:
- aparaturą i sposobem jej kalibracji (czułość elektrod pH, pCO2, pO2)
- sposobem wykonywania oznaczeń (właściwe wymieszanie próbek, wprowadzenie danych: ciepłota ciała, stężenie HGB)
- brakiem właściwej kontroli wiarygodności wyników (wymagana precyzja i dokładność pomiarów)
Faza polaboratoryjna
W fazie polaboratoryjnej błędy mogą być spowodowane:
- niewłaściwą interpretacja wyników (zaburzenia miaeszane)
- wpływem leków na RK-Z organizmu
Materiał do badań
Formalnie właściwym materiałem do badań RK-Z jest próbka krwi tętniczej pobierana w warunkach anaerobowych od pacjenta znajdującego się w stanie spoczynku fizycznego i psychicznego.
Wartości parametrów RK-Z są identyczne we wszystkich tętnicach, zwykle krew jest pobierana z tętnicy promieniowej lub udowej.
Zawsze istniejące przy nakłuciu tętnicy niebezpieczeństwo powoduje, że zabieg ten może wykonywać wyłącznie lekarz (wymóg prawny).
Stwarza to określone problemy, nie mniej w każdym przypadku pacjenta z zaawansowanymi obwodowymi zaburzeniami krążenia stan RK-Z należy badać w krwi tętniczej
Najczęściej pobieranym materiałem do badań RK-Z jest tzw. „arterializowana krew włośniczkowa”
Pojęcie arterializowana jest nie ścisłe, należy przez nie rozumieć przekrwienie czynne wywołane ogrzaniem opuszki palca, które spowoduje około 25 krotny wzrost przepływu włośniczkowego w tkance.
Nakłucie opuszki palca przy pobieraniu krwi do kapilar Astrupa powinno być głębokie i w miarę bezbolesne.
Ból może wpływać na wentylacje oddechową będąc przyczyna zarówno hiperwentylacji jaki i poprzez odruchowe wstrzymanie oddechu - hipowentylacji.
Dla eliminacji wpływu powietrza atmosferycznego próbkę należy pobierać ze środka kropli krwi, przy czym pierwszą kroplę po nakłuciu palca należy wytrzeć.
Innym miejsce pobrania krwi u dorosłych może być płatek ucha, u noworodków pięta, w części przyśrodkowo-bocznej stopy.
Antykoagulant
Zalecanym czynnikiem zapobiegającym krzepnięciu krwi jest sól sodowa heparyny.
Obecnie coraz częściej zastępowana solą litową, która umożliwia jednoczesne oznaczenie aktywności jonów sodowych w próbce.
Jeżeli pomiar RK-Z jest związany z pomiarem aktywności jonów wapniowych, wtedy jako antykoagulantu należy używać heparyny zbuforowanej solami wapnia.
Strzykawki, kapilary
Próbkę krwi tętniczej można pobierać do strzykawek lub kapilar.
Zalecane jest używanie strzykawek szklanych powleczonych wewnątrz liofilizowaną lub odparowaną heparyną, przy czym końcowe stężenie hepatyny powinno wynosić około 50 IU w 1 ml krwi.
Stosownie strzykawek plastikowych przemytych roztworem heparyny może być przyczyną błędów wynikających z:
- efektu rozcieńczania
- jak i zachodzącej dyfuzji gazów przez ściankę strzykawki
- roztwór heparyny (pH=7,00; pCO2=0; Po2=65-265 mmHg) jest czynnikiem zakwaszającym próbkę, obniżającym pCO2 i zawyżającym pO2
Dlatego też płynna heparyna w strzykawce, aczkolwiek bardzo wygodna (szybko miesza się z krwią) nie powinna być stosowana.
Próbkę krwi włośniczkowej pobiera się do heparynizowanych kapilar.
W próbkach krwi pobranych zarówno do kapilar, jak i strzykawek nie mogą znajdować się pęcherzyki powietrza.
Kapilary muszą być napełnione tak, aby po włożenieu do nich metalowego sztyftu były całkowicie wypełnione.
Bezpośrednio po pobraniu próbkę krwi należy wymieszać w kapilarach przy pomocy metalowego sztyftu i magnezu, w strzykawce poprzez obrotowe mieszanie w dłoniach. Mieszanie jest koniecznym warunkiem rozpuszczenia heparyny w próbce krwi, a niespełnienie tego wymogu często jest przyczyną powstawanie skrzepów zatykających komorę pomiarową w analizatorach RK-Z.
Do badań RK-Z nie można pobierać krwi do probówek próżniowych (np. system Vacutainer). Zarówno obecność resztkowego gazu, jak i obniżone ciśnienie w probówce wpływają na równowagę gazową.
Przechowywanie próbek
Istotne znaczenie dla zapewnienie jakości oznaczeń ma czas upływający od momentu pobrania próbki krwi do chwili dokonania pomiaru.
Jeżeli analiza nie może być wykonana w ciągu 20 minut od pobrania próbkę należy przechowywać w lodówce (0-4oC) lub ewentualnie w mieszaninie wody z lodem.
Przechowywanie próbek krwi w lodówce lub w wodzie z lodem powoduje spowolnienie metabolizmu komórkowego. Jest to szczególnie istotne w przypadku pacjentów z wysoką leukocytozą i/lub retikulocytozą.
Niższa temp. przechowywania próbek niż 0 st. C może uszkodzić krwinki. Maksymalny czas przechowywania próbek 0-4oC nie powinien przekraczać 2h.
Wpływ leków na wyniki RK-Z
⇑ pH |
⇓ pH |
|
|
⇑pCO2 |
⇓pCO2 |
|
|
⇑pO2 |
⇓pO2 |
|
|
1
MADE BY SŁOMEK
Wyszukiwarka
Podobne podstrony:
wykład 4 NERKA, chemia kliniczna
wykład 5 Barwniki żółciowe Porfirie, chemia kliniczna
Wykład 22, BIO, Diagnostyka Laboratoryjna, chemia kliniczna
Wykład z chemii klinicznej markery zawału serca, chemia kliniczna
Wyklad12 konspekt, BIO, Diagnostyka Laboratoryjna, chemia kliniczna
wyklad z czwartku chemia fizycz dnia19 marca
Chemia kliniczna kontrola id 11 Nieznany
chemia kliniczna cw 1 2011 id Nieznany
chf wykład 6, Studia, Chemia, fizyczna, wykłady
chf wykład 3, Studia, Chemia, fizyczna, wykłady
Wyklad 3, PWr, chemia nieorganiczna ćwiczenia
Chemia kliniczna ćwiczenie II, semestr III
wykladChK-03, Chemia UŁ, teoretyczna wykład
wykladChK-10, Chemia UŁ, teoretyczna wykład
Chemia kliniczna wykad VIII) 11
WYKLAD13.DOC, Chemia i technologia nitrowych pochodnych chlorobenzenu. 2,4-chlorodinitrobenzen, trin
chemia kliniczna-wykad 2, BIO, Diagnostyka Laboratoryjna, chemia kliniczna, semestr V
lKoło, BIO, Diagnostyka Laboratoryjna, chemia kliniczna
wykladChK-11, Chemia UŁ, teoretyczna wykład
więcej podobnych podstron