WOJSKOWY INSTYTUT MEDYCZNY
Centralny Szpital Kliniczny MON
Zakład Radiologii Lekarskiej
Działalność medyczno-usługowa
Kierownik: |
płk dr hab. n. med. Paweł TWARKOWSKI |
|
tel. 681-62-58; 681-68-54; 810-08-84 |
Pracownia Radiologii Konwencjonalnej
Pracownia Radiologii Dziecięcej
Pracownia Tomografii Komputerowej Spiralnej
Pracownia Rezonansu Magnetycznego
Pracownia Badań Naczyniowych
Pracownia Radiologii Interwencyjnej
Pracownia Ultrasonografii
Działalność medyczno-usługowa:
rentgenodiagnostyka konwencjonalna - cyfrowa,
ultrasonografia,
tomografia komputerowa,
rezonans magnetyczny,
radiologia naczyniowa i interwencyjna ( zabiegi wewnątrznaczyniowe )
pełna diagnostyka w zakresie radiologii i medycyny obrazowej dla wszystkich zakładów i klinik CSK MON, Wojska Polskiego, chorych zgodnie z umowami oraz odpłatnie zgodnie z cennikiem w trybie ambulatoryjnym.
* * *
Pracownia 64-rzędowej tomografii komputerowej WIM
Kierownik - dr n. med. Magdalena Zagrodzka - adiunkt Zakładu Radiologii
Lek. Anna Ratyńska
Lek. Bernard Jaroń
Rejestracja tel.: (0 22) 6816269
Zapisy od poniedziałku do piątku w godz. 8.00 - 14.00
Diagnostyka serca w tomografii komputerowej
Badanie angiograficzne w tomografii komputerowej
Badanie jelita grubego w tomografii komputerowej (kolonoskopia TK)
15 czerwca 2005 roku w Wojskowym Instytucie Medycznym została otwarta - pierwsza w Polsce i Europie Wschodniej - pracownia tomografii komputerowej wyposażona w 64-detektorowy tomograf komputerowy (VCT 64 LightSpeed GE). Główne profile badań specjalistycznych wykonywanych przez nasz zespół to: diagnostyka naczyń wieńcowych, angiografia naczyń tętniczych i żylnych pozasercowych, kolonoskopia TK, nieinwazyjna diagnostyka dróg żółciowych oraz diagnostyka onkologiczna. Jesteśmy jednym z niewielu ośrodków europejskich zajmujących się diagnostyką układu sercowo - naczyniowego. Każdego dnia wykonujemy 50-70 badań, na które przyjeżdżają osoby z całej Polski.
Diagnostyka serca w tomografii komputerowej
Podstawowe wskazania do wykonania badania serca w tomografii komputerowej:
Diagnostyka naczyń wieńcowych:
choroba wieńcowa,
anomalie wrodzone,
kontrola naczyń wieńcowych - stan po wielokrotnych koronarografiach,
chorzy bezobjawowi z grup wysokiego ryzyka (cukrzyca, nadciśnienie...),
kontrola po korekcjach wad wrodzonych serca (tetralogia Fallota, przewód Bottala).
Kontrola pomostów wieńcowych (by-passów).
Ocena lewego przedsionka i żył płucnych u pacjentów z migotaniem przedsionków przed zabiegami RF ablacji.
Ocena funkcji lewej komory z uwzględnieniem parametrów hemodynamicznych serca.
Kontrola po zabiegach kardiochirurgicznych:
przeszczepy serca
protezy aorty wstępującej
rozwarstwienia aorty
kontrola po implantacji stent-graftów
Ocena wskaźnika uwapnienia blaszek miażdżycowych w tętnic wieńcowych (Calcium Score) - badanie bez podania środka kontrastowego!
Chorzy z przeciwwskazaniami do próby wysiłkowej z podejrzeniem choroby wieńcowej.
podstawą do wykonania badania jest skierowanie od lekarza (pierwszego kontaktu, internisty, kardiologa...) z opisem problemu klinicznego;
badanie jest nieinwazyjne ( wkłucie dożylne wenflonu w zgięcie łokciowe, podanie 100 ml środka kontrastowego podczas badania);
nie wymaga hospitalizacji i może być wykonane u każdego ambulatoryjnego pacjenta;
czas badania nie przekracza 10 minut i obejmuje przygotowanie chorego do badania (podłączenie monitora EKG i założenie wenflonu) oraz czas "skanowania" (samego badania) 5-10 sekund;
po wykonanym badaniu niezbędne jest opracowanie wyniku, które trwa 30-60 min, w związku z tym osoby z Warszawy i jej okolic odbierają wynik w ciągu 2 dni, pozostali -jeśli jest to możliwe - otrzymują wynik w ciągu kilku godzin;
możliwe jest wysłanie wyniku z całą dokumentacją zdjęciową pocztą kurierską na koszt odbiorcy;
przed badaniem serca zaleca się dostarczyć lekarzowi wykonującemu badanie dokumentację historii choroby (wypisy ze szpitala, wyniki badań)
Naczynia mózgowe:
anatomia i topografia tętnic mózgowych oraz zatok żylnych i żył mózgu,
diagnostyka malformacji naczyniowych,
diagnostyka tętniaków wewnątrzczaszkowych,
kontrola po zabiegach neurochirurgicznych i radiologii interwencyjnej (klipsowanie, embolizacje śródnczyniowe).
Tętnice szyjne i kręgowe:
anatomia i topografia naczyń,
ocena stopnia zwężenia przed zabiegami chirurgicznymi i śródnaczyniowymi,
kontrola po zabiegach (endarterektomia, stentowanie),
unaczynienie guzów szyi.
Aorta piersiowa i brzuszna:
planowanie do zabiegów kardiochirurgicznych i radiologii interwencyjnej,
diagnostyka tętniaków,
diagnostyka rozwarstwień,
diagnostyka zwężeń/niedrożności dużych naczyń odchodzących od łuku aorty (pnia ramienno-głowowego, tętnicy szyjnej wspólnej lewej i podobojczykowej lewej) ,
kontrola po zabiegach ( protezy naczyniowe, stent-grafty),
Naczynia trzewne
pień trzewny (zwężenie, zespół uciskowy),
tętnica krezkowa górna (zwężenie, zator),
tętnice nerkowe
anatomia (liczba tętnic),
zwężenia - diagnostyka nadciśnienia wtórnego - nerkopochodnego,
planowanie do zabiegów angioplastyki,
malformacji naczyniowe
ocena układu żyły wrotnej (splenoportografia),
kontrola po implantacji "koszyków" do żyły głównej dolnej.
Naczynia kończyn górnych
anatomia i topografia (zespoły uciskowe),
flebografia (badanie żył) z oceną spływu do żyły głównej górnej,
obrazowanie przetok tętniczo-żylnych do hemodializ.
Naczynia kończyn dolnych
anatomia i topografia (odmiany rozwojowe tętnic i żył),
ocena zwężeń/niedrożności tętnic (przed zabiegami angioplastyki, chirurgicznymi),
ocena malformacji naczyniowych,
flebografia (badanie żył) kończyn dolnych z oceną spływu do żyły głównej dolnej (np. zakrzepica ).
zarostowe zapalenie tętnic
uraz tętnic
cukrzycowe zmiany małych naczyń
zatory naczyniowe
inne choroby naczyń
Chromanie przestankowe
Rola tlenku azotu (NO)
Badania kliniczne L-argininy w chromaniu przestankowym
Wydłużeniem dystansu przejścia bez bólu,
Skróceniem czasu trwania bólu po przejściu maksymalnego odcinka drogi,
Poprawą kostkowo-ramiennego wskaźnika ciśnieniowego - (ABI). Badanie polegające na pomiarze ciśnienia skurczowego w tętnicach na poziomie kostek i ramieniu - w celu oceny stanu chorego z chromaniem przestankowym.
Poprawą ukrwienia kończyn dolnych.
Kilka słów o badaniu:
Rekonstrukcja MIP tętnic wieńcowych. (dr.M.Zagrodzka)
Rekonstrukcja MIP Inwers tętnic wieńcowych.(dr.M.Zagrodzka)
Rekonstrukcja Volume Rendering serca.(dr.M.Zagrodzka)
Badanie angiograficzne w tomografii komputerowej
Współczesna diagnostyka w wielorzędowej tomografii komputerowej stwarza coraz większe możliwości wizualizacji naczyń. Pozwala na zobrazowanie niemal wszystkich rejonów anatomicznych ciała człowieka. Angiografia TK lub w skrócie angio-TK to nowoczesne narzędzie diagnostyki naczyniowej XXI wieku. Dzięki swej nieinwazyjności (jedynie wkłucie dożylne) szybko i precyzyjnie pozwala określić rodzaj patologii i zaplanować sposób dalszego postępowania. Dotychczasowe metody inwazyjne, jak arteriografia diagnostyczna odchodzą w zapomnienie.
Wskazania do wykonania badania angiograficznego w TK:
|
|
Obraz tętnic brzusznych i kończyn dolnych -rekonstrukcja (dr.B.Jaroń)
Bardzo warzne !!!
Badania
Układ krążenia
Pletyzmografia
Podstawowe informacje
Ten test mierzy skurczowe (maksymalne ciśnienie podczas skurczu komór serca) ciśnienie krwi kończyny dolnej w porównaniu z kończyną górną. Test polega na porównaniu chorej kończyny z kończyna zdrową. Jego celem jest wykluczenie zatorów w kończynach (zwykle dolnych).
Opis badania
Badanie może być przeprowadzone w gabinecie lekarza lub w szpitalu. Do badania pacjent jest układany częściowo podpartej pozycji. Następnie są zakładane na kończyny 3 mankiety do mierzenia ciśnienia które są pompowane do 65 mm Hg (słupa rtęci). Potem mankiety są podłączane do pletyzmografu (urządzenia rejestrującego falę tętna) który wyświetla każdą falę tętna. Zapis jest również rejestrowany na papierze. Zapisywane są wszelkie różnice na 3 mankietach. Jeżeli jest zmniejszenie fali tętna na którymś z mankietów może to wskazywać na obecność zwężenia w tętnicy. Po zakończeniu testu mankiety są zdejmowane.
Przygotowanie do badania
Na co najmniej 30 minut przed badaniem nie należy palić papierosów. Do badania pacjent musi zdjąć ubranie z kończyn. W trakcie badania nie odczuwa się żadnego dyskomfortu, jedynie łagodny ucisk spowodowany przez mankiety. Badanie nie niesie ze sobą ryzyka.
Wyniki
Test jest wykonywany aby wykluczyć schorzenie polegające na utrudnieniu przepływu krwi w tętnicach kończyn. Za wyniki prawidłowe uznaje się różnicę mniejszą niż 20 mm Hg pomiędzy kończynami górnymi i dolnymi. Wyniki nieprawidłowe mogą wskazywać na:
Miażdżyca tętnic obwodowych - co to jest i jak ją mozna leczyć
Słowa kluczowe: kardiologia zdrowe serce jak zachować zdrowie
Dziedzina: kardiologia kardiologia interwencyjna
Artykuł dla : Pacjentów
Więcej na ten temat:
Wiedza | kardiologia Dyskusja
Usługi interaktywne Początek formularza
Dół formularza
Katalog lekarzy
Początek formularza
Dół formularza |
Co to jest miażdżyca tętnic obwodowych?
Miażdżyca tętnic jest chorobą ogólnoustrojową, która polega na odkładaniu się w ścianach tętnic złogów cholesterolu, co powoduje usztywnienie ścian, zwężenie światła a następnie zamknięcie tętnicy. Choroba prowadzi do zmniejszenia przepływu krwi w tętnicy i do niedokrwienia zaopatrywanego obszaru.
Miażdżyca to choroba uogólniona wszystkich tętnic,
jednaknajczęściej zajmuje:
- tętnice wieńcowe prowadząc do choroby wieńcowej i zawału serca
tętnice kończyn dolnych powodując trudności w chodzeniu
- tętnice szyjne (domózgowe) co jestprzyczyną udaru mózgu
- tętnice nerkowe co powoduje nadciśnienie tętnicze i niewydolność nerek
- tętnice podobojczykowe co powoduje bóle i „mdlenie" rąk
- tętnice trzewne powodując bóle brzucha po posiłku czyli tzw.anginębrzuszną
Co sprzyja rozwojowi miażdżycy?
- Przyczyny miażdżycy tętnic nie są do końca wyjaśnione. Najczęściej chorują mężczyźni po 60¬tym roku życia, lecz choroba nie omija kobiet i osób przed 60-tką.
- U większości chorych obserwuje się rodzinne występowanie choroby, co wskazuje na jej pochodzenie genetyczne.
- Pośród innych przyczyn mówi się przede wszystkim o czynnikach zwiększonego ryzyka rozwoju miażdżycy jakimi są:
palenie tytoniu . cukrzyca, nie leczone nadciśnienie tętnicze, zwiększony poziom cholesterolu we krwi, otyłość (niewłaściwa dieta i siedzący tryb życia)
Należy pamiętać, że występowanie miażdżycy wśród bliskiej rodziny wraz z narażeniem na kilka z wyszczególnionych powyżej czynników ryzyka zwłaszcza u chorych powyżej 60-go roku życia stanowi poważne zagrożenie miażdżycą tętnic obwodowych.
Jakie są objawy miażdżycy tętnic obwodowych?
Powszechnie znane są objawy miażdżycy tętnic wieńcowych czyli choroby wieńcowej - gdy pojawiają się bóle za mostkiem często związane z zasłabnięciem, świadomi zagrożenia życia natychmiast zgłaszamy się do kardiologa.
Inaczej rzecz wygląda z miażdżycą tętnic kończyn dolnych - pierwsze objawy są często lekceważone, a choroba rozwija się dalej. Typowym objawem są bóle nóg występujące przy chodzeniu, które mijają po odpoczynku czyli tak zwane chromanie przestankowe. Dochodzi do tego, że po przejściu kilkuset lub kilkudziesięciu metrów chory musi zatrzymać się, aby dać odpocząć nogom - potocznie nazywa się to chorobą oglądaczy wystaw. Bóle i bolesne kurcze dotyczą najczęściej łydek, a wraz z rozwojem choroby również ud i pośladków. Wielu chorych uskarża się na chłodne stopy, które od pewnego czasu marzną szybciej w chłodne dni niż zazwyczaj. Wielu mężczyzn zgłasza również pojawienie się problemów z potencją.
Zwężenia miażdżycowe tętnic szyjnych (domózgowych) powodują najczęściej chwilowe utraty przytomności, przemijające zaburzenia widzenia i mowy lub nawet krótkotrwały niedowład połowy ciała. Czasami objawy nie są tak charakterystyczne i chory odczuwa tylko okresowe bóle i zawroty głowy.
Zmiany miażdżycowe tętnic nerkowych, podoboj¬czykowych i trzewnych występują rzadziej - a nadciśnienie, „mdlenie" rąk czy też bóle brzucha po posiłku mogą mieć różne inne przyczyny.
Gdzie należy się zgłosić po wystąpieniu typowych objawów?
Gdy zauważysz opisane wyżej objawy, a szczególnie gdy zaobserwujesz ich nasilanie się w czasie zgłoś się do Lekarza Rodzinnego, który oceni zgłaszane dolegliwości i gdy potwierdzi możliwość wystąpienia miażdżycy tętnic wystawi skierowanie do najbliższej Poradni Chorób Naczyń, gdzie Lekarz Specjalista (chirurg naczyniowy, angiolog) po badaniu specjalistycznym zaproponuje wykonanie konkretnych badań dodatkowych i po¬informuje o ewentualnym leczeniu.
Jakie badania dodatkowe należy wykonać?
Podstawowe badania laboratoryjne krwi i moczu będą odzwierciedleniem stanu ogólnego organizmu. Na ich podstawie można ocenić np. obecność stanu zapalnego oraz wydolność nerek. Bardziej szczegółowe badania pozwolą oznaczyć poziom cholesterolu i ocenić krzepliwość krwi. U każdego chorego należy zmierzyć ciśnienie tętniczekrwi. Kolejnym etapem są badania obrazowe, których rolą jest ustalenie które tętnice są zmienione miażdżycowo i w jakim stopniu. USG metodą Dopplera jest podstawowym badaniem w ocenie tętnic szyjnych, nerkowych, podobojczykowych i trzewnych pozwala również wstępnie ocenić stan tętnic kończyn dolnych. Jest to badanie nieinwazyjne, szeroko dostępne i tanie. W niektórych przypadkach pozwala na ustalenie właściwego rozpoznania i wdrożenie leczenia. U wielu chorych trzeba jednak wykonać angiografię kontrastowct, która w sposób ostateczny uwidoczni zwężone odcinki tętnic, zakres niedrożności i krążenie oboczne. Angiografia wymaga pobytu w szpitalu, gdyż jej wykonanie polega na nakłuciu i wprowadzeniu cewnika do tętnicy, aby podać środek kontrastowy. I choć jest badaniem inwazyjnym to uzyskane rzeczywiste obrazy są bezcenne przy wyborze właściwej metody skutecznego leczenia. W niektórych sytuacjach można zaproponować wykonanie angiografii Rezonansu Magnetycznego lub angiografii Tomografii Komputerowej, lecz badania te nie są tak dostępne i na razie mniej dokładne niż angiografia kontrastowa.
Jakie są metody leczenia miażdżycy?
• Leczenie farmakologiczne polega na podawaniu tabletek lub zastrzyków rozszerzających naczynia i wspomagających napływ krwi. Może to jednak przynieść ulgę tylko we wczesnym okresie choroby, gdy tętnice nie są bardzo zmienione.
• Gdy zmiany miażdżycowe są bardziej nasilone i dochodzi do pojedynczych zwężeń lub krót¬koodcinkowych niedrożności to zmienione odcinki tętnic można jeszcze leczyć bez operacji przy pomocy angioplastyki balonowej i metalowych stentów. Zabieg angioplastyki wykonuje się w znieczuleniu miejscowym z nakłucia tętnicy przez skórę w pachwinie lub pod pachą wprowadzając cewnik z balonem do mechanicznego poszerzenia zwężonego odcinka tętnicy. Zabiegi te są skuteczne u większości chorych, lecz gdy ich wynik nie jest satysfakcjonujący i zwężenie nawraca można wprowadzić do środka tętnicy stent czyli metalową siateczkę, która pozwoli utrzymać poszerzenie zwężonej tętnicy. Angioplastyka balonowa i stentowanie jest aktualnie metodą z wyboru w leczeniu zwężeń tętnic podnbojczykowych i nerkowych. Dobre wyniki osiągane są również w udrażnianiu pojedynczych zwężeń tętnic biodrowych, udowych i szyjnych. Szczególnym wskazaniem jest leczenie chorych obciążonych licznymi schorzeniami, co stwarza dodatkowe ryzyko przy operacj i chirurgicznej i znieczuleniu ogólnym. Zaletą metody jest niewielki uraz i to, że chory z reguły na drugi dzień może opuścić szpital.
Operacja chirurgiczna jest konieczna, gdy miażdżyca jest zaawansowana i rozsiana, a zwężenia i niedrożności dotyczą całych segmentów tętniczych na wielu poziomach. Endarterietomia to operacja nacięcia tętnicy i jej mechanicznego oczyszczenia z blaszek miażdżycowych - stosowana przede wszystkim w udrażnianiu tętnic szyjnych i krótkich odcinków tętnic biodrowych i udowych. Jeśli tętnice są niedrożne na długich odcinkach operacja polega na wszyciu pomostu omijającego którym krew popłynie bezpośrednio do dalszego odcinka tętnicy i gałęzi bocznych. Jest to tzw. by-pass - stosowany najczęściej w leczeniu niedrożności tętnic kończyn dolnych. Gdy jednak tętnice sązamlrnięte aż do stóp i nie można już zapewnić dostatecznego ukrwienia nogi to jedynym, ostatecznym sposobem zapobiegania martwicy tkanek jest amputacja części lub całej kończyny.
Metody leczenia miażdżycy tętnic przedstawiono w pewien uproszczony, schematyczny sposób. Chodziło o zaakcentowanie stopniowego rozwoju choroby i podkreślenie, że wczesne zgłoszenie się do lekarza zwiększa szansę wyboru skutecznej metody leczenia.
Jak zapobiegać rozwojowi choroby?
Miażdżyca tętnic jest jednym z głównych problemów zdrowotnych naszego społeczeństwa. Zawał serca, udar mózgu, nadciśnienie i niedokrwienie kończyn dolnych to główne przyczyny inwalidztwa ludzi w wieku pełnej aktywności zawodowej. I choć ostatnie lata to gwałtowny rozwój metod wykrywania i leczenia miażdżycy tętnic, to w dalszym ciągu miliony ludzi w Polsce są wyłączone z
normalnego życia z powodu miażdżycy. Pomimo znaczącego postępu medycyny, chorzy z zaawansowaną miażdżycą tętnic muszą być leczeni praktycznie do końca życia. Proces leczniczy jest skomplikowany i kosztowny - wiąże się zazwyczaj z wielokrotnym pobytem w szpitalu i z powtarzanymi zabiegami angioplastyki balonowej i operacjami chirurgicznymi wspomaganymi specjalistycznym leczeniem farmakologicznym. Dlatego też, na pierwszy plan wysuwa się konieczność zapobiegania występowaniu i kontrolowania rozwoju choroby, aby nie dopuścić do jej zaawansowania zagrażającego życiu i zdrowiu.
O ile skłonność rodzinna pozostaje na razie poza możliwościąingerencji medycznej, to właściwy sposób życia czyli unikanie czynników ryzyka miażdżycy zależy w głównej mierze od samych chorych:
- Rzucenie palenia i unikanie stresów
- Aktywny tryb życia i dieta niskotłuszczowa -walka z nadwagą
- Stałe kontrolowanie i właściwe leczenie cukrzycy i nadciśnienia tętniczego
- Okresowe badania poziomu cholesterolu i jego frakcji we krwi
- Okresowe badania kontrolujące rozwój choroby (Poradnia Chorób Naczyń, USG metodą Dopplera)
Powyższe opracowanie nie wyczerpuje z pewnością wszystkich zagadnień związanych z miażdżycą tętnic. Jego zadaniem jest przybliżenie problemu miażdżycy i poinformowanie chorych o zagrożeniach, możliwościach wczesnego rozpoznania, leczenia i zapobiegania chorobie.
Opracowanie sponsorowane przez firmę:
Cordis Johnson & Johnson Poland Sp. z o.o. ul. Szyszkowa 20, 02-285 Warszawa www.jnjgateway.com
Medargin w miażdżycowym niedokrwieniu kończyn dolnych |
"Choroba wystaw sklepowych” to dolegliwość wbrew pozorom nie mająca nic wspólnego z uzależnieniem od zakupów… Medyczna nazwa tego schorzenia, (objawiającego się kłopotami z chodzeniem, czyli chromaniem przestankowym), to miażdżycowe niedokrwienie kończyn dolnych. Na chromanie przestankowe cierpi w Polsce ponad 600 tysięcy osób. W walce z chorobą prym wiedzie L-arginina - aminokwas niezbędny organizmowi człowieka do samodzielnej syntezy tlenku azotu.
Dolegliwość ta nazywana jest żartobliwie „chorobą wystaw sklepowych” nie, dlatego, że powoduje zwiększone zainteresowanie ofertą handlową, lecz, dlatego, że osoby cierpiące na chromanie ból nóg często zatrzymuje w pół drogi na ulicy. Chorzy przystają wówczas pod pozorem oglądania wystaw, a w rzeczywistości po to, by dać odpocząć swoim nogom.
Odkrycie wszechstronnej roli tlenku azotu w organizmie stwarza szansę na proste i skuteczne leczenie miażdżycy, a także innych chorób układu krążenia. Tomasz Maliński, profesor medycyny mononuklearnej z Uniwersytetu w Ohio, właśnie odkrył na nowo tlenek azotu. Jego badania nad rolą NO wyjaśniają podstawowe przyczyny miażdżycy naczyń krwionośnych i innych chorób związanych z funkcjonowaniem układu krążenia. Z badań tych wynika, że tlenek azotu jest tzw. cząsteczką pierwotną, która była na Ziemi już, gdy powstawało życie, i dlatego odgrywa w organizmie człowieka szereg ról obronnych. Cząsteczka tlenku azotu działa rozkurczająco na naczynia krwionośne, obniża stężenie „złego” cholesterolu LDL, hamuje krzepnięcie krwi i zlepianie się jej płytek. NO dzięki swym właściwościom zmniejsza także ryzyko miażdżycowych zmian martwiczych spowodowanych zatkaniem tętnic doprowadzających krew np. do kończyn dolnych. U chorych z miażdżycą zawartość tlenku azotu we krwi jest zaniżona, gdyż dochodzi do zahamowania przepływu do komórek L-argininy, aminokwasu, z którego NO wytwarzany jest samodzielnie przez organizm człowieka. Badania Kliniki Chirurgii Ogólnej i Naczyń prowadzone przy współpracy z Zakładem Farmakologii Klinicznej i Katedry Fizjologii Akademii Medycznej im. Karola Marcnikowskiego w Poznaniu wykazały, że doustne podawanie L-argininy pacjentom cierpiącym na miażdżycę zarostową tętnic kończyn dolnych wpływa na poprawę ich stanu zdrowia, objawiającą się:
Żadnych działań niepożądanych stosowania L-argininy nie odnotowano. |
Choroby tętnic
Najczęściej spotykane jednostki chorobowe
Miażdżyca uogólniona. Choroba ta atakuje w przeważającej części mężczyzn. Nasilają ją takie czynniki jak cukrzyca, palenie tytoniu, dieta bogata w cholesterol, nadciśnienie tętnicze. Miażdżyca wywołuje zmiany w naczyniach doprowadzając do ich zwężenia, a następnie do ich zamknięcia. Najczęstszą chorobą, z którą zgłaszają się chorzy, jest przewlekłe niedokrwienie kończyn dolnych.
JAKIE OBJAWY WYSTĘPUJĄ NAJCZĘŚCIEJ?
Zamknięcie naczynia wywołuje charakterystyczne objawy:
łatwe męczenie się podczas chodzenia
ból podudzi w trakcie chodzenia, prowadząc do skrócenia dystansu chodzenia
tzw. chromanie przystankowe
zaniki mięśni
zblednięcie kończyn dolnych
niewyczuwalne tętno na tętnicach udowych
najczęściej przewlekły przebieg choroby
JAKIE STOSUJE SIĘ LECZENIE?
Leczenie chorych z objawowym zwężeniem lub zamknięciem tętnic dzieli się na:
1. Leczenie zachowawcze - farmakologiczne - stosowanie leków działających rozszerzająco na tętnice, poprawiające odkształcanie się krwinki, zmniejszające krzepliwość
2. Leczenie chorób współistniejących - np. niewydolność serca i płuc
3. Leczenie operacyjne:
a). udrożnienie tętnicy
b). wykonanie pomostu omijającego odcinek zamknięty
c). wycięcie fragmentu nerwu pnia współczulnego
CZY SĄ INNE ALTERNATYWNE SPOSOBY LECZENIA?
Postęp medycyny jaki nastąpił ostatnimi czasy spowodował wprowadzenie nowych metod leczenia polegających na przezskórnym udrażnianiu i rozszerzaniu naczyń. Należą do nich:
tromboliza celowana (rozpuszczenie zakrzepu)
przezskórna plastyka balonowa
protezowanie wewnątrznaczyniowe
Choroby układu krążenia
|
Jedną z najczęstszych chorób układu krążenia jest nadciśnienie tętnicze; szacuje się, że w Polsce dotyczy ono ponad 50% osób powyżej 65. r.ż.
Drugą w kolejności jest choroba wieńcowa, czyli choroba niedokrwienna mięśnia sercowego - jedna z najczęstszych przyczyn zgonu w naszym kraju.
Na trzecim miejscu należałoby postawić niewydolność krążenia (w tym niewydolność serca). Inne choroby to wady zastawek; następnie zapalenia mięśnia sercowego, osierdzia i wsierdzia; wreszcie kardiomiopatie - niezapalne schorzenia o niewyjaśnionej najczęściej przyczynie oraz zaburzenia rytmu pracy serca i przewodzenia bodźców.
Z chorób naczyń najczęściej występują: miażdżyca naczyń obwodowych (tzw. miażdżyca zarostowa kończyn) oraz żylaki i zapalenia żył (powierzchownych i głębokich).
Jeśli chcesz wiedzieć więcej, przeczytaj artykuł zamieszczony poniżej.
Choroby układu krążenia i ich leczenie
artykuł lek. med. Marcina Pustkowskiego, lekarza rodzinnego napisany w marcu 2000 dla serwisu RES MEDICA
Choroby układu krążenia
Jedną z najważniejszych chorób układu krążenia i jedną z najczęstszych chorób przewlekłych jest nadciśnienie tętnicze. Po 65. roku życia występuje u około 50% osób w polskiej populacji. Jest więc chorobą społeczną. Ostatnio zmieniły się kryteria rozpoznawania tego stanu - obecnie taką diagnozę można już postawić przy wartościach 140/90 mm Hg (słupa rtęci w ciśnieniomierzu) lub wyższych.
Nadciśnienie jest bardzo podstępną chorobą. Właściwie nie daje żadnych dolegliwości (rzadko bóle czy zawroty głowy, wyjątkowo zaburzenia widzenia). Niestety nie ma się z czego cieszyć - powikłania nadciśnienia pod postacią choroby wieńcowej (łącznie z zawałem mięśnia sercowego), udaru mózgu czy niewydolności serca są bardzo poważne i nierzadko kończą się zgonem.
Inną z bardzo rozpowszechnionych chorób jest choroba wieńcowa. Jedną z jej postaci (najbardziej zaawansowaną) jest zawał mięśnia sercowego. Przyczyną choroby wieńcowej, zwanej również chorobą niedokrwienną serca, jest zatykanie tętnic wieńcowych przez blaszki miażdżycowe. Do serca dochodzi wtedy mniej krwi (i tlenu), pojawiają się dolegliwości (ból i duszność), komórki zaczynają gorzej pracować. Przy całkowitym odcięciu krwi (zawał) pojawia się martwica.
Ból wieńcowy ma swoje charakterystyczne cechy: pojawia się za mostkiem; pacjent ma uczucie gniecenia i duszności, czasem palenia; ból promieniuje do szczęki, żuchwy, do ramion (najczęściej lewego); pojawia się po wysiłku czy stresie, a ustępuje w spoczynku i (co ważne) po zażyciu nitrogliceryny. Jeśli spotęgujemy te wszystkie cechy i dodamy lęk, poty i nieustępowanie bólu mimo podawania nitrogliceryny, to otrzymamy obraz bólu w zawale.
Zawał serca i choroba wieńcowa są najczęstszą przyczyną zgonów w Polsce. Co roku zapada na niego około 100 tys. osób (głównie mężczyzn); 40% spośród tych osób umiera w ciągu roku.
Kolejną grupą chorób są wady serca. Najczęściej dotyczą one zastawek. Zastawki są niezbędne do prawidłowego ukierunkowania przepływu krwi w sercu. Przy ich nieprawidłowościach pojawiają się problemy: niektóre jamy serca są bardziej obciążane niż zazwyczaj i przerastają albo rozszerzają się.
Wyróżniamy wady serca wrodzone i nabyte. Te ostatnie są częstsze i dotyczą przede wszystkim zastawki dwudzielnej (mitralnej), oddzielającej lewy przedsionek od lewej komory. Najczęściej powstają w wyniku nierozpoznanej lub niedostatecznie leczonej choroby reumatycznej, która "liże stawy, a kąsa serce".
Wady serca możemy również podzielić na przebiegające z sinicą (sinicze) - przede wszystkim niektóre wady wrodzone - oraz niesinicze.
Wymieniona przed chwilą choroba reumatyczna jest jednym z przykładów chorób zapalnych serca. Inne zapalenia wywołane są wirusami, bakteriami czy chorobami autoimmunologicznymi. Dotyczą mięśnia serca, wsierdzia lub osierdzia. Mogą być też zajęte wszystkie trzy warstwy.
Wśród chorób serca wymieńmy również kardiomiopatie, czyli niezapalne choroby mięśnia sercowego nie będące skutkiem zmian w mięśniu sercowym powstałych w następstwie wad serca, nadciśnienia i zwężenia tętnic wieńcowych, a także zaburzenia rytmu jego pracy i przewodzenia bodźców.
Te różne choroby mogą zakończyć się bardzo podobnie - w ich przebiegu może rozwinąć się niewydolność mięśnia serca. Pojawia się wtedy duszność, początkowo przy wysiłku, a później nawet w spoczynku. Jeśli zajęte jest też prawe serce, to pojawiają się obrzęki kończyn dolnych i częste oddawanie moczu w nocy.
Niewydolność świadczy o poważnym uszkodzeniu mięśnia serca. Należy wtedy leczyć przede wszystkim to, co do niej doprowadziło (np. chorobę wieńcową). Podaje się również leki zwalczające jej objawy (np. obrzęki).
Miażdżyca naczyń obwodowych (tzw. miażdżyca zarostowa) jest wyrazem tego samego procesu, który doprowadza do rozwoju choroby wieńcowej. Złogi lipidowe i rozrost komórek zwężają światło naczyń. Do tego dochodzą jeszcze zakrzepy tworzące się na uszkodzonej wyściółce tętnic (czyli śródbłonku), które jeszcze bardziej zmniejszają drożność chorego naczynia. W rezultacie część organizmu, która korzysta z danej "drogi transportowej" jest niedostatecznie zaopatrywana w tlen i substancje odżywcze.
W skrajnych przypadkach tworzy się martwica.
W przypadku kończyn dolnych (tam najczęściej ze wszystkich tętnic obwodowych, czyli znajdujących się dalej od serca, rozwija się miażdżyca) ból pojawia się przy chodzeniu. Z racji tego, że pacjent musi zatrzymać się co pewien czas (po przebyciu pewnej odległości), taki objaw nazywamy chromaniem przestankowym. W bardziej zaawansowanej fazie odcinki pokonywane bez bólu stają się coraz krótsze, a w końcu objaw ten pojawia się w spoczynku. Podobnie jak w przypadku serca kończyna może być na tyle niedokrwiona, że jej część ulega martwicy, która jest widoczna w postaci niegojących się owrzodzeń. Dodajmy do tego, że kończyna jest często chłodna i blada a lekarz nie może wyczuć tętna.
Inną częstą chorobą dotyczącą głównie kobiet są żylaki kończyn dolnych. Są to nierównomierne rozszerzenia żył, często widoczne na skórze. Mogą - ale nie muszą - być przyczyną nieprzyjemnego uczucia ciężkości nóg, a czasem również bolesności łydek. Leczenie (chirurgiczne, farmakologiczne) uzależnione jest od powikłań (zapaleń, zatorów) i od względów kosmetycznych.
W zapaleniu żył na jakimś odcinku ściany żyły rozwija się (zgodnie z nazwą) stan zapalny wraz z wytworzeniem się zakrzepu. Powstaniu takiego stanu sprzyjają między innymi: długotrwałe unieruchomienie, zabiegi operacyjne, poród, urazy oraz wspomniane żylaki. Rodzaj objawów zależy do tego, czy proces zapalny dotyczy żył powierzchownych czy głębokich.
W przypadku tych pierwszych spotykamy się z określeniem "bolesnego powrózka". Żyła jest wtedy wrażliwa na ucisk i twarda jak postronek; skóra nad nią jest zaczerwieniona i cieplejsza niż inne okolice, często dołącza się obrzęk okolicznych tkanek.
Zapalenie żył głębokich jest trudniejsze do wykrycia. Objawy są często słabiej wyrażone. Pojawia się uczucie ciężkości łydek i ich kurcze. Ból występuje samoistnie lub przy ucisku. Chora kończyna jest obrzęknięta i cieplejsza niż po przeciwnej stronie.
W zapaleniu żył boimy się przede wszystkim zatorów, czyli zatkania przez część zakrzepu światła jakiegoś dużego bądź małego naczynia. Zatory wraz z prądem krwi wędrują do serca i dalej do płuc.
Leczenie jest najczęściej farmakologiczne i polega na podaniu leków przeciwzapalnych oraz przeciwzakrzepowych lub trombolitycznych (rozpuszczających zakrzep).
Przykrym następstwem zapalenia żył głębokich jest tzw. zespół pozakrzepowy, w którym uszkodzeniu ulegają zastawki - w warunkach prawidłowych nie pozwalające na cofanie się krwi żylnej na obwód. Oprócz obrzęku, bólu oraz stwardnienia skóry i tkanki podskórnej pojawia się również duże, trudno gojące się owrzodzenie. Leczenie zachowawcze jest trudne i długotrwałe, lepsze wyniki dają zabiegi chirurgiczne.
Leczenie chorób krążenia
Leczenie chorób układu krążenia podobnie jak postępowanie w innych chorobach możemy podzielić na zachowawcze i zabiegowe.
Leczenie zachowawcze
Leczenie zachowawcze - to głównie farmakoterapia (za pomocą różnych klas leków). Jednak zanim rozpocznie się leczenie farmakologiczne, to w różnych chorobach można wypróbować środki, które nie są "pigułkami". Mówimy wtedy o leczeniu niefarmakologicznym.
Na przykład w nadciśnieniu tętniczym warto ograniczyć sól w diecie i zmniejszyć ciężar ciała (czyli odchudzić się). Czasami przynosi to rewelacyjne rezultaty. Jeśli jednak te metody nie pomagają, to należy zapisać leki (cały czas stosując leczenie niefarmakologiczne). Pamiętajmy, że leki trzeba najczęściej należy brać do końca życia. Nadciśnienie tętnicze jest chorobą dającą się kontrolować, ale tak naprawdę nieuleczalną.
W nadciśnieniu stosujemy pięć podstawowych klas leków: alfa- i beta-blokery, leki moczopędne, blokery wapnia oraz inhibitory konwertazy angiotensyny. Pod tymi dziwnymi nawami kryją się tak popularne leki, jak np. Metocard, Tialorid, Captopril. Tzw. alfa-blokery rozszerzają skurczone w nadciśnieniu tętniczki, beta-blokery zmniejszają ilość krwi, jaką serce wyrzuca do naczyń. Z kolei leki moczopędne usuwają wodę i sód z organizmu, co potrafi znakomicie obniżyć ciśnienie. Blokery wapnia są niejednorodną grupą, z której część leków działa głównie na serce (np. Isoptin), zmniejszając częstość i siłę jego pracy (i tym samym wyrzut krwi do naczyń), a część rozkurcza tętniczki. Inhibitory konwertazy angiotensyny (np. Captopril, Enarenal) blokują układ renina-angiotensyna-aldosteron, którego stałe pobudzenie uważa się za jeden z głównych mechanizmów powstania nadciśnienia.
W chorobie wieńcowej bardzo ważne jest zapobieganie jej wystąpieniu. Najważniejszy jest tu tzw. zdrowy tryb życia: prawidłowe odżywianie się (dieta ubogotłuszczowa i ubogocholesterolowa), regularny wysiłek fizyczny, kontrolowanie poziomu cholesterolu we krwi, leczenie chorób współistniejących (zwłaszcza cukrzycy) oraz zaprzestanie palenia tytoniu. Jeśli choroba już wystąpiła, to podajemy leki, które zmniejszają lub likwidują jej objawy i zmniejszają śmiertelność.
W chorobie wieńcowej jako leki podstawowe stosuje się azotany i kwas acetylosalicylowy. Do tych pierwszych należy nitrogliceryna, chyba najbardziej znany z leków "nasercowych". Nitrogliceryna na szczęście nie wybucha, za to ma bardzo pożyteczne działanie - rozkurcza naczynia wieńcowe i zmniejsza ilość krwi dopływającej do serca, tym samym je odciążając. Kwas acetylosalicylowy to nic innego jak popularna aspiryna. W chorobach serca stosuje się go w małych dawkach, które z powodzeniem zapobiegają zakrzepom, nie wywołując prawie wcale działań ubocznych (krwawień). W chorobie wieńcowej bardzo często stosuje się też beta-blokery, blokery wapnia, a po zawale - inhibitory konwertazy angiotensyny. Ich działanie opisaliśmy powyżej.
Leczenie miażdżycy jest trudne, ponieważ nie znamy na razie leków odwracających proces miażdżycowy. Ważna jest profilaktyka w postaci odpowiedniej diety i stylu życia. Pomagają również ćwiczenia fizyczne.
W leczeniu i zapobieganiu miażdżycy często stosujemy tzw. leki hipolipemiczne, czyli obniżające poziom lipidów (tłuszczów) we krwi. Chodzi nam tutaj głównie o cholesterol (a szczególnie jego "złą" frakcję - LDL) oraz trójglicerydy. Stosujemy głównie dwie klasy z tej grupy leków: tzw. statyny, blokujące tworzenie cholesterolu w organizmie oraz fibraty, zaburzające proces wchłaniania lipidów w przewodzie pokarmowym. Statyny (m.in. Zocor, Lipostat) działają głównie na cholesterol, a fibraty (Lipanthyl, Lipanor) przede wszystkim na trójglicerydy. Obniżając poziomy lipidów leki te zapobiegają tworzeniu się blaszki miażdżycowej i zwężeniu naczyń. W przypadkach zaawansowanych korzystamy z pomocy chirurgów naczyniowych.
W niewydolności krążenia do niedawna najważniejszym i najczęściej stosowanym lekiem były preparaty naparstnicy, np. digoksyna. Wzmacniają one często upośledzoną w tej chorobie kurczliwość serca, ale mają szereg objawów niepożądanych i łatwo jest się nimi zatruć. Dlatego zostały wyparte przez leki moczopędne i inhibitory konwertazy angiotensyny, które stosuje się w pierwszym rzucie. Leki moczopędne odciążają chore serce poprzez zmniejszenie ilości krążących w organizmie płynów.
Z chorobami układu krążenia często wiąże się stosowanie leków przeciwzakrzepowych. Oprócz kwasu acetylosalicylowego do tej grupy należy również acenokumarol, warfaryna i heparyna. Leczenie trwa czasami do końca życia i musi być uważnie monitorowane za pomocą badań laboratoryjnych. Pewnym przełomem jest zastosowanie tzw. heparyn drobnocząsteczkowych. Są podawane w formie zastrzyków podskórnych i nie wymagają uciążliwych pomiarów wskaźników krzepliwości. Heparyny są bardzo ważną grupą leków stosowanych w zakrzepowych zapaleniach żył i w zapobieganiu zatorom. Ważnym lekiem jest też streptokinaza, którą podajemy w zawale i w zatorach. Rozpuszcza ona zakrzep, doprowadzający bezpośrednio do niedrożności naczynia.
Leczenie zabiegowe
W leczeniu operacyjnym (czy też szerzej - zabiegowym) mamy obecnie do czynienia z całą gamą metod. Dzięki nim udaje się uratować, a czasami wyleczyć wielu pacjentów, którym kiedyś medycyna nie mogła pomóc.
Pomostowanie naczyń wieńcowych (tzw. by-pass) to chyba najbardziej znana operacja wykonywana w chorobach układu krążenia. Omijamy tutaj zwężone miejsce w naczyniu wieńcowym, tworząc "objazd" dostarczający krew z drugiej strony.
Takie "ominięcia" stosuje się zresztą nie tylko w sercu. Korzystając z naczyń żylnych lub ze sztucznych protez "objazd" prowadzi się również w zmienionych miażdżycowo tętnicach kończyn dolnych. Do innych operacji przywracających przepływ krwi przez tętnice należy też usunięcie zatoru (embolektomia) bądź zakrzepu (trombektomia), poszerzenie zwężonej tętnicy przez jej rozcięcie i wszycie "łaty" oraz udrożnienie tętnicy (tzw. endaretriektomia). Zakrzepy usuwa się również w żyłach. Można do tego celu użyć cewnika z balonikiem, który "przepycha" chore żyły.
W chorobie wieńcowej wykonuje się także coraz częściej zabieg angioplastyki wieńcowej (z ang. PTCA). Polega ona na wprowadzeniu do naczynia cewnika zakończonego balonikiem; w odpowiednim miejscu i czasie balonik wypełnia się, rozszerzając tym samym naczynie. Aby efekt był trwały wprowadza się jeszcze cienką, usztywniającą "sprężynkę" - tzw. stent. Analogiczny zabieg można przeprowadzić w tętnicach kończyn dolnych, gdzie również mamy do czynienia z miażdżycowym zwężeniem naczynia. Innym znanym zabiegiem jest też wymiana chorej zastawki na sztuczną. Niegdyś nowinka, stał się on teraz standardowym zabiegiem wykonywanym na oddziałach kardiochirurgicznych.
Chyba największe emocje i nadzieje budzi jednak zabieg przeszczepu serca. Przypomnijmy, że w Polsce po raz pierwszy dokonał go prof. Religa. Jak twierdzą fachowcy, problemem jest nie tyle strona techniczna tej operacji, ale odrzucanie przeszczepu już po zabiegu.
Żyła odpiszczelowa i jej dopływy.
|
Żyła odstrzałkowa i jej dopływy.
|
FLEBOLOG
Przewlekła niewydolność żylna kończyn dolnych
- przyczyny i objawy

Na przewlekłą niewydolność żylną kończyn (PNŻ) choruje 5-15% osób dorosłych, natomiast 10-15% ma żylaki z grupy 25-50%, u których stwierdza się jakiekolwiek schorzenia żylne, niezależnie od rodzaju i stopnia zaawansowania choroby żylakowej. W społeczeństwach rozwiniętych zwraca się coraz większą uwagę na jakość życia. Przewlekła niewydolność żylna stanowi, więc poważny problem społeczny socjalny i ekonomiczny.
W chorobie tej dochodzi do utrudnionego odpływu krwi żylnej z kończyn i zastoju krwi w układzie powierzchownym, głębokim i w mikrokrążeniu. Uszkodzone zastawki żylne nie zabezpieczają przed cofaniem się krwi w układzie żylnym, nie chronią, zatem układu powierzchownego żył przed wzrostem ciśnienia. Procesy chorobowe, które doprowadzają do uszkodzenia zastawek powodują powstanie zjawiska cofania się krwi, wystąpienia nadciśnienia, zmian w mikrokrążeniu i co za tym idzie powstania objawów klinicznych.
Czynnikami ryzyka powstania PNŻ są płeć (3 : 1 na niekorzyść kobiet), wiek (wzrost zachorowań w 3. dekadzie życia), ciąża ( u około 20% kobiet przyczyną powstania PNŻ była ciąża), otyłość, długie stanie i/lub siedzenie, przyjmowanie estrogenów ( antykoncepcja, hormonoterapia zastępcza).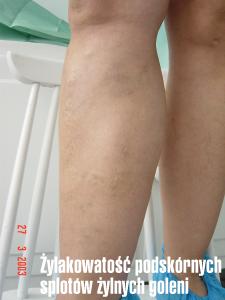
U pacjentów z PNŻ pod koniec dnia występuje uczucie ciężkości kończyn, może pojawić się ból
i kurcze występujące najczęściej
w nocy. W pierwszym okresie rozwijającej się choroby pojawiają się teleangiektazje („pajączki”),
są to rozszerzenia drobnych śródskórnych i podskórnych splotów żylnych. Umiejscawiają się najczęściej na bocznych powierzchniach ud, bocznych okolicach kolan i okolicach podkolanowych. Najczęściej jest to problem kosmetyczny, ale mogą być przyczyną dolegliwości i obrzęków. Objawami PNŻ są również żyły siatkowate i żylaki. Wysokie ciśnienie hydrostatyczne w układzie żylnym kończyn doprowadza do powstania poszerzenia pni żylnych.
Do powstania patologii w układzie żylnym może również usposabiać genetyczne uwarunkowanie osłabienia ściany żylnej. N skutek rozciągania ściany żyły dochodzi do zwiększonej przepuszczalności płynów do przestrzeni poza naczyniowej i powstania obrzęków, które ustępują najczęściej po odpoczynku nocnym. W bardziej zaawansowanym stadium choroby obrzęk staje się twardy, nie ustępujący. Najczęściej zlokalizowany jest w okolicy kostek na grzbiecie stopy a nawet w okolicy 1/3 dolnej goleni.
Dalej pojawiają się przebarwienia skórne na skutek przechodzenie krwinek czerwonych przez niewydolne naczynia włosowate. Dość typowym miejscem występowania przebarwień jest okolica przednia i przyśrodkowa dalszej części goleni w okolicach rozszerzeń żylakowych. W tej okolicy może również występować zapalenie skóry pod postacią ograniczonego lub rozlanego wyprysku. Skóra w tej okolicy staje się sucha, łuszcząca się i bardzo swędząca.
W miarę postępu choroby pojawia się stwardnienie włókniste skóry. Włóknieje skóra i tkanka tłuszczowa podskórna. Z napiętej skóry sączyć się może jasnoczerwony płyn, a miejsce jest bolesne i wrażliwe na dotyk.
Owrzodzenie żylne goleni jest najpoważniejszym powikłaniem PNŻ, nie leczenia żylaków lub przebytej zakrzepicy żył głębokich. Stanowi poważny problem leczniczy. Owrzodzenie najczęściej zlokalizowane jest powyżej kostki przyśrodkowej może być powierzchowne, ale także głębokie dochodzące do powięzi mięśniowej i pokryte martwicą.
W kolejnym artykule o zapobieganiu i leczeniu.
Choroba żylakowa kończyn dolnych - profilaktyka i leczenie >>>
dr hab. n. med. Andrzej Nowicki
ZdroweMiasto.PL
dr hab. med. Sławomir Nazarewski
Katedra i Klinika Chirurgii Ogólnej, Naczyniowej i Transplantacyjnej
Akademii Medycznej w Warszawie
Kierownik Kliniki: Prof. dr hab. med. Jacek Szmidt
SYMWASTATYNA
w leczeniu miażdżycowego
niedokrwienia kończyn dolnych
dr hab. med. Sławomir Nazarewski
SYMWASTATYNA
w leczeniu miażdżycowego
niedokrwienia kończyn dolnych
Katedra i Klinika Chirurgii Ogólnej, Naczyniowej i Transplantacyjnej
Akademii Medycznej w Warszawie
Kierownik Kliniki: Prof. dr hab. med. Jacek Szmidt
5
Spis treści
I. Wprowadzenie .........................................................................................7
II. Miażdżyca zarostowa tętnic kończyn dolnych ...................................9
1. Epidemiologia miażdżycy ...................................................................9
2. Patogeneza miażdżycy .....................................................................12
3. Obraz kliniczny .................................................................................17
4. Leczenie ...........................................................................................24
a. Leczenie farmakologiczne ............................................................28
b. Przezskórna angioplastyka ...........................................................29
c. Leczenie chirurgiczne ...................................................................31
III. Statyny .................................................................................................33
1. Budowa statyn ..................................................................................33
2. Mechanizm działania ........................................................................34
IV. Rola statyn w miażdżycowym niedokrwieniu kończyn dolnych ...39
1. Wpływ symwastatyny na chromanie przestankowe .........................40
2. Wpływ symwastatyny na hiperplazję śródbłonka naczyniowego ......46
3. Wpływ symwastatyny na wyniki odległe
przeszczepów udowo-podkolanowych ............................................52
4. Symwastatyna a restenozy po przezskórnych
zabiegach naczyniowych ..................................................................55
5. Statyny a tętniak aorty brzusznej ......................................................56
V. Podsumowanie .....................................................................................59
VI. Piśmiennictwo .....................................................................................61
7
I. Wprowadzenie
Miażdżyca jest jedną z najbardziej rozpowszechnionych chorób w cywilizowanym
świecie, pochłaniającą coraz więcej ofiar - w tym również znaczną
liczbę ludzi młodych. We wszystkich zestawieniach statystycznych miażdżyca,
jak i jej następstwa, np. zawał mięśnia sercowego, udar mózgowy, choroba
niedokrwienna kończyn dolnych, zajmują, jeśli nie pierwsze, to jedno z czołowych
miejsc w zachorowalności i śmiertelności. Nic zatem dziwnego, iż chorzy
z miażdżycą zarostową tętnic kończyn dolnych, zwłaszcza ze współistniejącą
cukrzycą, stanowią bardzo dużą grupę stałych pacjentów przychodni
pierwszego kontaktu. Chorzy ci, niestety, zbyt często są niewłaściwie diagnozowani
i w związku z tym przez całe lata źle leczeni, najczęściej objawowo,
bez żadnej profilaktyki systemowej [10, 33, 39]. Wg badań przeprowadzonych
ostatnio w Szkocji, aż 84% chorych z objawami chromania przestankowego,
którzy po raz pierwszy zgłosili się z tego powodu do lekarza, ma wskazania do
obniżenia poziomu lipidów [30]. Jak wykazały badania, w polskich warunkach
chorzy z niedokrwieniem kończyn dolnych zaledwie w 52,9% są kierowani
do specjalistycznych poradni naczyniowych i tylko 66,7% znajduje się pod
opieką poradni cukrzycowych [43]. Jak podaje Bild i wsp., nawet jeśli chorzy
z przewlekłym niedokrwieniem kończyn dolnych i współistniejącą cukrzycą
pozostają pod opieką specjalisty, to dokładne badanie stóp w czasie ich wizyt
u lekarza, odbywa się tylko u 12,3% z nich [6].
Pacjent trafia do chirurga naczyniowego zwykle w bardzo zaawansowanym
stadium niedokrwienia, wiele lat po tym, kiedy włączenie odpowiedniej
terapii mogłoby w znaczącym stopniu zmodyfikować historię naturalną jego
choroby. Czynniki ryzyka są doskonale znane, są nimi: palenie tytoniu,
cukrzyca, hiperlipidemia, nadciśnienie tętnicze oraz podwyższenie poziomu
homocysteiny (Rycina 1).
W związku z tym, iż miażdżyca jest chorobą ogólnoustrojową, wszyscy
chorzy z przewlekłym niedokrwieniem kończyn dolnych, bez względu na to,
czy występują u nich objawy choroby wieńcowej, czy też nie, powinni otrzymywać
leczenie profilaktyczne. Działanie zapobiegawcze obejmuje walkę
z nikotynizmem, utrzymywanie prawidłowego poziomu lipidów, prawidłowego
8 9
II. Miażdżyca zarostowa tętnic kończyn dolnych
1. Epidemiologia miażdżycy
Czynniki ryzyka miażdżycy zarostowej tętnic kończyn dolnych (Arteriosclerosis
obliterans - A.O.) nie różnią się od czynników ryzyka miażdżycy
o innej lokalizacji. Do najważniejszych należą płeć męska (3:1) i wiek.
Narażenie rośnie wraz z wiekiem chorego - powyżej 40 roku życia ryzyko
zachorowania wzrasta 2-3 razy po przeżyciu każdej następnej dekady
(Tabela I) [31, 33, 44]. Według innych danych, szacuje się, że w grupie
ludzi w wieku powyżej 70 lat aż 20% ma objawy A.O. o różnym stopniu
nasilenia [39].
45-54
Tabela I. Częstość chromania przestankowego w populacji ogólnej rośnie wraz
z wiekiem (wg K. Ouriela [44]).
55-64
65-74
0,6%
2,5%
8,8%
Wiek chorego (lata) Częstość chromania przestankowego
Niezwykle ważną rolę odgrywa cukrzyca oraz nadciśnienie tętnicze [4].
Stwierdzono, że nadciśnienie tętnicze u mężczyzn zwiększa ryzyko A.O. 2,5
razy, a u kobiet 3,9 razy. Już w 1911 roku Erb stwierdził, że palenie tytoniu
zwiększa trzy razy ryzyko wystąpienia chromania przestankowego. Na zwiększone
ryzyko wystąpienia niedokrwienia kończyn dolnych wpływają ponadto:
dyslipidemia, tj. niewłaściwe proporcje poszczególnych frakcji cholesterolu
(Rycina 2), hyperhomocysteinemia, hyperfibrynogenemia, a także podwyższony
hematokryt.
ciśnienia tętniczego poniżej 130/85 mm Hg, utrzymywanie prawidłowego
poziomu glikemii u chorych z cukrzycą tak, aby poziom hemoglobiny glikozylowej
(HbA1C) nie przekraczał 7%. Ponieważ hiperlipidemia uważana jest
za jeden z głównych czynników ryzyka wystąpienia choroby wieńcowej oraz
rozwoju miażdżycy, należy dążyć, by poziom frakcji LDL cholesterolu nie
przekraczał 100 mg/dL [12, 33]. Do leków o uznanym działaniu obniżającym
poziom cholesterolu całkowitego oraz jego frakcji LDL należą statyny.
Udowodniono, iż symwastatyna podawana przewlekle chorym z niedokrwieniem
kończyn dolnych w dawce 40 mg na dobę redukuje ogólną
śmiertelność o 12%, a śmiertelność z przyczyn naczyniowych o 17%. Zmniejsza
także o 24% częstość zdarzeń sercowo-naczyniowych, a o 27% ryzyko udaru
mózgu oraz o 16% liczbę koniecznych rewaskularyzacji obwodowych [33].
Okazało się ponadto, iż podawanie symwastatyny chorym z chromaniem
przestankowym wpływa bardzo korzystnie nie tylko na zdarzenia sercowo-
-naczyniowe, ale w sposób znamienny zmniejsza dolegliwości wynikające
z niedokrwienia kończyn dolnych.
Hiperglikemia
Oporność
na insulinę
Podwyższenie
poziomu
homocysteiny
Hiperlipidemia Nadciśnienie
tętnicze
STATYNY
MIAŻDŻYCA
Rycina 1. Czynniki ryzyka miażdżycy oraz miejsce działania statyn.
10 11
Blisko 1/3 przebadanych chorych miała objawy chromania przestankowego.
Wykazano, że u 41,4% chorych z A.O. współwystępuje choroba wieńcowa
lub choroba naczyń mózgu, a u 8,6% występują wszystkie trzy patologie
razem (Rycina 3) [9, 44].
19,2 %
11,9 %
3,8 %
3,3 %
24,6 %
29,9 %
Choroba
wieńcowa
A.O.
Rycina 3. Częstość objawów choroby wieńcowej, przewlekłego niedokrwienia kończyn
dolnych i choroby niedokrwiennej ośrodkowego układu nerwowego wśród blisko
20 000 pacjentów z miażdżycą (n=19185=100%) (dane wg badania CAPRIE [9]).
Choroba
niedokrwienna
OUN
7,3 %
Badania epidemiologiczne wskazują na to, iż ryzyko utraty kończyny
u chorych z chromaniem przestankowym jest mniejsze niż ryzyko wystąpienia
innych powikłań miażdżycy (Rycina 4). Wykazano mianowicie, że
ryzyko zgonu z przyczyn sercowo-naczyniowych w ciągu roku obserwacji
wynosi 6,8%, a ryzyko zawału mięśnia sercowego 2,0%, podczas gdy
ryzyko interwencji zabiegowej tylko 1,0%, a ryzyko wykonania dużej amputacji
kończyny - 0,4%. Ryzyko amputacji kończyny dolnej w ciągu 5 lat u
chorego z II stopniem niedokrwienia kończyny wg Fontaine'a wynosi 2%.
Ryzyko to gwałtownie rośnie wraz ze stopniem zaawansowania choroby
- u chorego z bólami spoczynkowymi ryzyko dużej amputacji wynosi 12,2%
w ciągu 3 miesięcy [44]. Przyczyną zgonu 55% chorych z A.O. jest zawał
mięśnia sercowego, a 10% udar mózgu. Dwadzieścia pięć procent chorych
umiera z przyczyn niezwiązanych z naczyniami, a 10% z powodu zmian w
aorcie i tętnicach obwodowych (najczęściej w wyniku pęknięcia tętniaka aorty
brzusznej) [44].
Zły cholesterol Dobry
cholesterol
Chylomikron
1000 nm
VLDL
70 nm
IDL
40 nm
LDL
20 nm
HDL
10 nm
Rycina 2. Podzial lipoprotein; frakcja HDL to tzw. „dobry” cholesterol [19].
Hipercholesterolemia jest uznanym czynnikiem ryzyka miażdżycy uogólnionej.
Odpowiada także za przyspieszone powstawanie zmian w tętnicach
wieńcowych. Podawanie leków obniżających poziom lipidów w surowicy
okazało się niezwykle pomocne w uzyskaniu normolipemii i w sposób
znamienny statystycznie zmniejszyło ryzyko wystąpienia zdarzeń sercowo-
naczyniowych włączając w to zgony z przyczyn sercowych. Leczenie
prewencyjne statynami okazało się niezwykle korzystne także z ekonomicznego
punktu widzenia [12]. Badania angiograficzne, które wykonywano
kontrolnie w odległym okresie pooperacyjnym udowodniły, że statyny
wyraźnie opóźniają powstawanie zmian miażdżycowych w tętnicach wieńcowych
[12].
Współistnienie kilku czynników ryzyka zwiększa szansę na wystąpienie
A.O. [32]. Biorąc pod uwagę tylko trzy czynniki: palenie tytoniu, cukrzycę
i nadciśnienie tętnicze, szansa na wystąpienie A.O. wzrasta 2,3 razy przy
jednym czynniku ryzyka, 3,3 razy przy dwóch, 6,3 razy przy współistnieniu
wszystkich trzech czynników ryzyka [31, 33, 39]. Zmiany miażdżycowe w
tętnicach kończyn dolnych zwykle współistnieją z mniej lub bardziej nasilonymi
zmianami miażdżycowymi w pozostałych częściach układu tętniczego.
Badanie CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic
Events), przeprowadzone u blisko 20 000 ludzi, w sposób jednoznaczny
ilustruje zależność pomiędzy chromaniem przestankowym, a występowaniem
choroby wieńcowej i/lub niedokrwienia ośrodkowego układu nerwowego.
12 13
SKURCZ
NACZYNIA
nadciśnienie
tętnicze
migracja
i rozplem komórek
mięśni gładkich
tęnicy
REAKCJA
ZAPALNA
uwolnienie
chemokin
uwolnienie
cytokin
wzrost aktywności
cząsteczek adhezyjnych
SKŁONNOŚĆ
DO ZAKRZEPICY
nadkrzepliwość
aktywacja płytek
hamowanie
fibrynolizy
ATEROGENEZA
eNO
endotelina-1
angiotensyna II
eNO
czynnik tkankowy
inhibitor aktywatora
plazminogenu-1
prostacyklina
ŚRÓDBŁONEK
CHORESTEROL LDL
eNO
aktywacja NF- B
angiotensyna II
aktywacja
aktywatora białka-1
Rycina 5. Zaburzenia funkcji śródbłonka naczyniowego prowadzące do obkurczenia tętnicy,
nasilenia reakcji zapalnych w ścianie oraz do wzrostu podatności na zakrzepicę;
eNO - tlenek azotu syntetyzowany w endothelium; NF-B - czynnik transkrypcyjny
kappa-B (na podstawie Beckmana i wsp. [4]).
Wydaje się, iż dla rozwoju miażdżycy duże znaczenie ma proces modyfikacji
składników białkowych i lipidowych lipoproteiny LDL, polegający głównie
na ich utlenianiu, glikozylacji oraz na trawieniu przez enzymy proteolityczne
[46]. Już minimalna modyfikacja struktury lipoproteiny LDL powoduje, że jest
ona silniej wiązana przez proteoglikany błony wewnętrznej, a przez to ściślej
izolowana przed znajdującymi się we krwi antyoksydantami. Taka izolacja
nasila dalszą ich modyfikację, a to z kolei prowadzi do silnej miejscowej
reakcji zapalnej zapoczątkowującej ekspresję cząsteczek adhezyjnych
- selektyn P i E, ICAM-1 (InterCellular Adhesion Molecule-1) oraz VCAM-1
0 1 2 3 4 5 6 7 8 9 10
20
40
60
80
100
Krzywa przeżycia
Zawał mięśnia sercowego
Zabiegi naczyniowe
Amputacje
Rycina 4. Krzywa przeżycia oraz krzywe częstości występowania zawału mięśnia sercowego,
częstości wykonywanych zabiegów naczyniowych (endowaskularnych
i chirurgicznych) oraz częstości dużych amputacji kończyny dolnej w ciągu 10 lat
obserwacji chorego z wyjściowym rozpoznaniem A.O. w II stopniu zaawansowania
wg klasyfikacji Fontaine'a [44].
Odsetek pacjentów (%)
Lata
2. Patogeneza miażdżycy
Znajomość procesów zachodzących w ścianie tętnicy, prowadzących
do rozwoju miażdżycy, jest istotna dla zrozumienia patogenezy chorób
układu sercowo-naczyniowego o podłożu miażdżycowym i ma podstawowe
znaczenie dla diagnostyki, terapii, a przede wszystkim dla profilaktyki
tych chorób. Miażdżyca jest przewlekłym procesem zapalnym toczącym
się początkowo w błonie wewnętrznej tętnic, a następnie także w błonie
mięśniowej. Najważniejszym czynnikiem odpowiedzialnym za powstawanie
i rozwój zmian miażdżycowych jest cholesterol, który dostarczany jest do
tkanek za pośrednictwem lipoproteiny LDL [46]. Obecnie przyjmuje się,
iż kluczowym elementem rozwoju zmian miażdżycowych (ateromatycznych)
jest uszkodzenie funkcji śródbłonka naczyniowego.
Na historię naturalną aterogenezy składają się trzy podstawowe fazy:
1/ faza początkowa powstawania blaszki miażdżycowej (plaque),
2/ progresja zmian,
3/ powikłania ze strony blaszki miażdżycowej (blaszka miażdżycowa
niesta bilna).
14 15
Zawał mięśnia
sercowego
Niedokrwienie
kończyn dolnych
Udar mózgu
Kalcyfikacja
Skrzeplina
(zakrzep)
Zredukowany
przepływ krwi
Leukocyty i płytki krwi
aktywne nieaktywne
Blaszka miażdżycowa
stabilna niestabilna
migracja
i proliferacja
miocytów
obrzęk
śródbłonka
PRAWIDŁOWA
TĘTNICA
- przekrój
ŚRÓDBŁONEK
BŁONA ŚRODKOWA
(mięśniówka gładka)
PRZYDANKA (tkanka łączna)
BŁONA PODSTAWNA (proteoglikany + kolagen)
TKANKOWY
AKTYWATOR
PLAZMINOGENU
(działanie
fibrynolityczne)
PROSTACYKLINA
+ TROMBOMODULINA
(działanie
przeciwzakrzepowe)
eNO
- rozszerzenie naczynia
- działanie antyadhezyjne
- działanie
antyproliferacyjne
Rycina 6. Rola śródbłonka naczyniowego w utrzymaniu homeostazy w zdrowej tętnicy oraz
historia naturalna powstawania blaszki miażdżycowej; eNO - tlenek azotu.
Kierunek przepływu krwi
Lat Wiek 0 10 20 30 40+
Trzecia, ostatnia faza rozwoju blaszki miażdżycowej rozpoczyna się w
chwili, gdy dochodzi do zmian strukturalnych w obrębie stabilnej do tej pory
blaszki miażdżycowej. Pęknięcie powierzchni blaszki miażdżycowej i kontakt
jej zawartości z światłem naczynia decydują o przemianie w blaszkę niestabilną.
Także i na tym etapie ważną rolę odgrywają makrofagi, które uwalniają
enzymy proteolityczne należące do grupy metaloproteinaz (MMP - Matrix
MetalloProteinase), np. stromielizynę i kolagenazę. Enzymy te rozkładają
zrąb łącznotkankowy otoczki blaszki miażdżycowej. Wykazano, że blaszka
pęka najczęściej w miejscach, gdzie nacieki z komórek zapalnych są szczególnie
nasilone. Przez pękniętą blaszkę miażdżycową krew z światła tętnicy
trafia do rdzenia blaszki i tu interferuje z czynnikiem tkankowym, tj. głównym
czynnikiem aktywującym zewnątrzpochodną kaskadę krzepnięcia. Powstała
skrzeplina może ograniczać swój zasięg jedynie do blaszki, w której ulega
reorganizacji i włóknieniu, co w konsekwencji zwykle prowadzi do zwiększenia
objętości blaszki i nasilenia stopnia zwężenia naczynia [44, 46]. Skrzeplina
może także rozprzestrzeniać się do światła naczynia.
(Vascular Cell Adhesion Molecule-1) [44, 46]. Są to proteiny pojawiające się
na powierzchni komórek śródbłonka, które reagują z antygenami obecnymi
na powierzchni leukocytów i umożliwiają ich przyleganie do powierzchni
błony wewnętrznej.
W pierwszej (początkowej) fazie powstawania blaszki miażdżycowej
molekuły adhezyjne zatrzymują na wewnętrznej powierzchni śródbłonka
przepływające leukocyty, które następnie przenikają do błony wewnętrznej.
Aktywacja komórek śródbłonka stymuluje wydzielanie chemokin i cytokin,
co prowadzi do kumulacji monocytów i limfocytów.
Ściana naczynia wykształciła mechanizmy, które w warunkach fizjologicznych
chronią przed tymi zmianami. Należy do nich synteza tlenku azotu
(eNO) (Rycina 5).
Wykazano, że tlenek azotu, poza działaniem rozszerzającym naczynie,
hamuje zdolność leukocytów do adhezji do śródbłonka tętnicy [38, 44]. Stwierdzono
ponadto, iż na poziomie transkrypcji tlenek azotu interferuje z jądrowym
czynnikiem kappa-B (NF-B) i hamuje ekspresję genu odpowiedzialnego
za syntezę VCAM-1 w komórce śródbłonka. Prawidłowy, laminarny przepływ
krwi przez tętnicę stymuluje śródbłonkową syntazę tlenku azotu zwiększając
w ten sposób miejscowe stężenie eNO i potęguje jego właściwości przeciwzapalne
oraz rozszerzające naczynie. Natomiast przepływ turbulentny, któremu
zwykle towarzyszy zwiększony gradient naprężenia ścinającego, taki jaki na
przykład powstaje w miejscu podziału tętnicy na mniejsze gałęzie, osłabia
aktywność przeciwzapalną śródbłonka zależną od tlenku azotu [44, 46].
W błonie wewnętrznej tętnicy monocyty ulegają transformacji w makrofagi.
Nieograniczona absorpcja cholesterolu przez makrofagi prowadzi do przekształcenia
ich w tzw. komórki piankowate. Rozpad tych komórek stymuluje
pozakomórkowe odkładanie się złogów cholesterolowych i powstanie tzw.
rdzenia lipidowego blaszki miażdżycowej. Chociaż na tym etapie istnieje
możliwość odwrócenia choroby, to jednak stale rosnące gromadzenie się
komórek piankowatych w śródbłonku, stymuluje przemianę blaszki w formę
bardziej zaawansowaną zbudowaną dodatkowo z włókien tkanki łącznej.
Tworzy się włóknista macierz blaszki miażdżycowej [19, 44]. Makrofagi
stymulują proces miażdżycowy na każdym jego etapie, a dodatkowo aktywują
również limfocyty T, głównie za pośrednictwem interleukiny IL-2. Makrofagi,
za pośrednictwem różnych czynników wzrostowych (np. PDF, ILGF-1)
pobudzają komórki mięśni gładkich, które z błony środkowej migrują do błony
wewnętrznej i tu ulegają intensywnej proliferacji [46]. W wyniku intensywnych
podziałów komórek mięśniowych oraz wzmożonej syntezy macierzy pozakomórkowej
objętość blaszki miażdżycowej systematycznie rośnie (Rycina 6).
16 17
Proces ten jest zróżnicowany i polega zarówno na przeroście ściany tętnicy i
zwiększeniu jej średnicy (dodatnia przebudowa), jak też może przejawiać się
obkurczeniem ściany (ujemna przebudowa). Proces dodatniej przebudowy
określanej także jako zjawisko Glagova może przez długi czas niwelować
hemodynamiczne skutki blaszki miażdżycowej [26, 46] (Rycina 8).
Zwężenie 40%
Rycina 8. Zmiany średnicy tętnicy oraz jej światła w czasie postępu miażdżycy. W początkowej
fazie występuje przebudowa dodatnia polegająca na tym, że powiększanie
się rdzenia lipidowego blaszki miażdżycowej powoduje wzrost przekroju całej
tętnicy, a przekrój światła jest stały lub podlega tylko niewielkim zmianom (zjawisko
Glagova). Przekrój całej tętnicy powiększa się do momentu, gdy jej światło
stanowi 40% przekroju tętnicy, później traci ona zdolność powiększania swojej
średnicy. W ostatniej fazie - przebudowy ujemnej, dalsze powiększanie się
rdzenia lipidowego blaszki miażdżycowej redukuje światło naczynia (wg Glagova
i wsp. [26]).
W początkowej fazie występuje przebudowa dodatnia polegająca na tym,
że powiększanie się rdzenia lipidowego blaszki miażdżycowej powoduje
wzrost przekroju całej tętnicy, a przekrój światła jest stały lub podlega tylko
niewielkim zmianom (zjawisko Glagova). Przekrój całej tętnicy powiększa się
do momentu, gdy jej światło stanowi 40% przekroju tętnicy, później traci ona
zdolność powiększania swojej średnicy.
W ostatniej fazie - przebudowy ujemnej, dalsze powiększanie się rdzenia
lipidowego blaszki miażdżycowej redukuje światło naczynia (wg Glagova
i wsp. [26]).
3. Obraz kliniczny
Bóle o typie chromania przestankowego (Tabela II), pierwszy objaw choroby
skłaniający pacjentów do wizyty u lekarza, należy różnicować z innymi bólami
o etiologii pozanaczyniowej, a także z innymi chorobami naczyniowymi dającymi
podobne objawy bólowe (Tabele III - VII) [8, 10, 25, 58]. Typowy ból
kończyn dolnych u chorych z A.O. występuje zawsze po przejściu podobnego
O tym, czy blaszka miażdżycowa będzie blaszką stabilną czy niestabilną,
decydują dwa główne czynniki. Pierwszy czynnik to grubość otoczki
(czapeczki włóknistej - fibrous cap) wokół rdzenia lipidowego, a drugi - ilość
zawartego w niej kolagenu. Zaobserwowano, że pęknięciom blaszki miażdżycowej
towarzyszą nacieki z limfocytów T. Przypuszcza się, że limfocyty T
obecne w obrębie blaszki miażdżycowej mogą hamować wytwarzanie kolagenu
przez komórki mięśni gładkich i w ten sposób, pośrednio przyczyniać
się do pęknięcia cienkiej otoczki rdzenia lipidowego i całej blaszki miażdżycowej
[44] (Rycina 7).
Otoczka
Błona środkowa
Rdzeń lipidowy
Światło
tętnicy
Blaszka niestabilna
Blaszka stabilna
Limfocyt T
Makrofag
Aktywowana komórka mięśnia gładkiego
Komórka mięśnia gładkiego
Rdzeń
lipidowy
Światło
tętnicy
Rycina 7. Schemat powstawania blaszki miażdżycowej stabilnej i niestabilnej.
Zwraca się uwagę na możliwy udział metaloproteinaz, uwalnianych przez
makrofagi, w powstawaniu zmian wstecznych w obrębie blaszki miażdżycowej,
a także na udział Chlamydia pneumoniae jako czynnik etiologiczny
rozwoju miażdżycy poprzez zakażenie komórek biorących udział w tworzeniu
blaszki miażdżycowej [44].
Blaszka miażdżycowa początkowo rośnie od światła tętnicy w kierunku błony
zewnętrznej, co stymuluje przebudowę pozostałych warstw ściany naczynia.
18 19
Tabela IV. Diagnostyka bólów w kończynach dolnych - ciąg dalszy [8].
Elementy
różnicujące
Chromanie
przestankowe (A.O.)
Chromanie
żylne
Bóle pochodzenia
neurologicznego
Charakter bólu kurcz mięśni rozsadzający
podobny do porażenia
prądem elektrycznym
Początek
dolegliwości
stopniowo narastający
stopniowy, ale
może być nagły
zwykle nagły
Ustępowanie bólu
przerwanie marszu,
pozycja stojąca
uniesienie
kończyny
pozycia siedząca,
pochylenie do przodu
Lokalizacja bólu
grupa mięśniowa, np.
łydka, udo lub pośladek
w całej kończynie
słaba lokalizacja, może
dotyczyć całej kończyny
Dolegliwości
w kończynach dolnych
zwykle w jednej zwykle w jednej często w obu
Elementy różnicujące A.O. T.O.
Epidemiologia równomierne rozpowszechnienie częściej w krajach Wschodu
Wiek pacjenta w chwili
rozpoznania choroby > 40 lat < 40 lat
Patologia
rozwój blaszki miażdżycowej
+ miejscowa zakrzepica etiologia zapalna
Zmiany w naczyniach w naczyniach o dużej średnicy w naczyniach o małej średnicy
Lokalizacja zmian
najczęściej zmiany w odcinku
biodrowo-udowym
najczęściej zmiany w obwodowych
naczyniach kończyn dolnych i górnych
Zmiany w żyłach nie tak
Postęp choroby ciągły
naprzemienne okresy
zaostrzenia i remisji
Objaw Raynauda bez związku tak (u > 40% chorych z T.O.)
Związek z paleniem tytoniu czynnik ryzyka pacjent zwykle jest nałogowym palaczem
Możliwość rekonstrukcji
naczyniowej tak najczęściej bardzo ograniczona
Tabela V. Różnicowanie miażdżycy tętnic kończyn dolnych (A.O.) i zakrzepowo-zarostowe-
go zapalenia naczyń (T.O. - Thrombangiitis obliterans; choroba Buergera).
dystansu i mija po kilku minutach odpoczynku nawet w pozycji stojącej. Stały
postęp miażdżycy prowadzi w ciągu 5 lat do progresji dolegliwości i skracania
dystansu chromania u 25% chorych, a u 5% do amputacji kończyny [32].
W przypadku zmian w kręgosłupie, bóle kończyn dolnych nie ustępują
po zaprzestaniu marszu i mogą ulec nasileniu podczas stania lub siedzenia.
Lokalizacja bólu zależy od miejsca najbardziej nasilonych zmian miażdżycowych
w tętnicach - bóle łydek występują przy zmianach w tętnicy udowej
powierzchownej, bóle ud i pośladków przy zmianach w aorcie brzusznej i
tętnicach biodrowych.
I
Tabela II. Klasyfikacja miażdżyc tętnic kończyn dolnych wg Fontaine`a.
II
II
IIa
IIb
bezobjawowa
chromanie przestankowe
dystans chromania ≥ 200 metrów
dystans chromania < 200 metrów
III bóle spoczynkowe i nocne
IV martwica, zgorzel
Stopień niedokrwienia Objawy kliniczne choroby
Neuropatie obwodowe
Tabela III. Diagnostyka różnicowa bólów w kończynach dolnych [8,10, 25].
neurogenne
Przyczyny pozanaczyniowe
Zmiany wyrodnieniowe
stawów biodrowych
z układu kostno-mięśniowego
Miażdżyca zarostowa tętnic
kończyn dolnych (A.O.)
Stenoza kanału kręgowego
(→chromanie rzekome) Torbiel Bakera Zator i zakrzepica tętnicza
Przepuklina krążka międzykręgowego
(→rwa kulszowa)
Naciągnięcie mięśni kończyny
dolnej, urazy ścięgień i więzadeł
Zakrzepowo-zarostowe
zapalenie naczyń (T.O.)
Zespół niespokojnych nóg Choroby tkanki łącznej
Zakrzepica żył głębokich
kończyn dolnych
Przyczyny naczyniowe
20 21
Dla potrzeb chirurgicznych zaproponowany został podział zmian miażdżycowych
w tętnicach kończyn dolnych, który uwzględnia techniczne
możliwości wykonania operacji naczyniowej. Jednym z bardziej popularnych
jest podział zaproponowany przez Darlinga i zmodyfikowany przez Halletta
[18, 28]. Obejmuje on trzy typy zmian w tętnicach. Typ I to zmiany ograniczone
do odcinka aorty brzusznej poniżej odejścia tętnic nerkowych oraz do
tętnic biodrowych (Rycina 9). Typ II obejmuje wielopoziomowe zmiany ograniczone
do odcinka biodrowego i tętnicy udowej powierzchownej. Tętnice
podkolanowe i tętnice podudzi są zwykle drożne (Rycina 10). Typ III to zmiany
w tętnicy udowej powierzchownej, podkolanowej i tętnicach podudzi - tętnicy
piszczelowej przedniej i tylnej oraz strzałkowej (Rycina 11a, 11b).
Rycina 9. Zmiany typu I wg Darlinga i Halletta - niedrożność (wysoka) końcowego odcinka
aorty brzusznej - zespół Leriche'a.
Elementy
różnicujące
Chorzy z A.O.
i cukrzycą
Chorzy z A.O.
bez cukrzycy
Największe nasilenie zmian
w małych tętnicach obwodowych
kończyn dolnych
zwykle w odcinku
biodrowo-udowym
Zmiany w tętnicach podudzi bardzo częste umiarkowanie częste
Krążenie oboczne słabo wykształcone najczęściej dobrze rozwinięte
Lokalizacja zmian skórnych punkty podparcia stopy oraz palce stopy / okolica kostek
Mikroangiopatia bardzo często czasami występuje
Neuropatia bardzo często nie lub wyjątkowo
Kalcyfikacja ściany tętnicy bardzo nasilona ograniczona
Tabela VI. Porównanie miażdżycy tętnic kończyn dolnych u chorych z cukrzycą i bez cukrzycy.
Badanie fizykalne kończyny (porównanie z drugą kończyną):
Dodatkowo należy wykonać:
- badanie dotykiem w celu wykluczenia tętniaka aorty brzusznej,
- badanie osłuchowe w celu wykrycia szmerów naczyniowych (w tym na tętnicach szyjnych)
utrata owłosienia na skórze kończyny
kruche, łamliwe paznokcie
suchy, łuszczący się, atroficzny naskórek
możliwe zaczerwienienie skóry
bladość kończyny po jej elewacji pod kątem 60° na jedną minutę
(po opuszczeniu kończyny - prawidłowe zabarwienie skóry powraca po 10-15 sekundach;
powrót do normy po >40 sekundach oznacza krytyczne niedokrwienie kończyny)
owrzodzenie troficzne, zgorzel
brak tętna lub słabe tętno na tętnicach kończyny
(na tętnicy udowej wspólnej, podkolanowej, piszczelowej tylnej i/lub grzbietowej stopy)
szmer naczyniowy nad tętnicą
Tabela VII. Objawy przewlekłego niedokrwienia kończyny dolnej [25].
Rycina 10. Zmiany typu II wg Darlinga i Halletta - niedrożność
tętnicy udowej powierzchownej lewej, nasilone
zmiany miażdżycowe w tętnicy udowej
powierzchownej prawej.
22 23
kończyn dolnych. Należy jednak pamiętać o tym, że u chorych z cukrzycą lub
przewlekłą niewydolnością nerek może dochodzić do zafałszowania wyniku
z powodu zwapnienia ściany tętnic i zmniejszenia ich podatności na ucisk
w czasie badania.
0
0•2
0•4
0•6
0•8
1•0
1•2
Norma
Chromanie
przestankowe
Bóle
spoczynkowe
Martwica
Ostre niedokrwienie
kończyny
Indeks kostkowo-ramienny
Rycina 12. Zależność między indeksem kostkowo-ramiennym a stopniem zaawansowania
niedokrwienia kończyn dolnych (wg K. Ouriela [44]).
Indeks kostkowo-ramienny można również wykorzystać jako czynnik
prognostyczny wychodząc z założenia, iż miażdżycowe niedokrwienie
kończyn dolnych jest jednym z objawów miażdżycy uogólnionej, a zatem
obejmującej swym zakresem także naczynia wieńcowe i mózgowe [16, 21,
39] (Rycina 13).
Arteriografia tętnic kończyn dolnych, jako badanie inwazyjne, powinna
być wykonywana jedynie u tych chorych z A.O., u których planowane jest
wykonanie chirurgicznej rekonstrukcji naczyniowej lub zabiegu przezskórnej
angioplastyki. Do diagnostyki układu tętniczego kończyn dolnych coraz szerzej
stosuje się tomografię komputerową (angio-KT) oraz rezonans magnetyczny
(angio-NMR), zwłaszcza u chorych z niewydolnością nerek (dzięki mniejszemu
objętościowo obciążeniu nefrotoksycznym kontrastem) [55].
Rycina 11a. Zmiany typu III wg Darlinga i Halletta - nasilone zmiany miażdżycowe w tętnicach
podudzi.
Rycina 11b. Zmiany typu III wg Darlinga i Halletta - główne pnie tętnicze podudzia niedrożne,
bogate krążenie oboczne.
Niezwykle pomocnym nieinwazyjnym badaniem, pozwalającym na ocenę
lokalizacji i nasilenia zmian miażdżycowych w tętnicach kończyn dolnych
jest badanie dopplerowskie tętnic. Określenie za jego pomocą indeksu kostkowo-
ramiennego (AB(P)I - Ankle-Brachial (Pressure) Index; stosunek
ciśnienia tętniczego na poziomie kostki do ciśnienia oznaczonego na tętnicy
ramiennej) daje wstępną ocenę stopnia zaawansowania niedokrwienia
kończyn dolnych (Rycina 12). Gradient ciśnień większy niż 30 mm Hg pozwala
sądzić, że istnieje odcinek niedrożny między badanymi poziomami tętnic
24 25
Hyperlipidemii
Hyperglikemii
Nadciśnienia tętniczego
Antyagregacyjne
Hyperhomocysteinemii
Tabela VIIIa. Kierunki profilaktyki i leczenia chorych z A.O.; TG - trójglicerydy.
LDL cholesterol <100 mg/dL i TG <150 mg/dL
HbA1c <7,0%
< 130/85 mm Hg
Program ćwiczeń fizycznych
Zerwanie z nałogiem palenia tytoniu
Obniżenie wagi ciała
(przy istniejącej nadwadze)
Leczenie
farmakologiczne
Zmiana
stylu życia
Tabela VIIIb. Kliniczne korzyści wynikające z właściwej profilaktyki i leczenia chorych z A.O.
(na podstawie W. Hiatt'a [31]).
Postępowanie
Ryzyko zawału
m. sercowego/
udaru mózgu/
śmierci*
Wpływ
na kończyny
dolne
Wpływ
na objawy
A.O.
Rzucenie palenia możliwe ↓ ryzyko amputacji ↓ 0
Leczenie dyslipidemii ↓ postęp choroby ↓ możliwe korzyści
Leczenie cukrzycy możliwe korzyści
nie wpływa na ↓
ryzyka amputacji ?
Leczenie nadciśnienia
tętniczgo
możliwe ↓ ? 0
Podawanie
inhibitorów ACE
↓ ? ?
ASA możliwe ↓ wskaźnik drożności
przeszczepu ↑ 0
Tiklopidyna ↓ wskaźnik drożności
przeszczepu ↑ możliwe korzyści
Modyfikacja czynników ryzyka
Leki przeciwpłytkowe
Klopidogrel ↓ ? ?
ACE - inhibitory enzymu konwertującego angiotensynę; ASA - kwas acetylosalicylowy; * - zgon z przyczyn sercowo-naczyniowych;
? - wpływ nieznany; 0 - brak wpływu
0 1 2 3 4 5 6 7 8 9 10
20
40
60
80
100
ABPI > 0,85
Wskaźnik przeżycia chorych (%)
Lata
ABPI > 0,4-0,85
ABPI < 0,4
Rycina 13. Zależność między przeżyciem chorych a stopniem zaawansowania A.O.
wyrażonym indeksem kostkowo-ramiennym (wg Donnelly i wsp. [21]).
4. Leczenie
Najważniejszym problemem klinicznym chorych z A.O. jest nie tyle
ograniczenie ich sprawności ruchowej, ale przede wszystkim zagrożenie
niebezpiecznymi, często śmiertelnymi powikłaniami sercowo-naczyniowymi
takimi jak zawał mięśnia sercowego lub udar mózgu. Podwyższone
ryzyko zgonu istnieje nawet wtedy, gdy u pacjenta brak jest objawów choroby
wieńcowej lub niedokrwienia ośrodkowego układu nerwowego [32, 58].
Zatem leczenie chorych z miażdżycowym niedokrwieniem kończyn dolnych
powinno być dwukierunkowe. Z jednej strony należy eliminować wszystkie
czynnikach ryzyka, które mogą nasilać istniejące zmiany miażdżycowe
(profilaktyka), a z drugiej strony, dysponując dostępnymi środkami terapeutycznymi,
powinniśmy wpływać bezpośrednio na objawową chorobę i jej
skutki - farmakoterapia, przezskórne zabiegi wewnątrznaczyniowe, leczenie
chirurgiczne [31, 32, 44] (Tabela VIIIa, VIIIb, IX, Xa, Xb, Rycina 14).
26 27
22
50
152
154
156
158
160
162
164
166
168
170
172
174
176
178
180
182
184
186
188
190
192
194
196
198
200
52 54 56 58 60 62 64 66 68 70 72 74 76 78 80 82 84 86 88 90 82 94 96 98 100 102 104 106
23 23 24 25
21
21
22 23 24 24 25
21 22 23 24 25 25
20
20
19
19
18
21 22 22 23 24 25
20 21 22 23 23 24 25
20 21 21 22 23 24 24 25
19
19
18 18
17 18
17
17
16
16
18 18
17 18
17 17 18
16 17 18 18
15 16 17 17 18
15
15
14
16 16 17 18 18
15 16 17 17 18 18
15 16 16 17 17 18 18
14
14
14
15 15 16 16 17 18 18
14 15 16 16 17 17 18 18
14 15 15 16 16 17 17 18 18
13
13
13
14 14 15 15 16 16 17 18 18
14 14 15 15 16 16 17 17 18 18
13 14 14 15 15 16 16 17 17 18 18
13 13 14 14 15 15 16 16 17 17 18 18
18
20 21 22 22 23 24 25 25
20 20 21 22 22 23 24 25 25
19 20 21 21 22 23 23 24 25 25
19 19 20 21 21 22 23 24 24 25
19 20 20 21 22 22 23 24 24 25
19
19
20 20 21 22 22 23 24 24 25
19 20 21 21 22 23 23 24 25 25
19
19
20 20 21 21 22 23 23 24 25 25
19 20 20 21 22 22 23 23 24 25 25
19 19 20 21 21 22 22 23 24 24 25 25
19 19 20 21 21 22 22 23 24 24 25 25
19
19
20 20 21 21 22 23 23 24 24 25 25
19 20 20 21 22 22 23 23 24 24 25 25
19 19 20 20 21 22 22 23 23 24 24 25 25
19 20 20 21 21 22 22 23 23 24 24 25 25
19 19 20 20 21 21 22 22 23 23 24 24 25
19 19 20 20 21 21 22 22 23 23 24 24 25
19 19 20 20 21 21 22 22 23 23 24 24 25
19 19 20 20 21 21 22 22 23 23 24 24 25 25
26 27 28 29 29 30
26 27 28 29 30 30
26 27 28 29 30 30
26 26 27 28 29 30 30
26 27 27 28 29 30 30
26 27 27 28 29 30 30
26 27 28 28 29 30 30
26 27 28 28 29 30 30
26 27 28 28 29 30 30
26 26 27 28 28 29 30 30
26 26 27 28 28 29 30 30
26 26 27 28 28 29 30 30
26 26 27 28 28 29 30 30
27 26 27 28 28 29 30 30
27 26 27 28 28 29 30 30
27 26 27 28 28 29 30 30
27 26 27 28 28 29 30 30
27 26 27 28 28 29 29 30
27 26 27 28 28 29 29 30
27 26 27 28 28 29 29
27 26 27 28 28 29
26 26 27 27 28 28
26 26 27 27
26 26 27
26 26 27
27
28
31 32 33 34 35 35 36 37 38 39 40 41 42 42 43 44 45 46
31 32 33 34 35 35 36 37 38 39 40 40 41 42 43 44 45
31 32 33 34 35 35 36 37 38 39 39 40 41 42 43 44
31 32 33 34 34 35 36 37 38 38 39 40 41 42 42
31 32 33 34 34 35 36 37 38 38 39 40 41 41
31 32 33 34 34 35 36 37 37 38 39 40 40
31 32 33 33 34 35 36 36 37 38 39 39
31 32 33 33 34 35 36 36 37 38 38
31 32 33 33 34 35 35 36 37 38
31 32 33 33 34 35 35 36 37
31 32 32 33 34 34 35 36
31 32 32 33 34 34 35
31 32 32 33 34 34
31 32 32 33 33
31 31 32 33
31 31 32
31 31
31
prawidłowa masa ciała niedobór masy ciała nadwaga otyłość
masa ciała (kg)
wzrost (cm)
Tabela Xb. Normy należnej wagi ciała w oparciu o BMI - ciąg dalszy.
w pełni sprawny
Chory z chromaniem
przestanowym
Ćwiczenia
+ farmakoterapia Arteriografia
Leczenie
chirurgiczne
Zabiegi
wewnątrznaczyniowe
Angioplastyka
balonowa Założenie stentu
ograniczona sprawność
nasilone zmiany
w tętnicach podudzia
zmiany
na długim
odcinku
zmiany
na krótkim
odcinku
zmiany w odcinku
udowo-podkolanowym
zmiany w odcinku
aortalno-biodrowym
niepełny efekt
techniczny zabiegu
Rycina 14. Algorytm postępowania z chorym z chromaniem przestankowym.
Tabela IX. Normy lipidów w surowicy
Poziom w surowicy
mg/dL mmol/l
Komentarz
< 200 < 5,2 poziom zalecany
200-240 5,2-6,3 poziom graniczny
> 240 > 6,3 poziom wysoki, ryzyko zwiększone
Cholesterol całkowity
< 100 < 2,6 poziom optymalny
100-129 2,6 - 3,3 poziom nieznacznie podwyższony
130-159 3,4 - 4,0 poziom graniczny, ryzyko zwiększone
160-190 4,1 - 4,9 poziom wysoki, ryzyko zwiększone umiarkowanie
> 190 > 4,9 poziom bardzo wysoki, znaczne ryzyko
Cholesterol - LDL
< 40 < 1,1 poziom niski, ryzyko zwiększone
> 60 > 1,6 poziom wysoki
Cholesterol - HDL
< 150 < 1,7 poziom zalecany
150-200 1,7 - 2,3 poziom graniczny, ryzyko zwiększone
200-500 2,3 - 5,7 poziom wysoki, ryzyko zwiększone umiarkowanie
> 500 > 5,7 poziom bardzo wysoki, znaczne ryzyko
Trójglicerydy
BMI
Norma 18,5 - 25
Nadwaga > 25
Łagodna otyłość 27 - 30
Otyłość średniego stopnia 31 - 35
Otyłość patologiczna > 35
Tabela Xa. Normy należnej wagi ciała w oparciu o BMI (Body Mass Index).
BMI = masa ciała / wzrost2
[BMI = kg / m2]
28 29
Chorzy z zaawansowanym niedokrwieniem kończyn dolnych, zagrażającym
żywotności kończyny powinni być kwalifikowani do leczenia
zabiegowego. W szczególnych przypadkach, kiedy niemożliwe jest leczenie
operacyjne, należy wdrożyć leczenie zachowawcze, ale jego skuteczność jest
kwestionowana przez większość autorów. Wielotygodniowe dożylne podawanie
prostanoidów, np. prostaglandyny E1 lub bardziej stabilnych analogów
prostacykliny, np. iloprostu, wpływa na zmniejszenie bólów spoczynkowych,
a także wygojenie części owrzodzeń stopy.
Wielce obiecujące są wyniki badań nad genetycznie indukowaną angiogenezą
z wykorzystaniem czynnika wzrostu śródbłonka naczyniowego, która
prowadzi do relatywnie szybkiego wytworzenia nowych naczyń krążenia
obocznego potwierdzonego w badaniach angiograficznych [34]. W efekcie
osiągnięto poprawę indeksu kostkowo-ramiennego, ustąpienie bólów
spoczynkowych i wygojenie owrzodzeń w krytycznie niedokrwionej kończynie
[3]. Niedawno wyjaśniono mechanizm wpływu statyn na angiogenezę. Leki
z tej grupy powodują translokację kinazy B, głównego białka przekaźnikowego
w procesie tworzenia naczyń, do struktur błonowych cholesterolowrażliwych
w aktywowanych komórkach śródbłonka. Wpływ statyn na angiogenezę
jest istotną składową zarówno ich ochronnego działania na serce, jak i na
naczynia krwionośne.
Do nowych odkryć należy to, iż [20]:
1. statyny hamują neowaskularyzację przydanki;
2. statyny nasilają tworzenie krążenia obocznego pod wpływem niedokrwienia;
3. statyny wydają się mieć dwufazowy wpływ na angiogenezę;
4. statyny mogą hamować angiogenezę w obrębie guza nowotworowego.
b. Przezskórna angioplastyka
Przezskórne, małoinwazyjne zabiegi wewnątrznaczyniowe w celu leczenia
zmian niedokrwiennych w kończynie dolnej zostały zapoczątkowane w 1964
roku przez Dottera i Judkinsa [44]. Po latach stosowania stały się, w wielu
przypadkach, alternatywą dla leczenia metodami tradycyjnymi - za pomocą
przeszczepów omijających lub trombendarterektomii (Tabela XI). Mimo
olbrzymiego postępu, jaki dokonał się w technikach endowaskularnych,
leczenie chirurgiczne pozostaje nadal metodą, za pomocą której osiąga się
znacznie lepsze wyniki odległe. Zwolennicy techniki małoinwazyjnej wskazują
jednak na dwie podstawowe zalety, które decydują o stale rosnącym
U każdego chorego z A.O. należy wykonać podstawowe badnia hematologiczne
i biochemiczne, a w tym m.in.: oznaczyć liczbę płytek krwi, poziom
glukozy na czczo, poziom hemoglobiny glikozylowej A1c, mocznik i kreatyninę
w surowicy, profil lipidów na czczo oraz badanie ogólne moczu. U młodych
pacjentów z przyspieszoną miażdżycą oraz u tych chorych, u których dochodzi
do nawrotów zakrzepicy przeszczepu naczyniowego, należy rozszerzyć
profil badań o diagnostykę w kierunku hyperhomocysteinemii oraz zespołu
antyfosfolipidowego. Wszyscy chorzy powinni zaprzestać palenia tytoniu,
a także rozpocząć regularne ćwiczenia fizyczne mające na celu pobudzenie
wytworzenia krążenia obocznego w kończynach dolnych. Dla pacjentów
ze zmianami w odcinku aortalno-udowym zalecane jest chodzenie po schodach
i/lub jazda na rowerze, natomiast dla chorych ze zmianami w odcinku
udowo-podkolanowym - trening marszowy. Sam trening fizyczny może
doprowadzić do dwu- lub trzykrotnego wydłużenia wyjściowego dystansu
chromania przestankowego [32, 44, 57, 58].
a. Leczenie farmakologiczne
Sposób postępowania jest uzależniony od stopnia zaawansowania
A.O. Zmiany miażdżycowe u chorych z I stopniem niedokrwienia kończyn
dolnych wg Fontaine'a należy traktować jako objaw uogólnionej miażdżycy
i dlatego należy podjąć profilaktyczne działania chroniące przed powikłaniami
sercowo-naczyniowymi, tzn. przed zawałem mięśnia sercowego i/lub udarem
mózgu. U chorych z II stopniem niedokrwienia wg Fontaine'a farmakoterapia
powinna być uzupełnieniem intensywnej rehabilitacji ruchowej. W przewlekłym
niedokrwieniu kończyn dolnych stosowanych jest wiele preparatów.
Jednym z nich jest pentoksyfilina znana ze swej zdolności do zmiany kształtu
krwinki czerwonej, obniżenia poziomu fibrynogenu i niewielkiego wpływu
antyagregacyjnego na płytki krwi. Wiele badań klinicznych wykazało jednak
tylko niewiele wyższą skuteczność pentoksyfiliny od placebo [44]. Wg wielu
autorów, przewlekłe stosowanie naftidrofurylu - antagonisty serotoniny, czy
buflomedilu - preparatu 1 i 2 adrenolitycznego, spowodowało wydłużenie
dystansu chromania u części chorych z A.O. Jedynie cilostazol, inhibitor
fosfodiesterazy o właściwościach antyagregacyjnych i wazodilatacyjnych,
daje szansę na wyraźną poprawę odległych wyników leczenia farmakologicznego
[5, 25, 32, 58]. Wieloośrodkowe wyniki randomizowanych badań,
prowadzonych metodą podwójnie ślepej próby wykazały, że cilostazol powoduje
wyraźne wydłużenie dystansu chromania oraz poprawę jakości życia
pacjentów z A.O.
30 31
c. Leczenie chirurgiczne
Chirurgiczna rewaskularyzacja jest niekwestionowanym i najlepszym
znanym sposobem leczenia krytycznego niedokrwienia kończyn dolnych
spowodowanego nasilonymi i rozległymi zmianami miażdżycowymi
w tętnicach. U pacjentów, u których jedynym objawem choroby jest chromanie
przestankowe, a ryzyko utraty kończyny dolnej jest niskie, zwykle
nie ma wskazań do interwencji chirurgicznej. Tylko w tych sytuacjach,
w których objawy niedokrwienia kończyny w istotny sposób ograniczają
sprawność chorego i stanowią poważną przeszkodę w jego codziennym
życiu, korzyści leczenia chirurgicznego przewyższają podjęte ryzyko
operacyjne i uzasadniają interwencję chirurga naczyniowego. Ma on
do dyspozycji dwa zasadnicze typy operacji: trombendarterektomię i
omijające przeszczepy naczyniowe. Trombendarterektomia najczęściej
wykonywana jest przy ograniczonych zmianach obejmujących
odcinek aortalno-udowy. Nasilone zmiany w tym odcinku są wskazaniem
do wykonania przeszczepu omijającego, który rokuje zdecydowanie
lepszym wskaźnikiem drożności, a w konsekwencji wyższym wskaźnikiem
uratowania kończyny. Tradycyjnym materiałem wykorzystywanym
do rekonstrukcji w odcinku aortalno-udowym jest dakronowa proteza
naczyniowa jednostronna lub rozwidlona. Wyniki rekonstrukcji
w odcinku udowo-podkolanowym są nieco gorsze niż w odcinku
aortalno-udowym (Tabela XII). Preferowanym sposobem rekonstrukcji
w odcinku udowo-podkolanowym jest przeszczep udowo-podkolanowy,
najlepiej z autogennej żyły odpiszczelowej. Zastosowanie przeszczepów
syntetycznych w tym odcinku daje pozytywne wyniki pod warunkiem, że
obwodowe zespolenie nie przekracza poziomu szpary stawu-kolanowego
[44]. Według wielu autorów wskaźnik drożności żylnego przeszczepu
udowo-podkolanowego po 5 latach wynosi około 70-80% nawet w przypadkach,
kiedy zespolenie obwodowe zostanie wykonane poniżej szpary
stawu kolanowego lub jeszcze bardziej obwodowo oraz bez względu
na to, czy będzie to żyła odwrócona, czy pozostawiona in situ.
Zdecydowana większość autorów wskazuje na potrzebę stosowania
profilaktyki przeciwzakrzepowej u pacjentów po wykonanej rekonstrukcji
naczyniowej ze względu na czynniki ryzyka zakrzepicy związane zarówno
z postępem miażdżycy, jak i ze zmianami zachodzącymi w świetle przeszczepu
i w miejscach zespoleń naczyniowych (Rycina 15). Prowadzone w
Danii badania ujawniły, że przewlekłe podawanie doustnych antkoagulantów
poprawia odległe wyniki przeszczepów żylnych, natomiast kwas acetylosalicylowy
poprawia wyniki przeszczepów syntetycznych [44].
zainteresowaniu tą metodą leczenia - 1/ na krótszy czas trwania zabiegu
w stosunku do operacji tradycyjnej, co prowadzi do zmniejszenia liczby
powikłań i chorobowości, a także 2/ na możliwość powtarzania zabiegów
wewnątrznaczyniowych w przypadku pierwotnego niepowodzenia (dodatkowym
atutem jest to, że w przypadku niepowodzenia, tylko w wyjątkowych
przypadkach dochodzi do pogorszenia stanu klinicznego).
Autorzy podają, iż w przypadku angioplastyki balonowej tętnic biodrowych
z następowym wprowadzeniem w to miejsce stentu, wczesna śmiertelność
(30 dni) nie przekracza 1%. Wskaźnik drożności po 1 roku i 3 latach od takiej
angioplastyki waha się w zależności od stopnia zaawansowania miażdżycy
w tym odcinku odpowiednio od 68% (przy odcinkowej niedrożności tętnicy
biodrowej) do 97% (przy krótkim zwężeniu tętnicy biodrowej) oraz od 62%
(przy odcinkowej niedrożności tętnicy biodrowej) do 86% (przy krótkim
zwężeniu tętnicy biodrowej) [44, 58].
Gorsze wyniki uzyskuje się po angioplastyce w odcinku udowo-podkolanowym
- wskaźnik drożności po 3 latach zwykle nie przekracza 60%
(Tabela XII). Porównanie danych prezentowanych przez różnych autorów
wskazuje na przewagę metod chirurgicznych w odniesieniu do skuteczności
metody i odległych wyników drożności, natomiast na przewagę metod
wewnątrznaczyniowych nad chirurgicznymi w przypadku oceny powikłań
i chorobowości.
Tak Nie
zwężenie pełna niedrożność
ściana bez zwapnień zmiana na długim odcinku (≥ 5 cm)
zmiana na krótkim odcinku ( 3 cm) tętniak aorty i/lub tętnicy biodrowej
na podudziu drożne dwie lub trzy tętnice zatorowość tętnic obwodowych
chory bez cukrzycy obustronne rozsiane zmiany
Tabela XI. Wskazania do leczenia wewnątrznaczyniowego (PTA - Percutaneous Transluminal
Angioplasty) zmian miażdżycowych w tętnicach biodrowych.
32 33
III. Statyny
1. Budowa statyn
Statyny należą do stosunkowo nowej grupy leków, stosowanych w zaburzeniach
przemiany lipidów, głównie cholesterolu. Statyny zostały odkryte przez
Endo i Kuroda w 1973 roku w trakcie prowadzonych badań nad metabolitami
drobnoustrojów, które wybiórczo hamują reduktazę 3-hydroksy-3-metylo-
-glutarylo-koenzymu A (HMG-CoA), tj. enzymu uczestniczącego w syntezie
cholesterolu. Pierwszym związkiem z tej grupy, wyizolowanym z grzybów
Aspergillus terreus i Monascus ruber, wprowadzonym do lecznictwa w 1989
roku była lowastatyna. W ciągu kilku następnych lat uzyskano nowe półsyntetyczne
pochodne tego związku.
Obecnie w lecznictwie znanych jest sześć statyn (Rycina 16):
statyny pierwszej generacji (pochodzenia naturalnego)
lowastatyna
prawastatyna
symwastatyna (półsyntetyczna)
statyny drugiej generacji (synetyczne, w postaci racematu)
fluwastatyna
statyny trzeciej generacji (syntetyczne, enancjomery)
ceriwastatyna
atorwastatyna
Od sierpnia 2001 roku ceriwastatyna nie ma zastosowania klinicznego ze
względu na przypadki ciężkiej rabdomiolizy, które powodowała [13].
Odcinek
Angioplastyka przezskórna Leczenie chirurgiczne
aortalno-biodrowy 68-97% 62-86% 54-65%
1 rok
Wskaźniki drożności
3 lata 5 lat 1 rok 3 lata 5 lat
90-95% 82-88% 74-90%
udowo-podkolanowy 70-75% 54-65% 41-60% 80-87% 65-75% 55-70%
Tabela XII. Porównanie średnich wskaźników pierwotnej drożności tętnicy po przezskórnej
angioplastyce balonowej ze wskaźnikami drożności przeszczepów naczyniowych
w analogicznych odcinkach tętnic kończyn dolnych dla chorych z I-IV
stopniem niedokrwienia wg Fonataine'a (na podstawie danych K. Ouriela [44],
2nd European Consensus Document on Critical Leg Ischemia, 1991 [22] oraz
danych własnych [43]).
Postęp miażdżycy
Zmiany strukturalne w przeszczepie sztucznym
Zmiany strukturalne w przeszczepie żylnym
Hiperlazja śródbłonka
Niewystarczający napływ / niewystarczający odpływ krwi
Trombogenność przeszczepu naczyniowego
Technika operacyjna
Wczesny
okres
Odległy
okres
Czynniki
Operacja
naczyniowa
30 dni
18 miesięcy 5 lat
Czas po operacji rekonstrukcyjnej
Rycina 15. Wpływ różnych czynników w czasie na drożność przeszczepu naczyniowego*
(wg R.B. Rutheforda [53]).
* kolorem ciemnoniebieskim oznaczono stopień ryzyka
zakrzepicy przeszczepu naczyniowego
34 35
Poza wpływem na metabolizm cholesterolu, statyny odgrywają istotną rolę
także w innych procesach zachodzących m.in. w śródbłonku naczyniowym.
Metabolizm mewalonianu dostarcza produktów pośrednich w postaci izoprenoidów,
a one z kolei odgrywają kluczową rolę w potranslacyjnej modyfikacji
białek G, polegającej na tzw. prenylacji, tj. na przyłączeniu do tych białek
cząsteczki farnezylu lub geranylogeranylu (Rycina 17). Tak zmodyfikowane
białko G pozwala na translokację oraz wytworzenie wiązania kowalencyjnego
białka G z błoną komórkową, co jest niezbędnym procesem do prawidłowego
funkcjonowania komórki. Jednym z lepiej poznanych białek G jest odmiana
Rho, która odpowiada za właściwą funkcję struktur komórkowych. Dzięki
temu białka G mają wpływ m.in. na komórki śródbłonka, kurczliwość komórek
mięśni gładkich naczynia, aktywację płytek krwi, migrację leukocytów, adhezję
komórek [20, 38]. Zatem statyny, poprzez hamowanie aktywacji białek G,
w zasadniczy sposób mogą regulować homeostazę naczyń krwionośnych.
Najnowsze badania dowiodły, że aktywowane lipoproteiny LDL (ox-LDL) są
silnymi inhibitorami śródbłonkowej syntezy tlenku azotu (eNOS). Pobudzają
również aktywność czynnika jądrowego -B (NF kappa-B) odpowiedzialnego
za transkrypcję cytokin. Ponieważ statyny obniżają poziom LDL i hamują ich
oksydację (aktywację), modyfikują w ten sposób aktywność NF-B, a dzięki
temu w znacznym stopniu ograniczają ekspresję wielu cytokin biorących
udział w procesach zapalnych. Aktywność antyoksydacyjna statyn nie tylko
ogranicza wczesne uszkodzenie naczynia, ale także wpływa na progresję
zmian miażdżycowych, zapobiegając dalszemu tworzeniu komórek piankowatych
i stałemu uszkadzaniu śródbłonka między innymi przez wolne rodniki
tlenowe [20, 38, 45].
Wykazano ponadto, iż statyny wpływają na osłabienie interakcji pomiędzy
cząsteczkami adhezyjnymi i monocytami na powierzchni śródbłonka, co
prowadzi do zmniejszenia infiltracji śródbłonka przez monocyty i neutrofile.
Takie silne działanie przeciwzapalne statyn skutkuje m.in. znaczącym obniżeniem
poziomu białka C-reaktywnego (CRP). Statyny nie tylko zmniejszają
stężenie markerów stanu zapalnego w surowicy, ale mają także własne
działanie przeciwzapalne, które jest niezależne od ich wpływu na syntezę
cholesterolu. Wykazano, że statyny działają przeciwzapalnie in vitro i in vivo
wiążąc się z integrynowym miejscem regulatorowym oddziałującym ze statynami
[20].
Innym, dobrze znanym efektem działania statyn jest ich wpływ na aktywację
kinazy białkowej (aktywatora syntazy eNO), a także hamujący wpływ
na działanie endoteliny-1 (ET-1), głównej substancji kurczącej naczynia
krwionośne. Statyny zmniejszają również mobilizację jonów Ca2+ oraz odpowiedź
komórek mięśni gładkich na angiotensynę II [20, 38].
CH3
H3C
O
O
O
HO
O
CH3
HO
COONa
O
O
HO
OH
CH3
O
O
HO
H3C
H3C
O
O
O
CO2 -
HN
N
F
HO
HO
N
F
HO
HO COONa
F
CH3
CH3 CH3
CH3
CH3OCH2
N
HO H H OH
COONa
Atorwastatyna Ceriwastatyna Fluwastatyna
Symwastatyna Prawastatyna Lowastatyna
Rycina 16. Rodzaje i budowa statyn.
2. Mechanizm działania
Źródłem cholesterolu dla komórki jest jego synteza de novo, albo wychwyt
za pośrednictwem receptorów dla LDL po degradacji lipoprotein surowicy.
Napływ cholesterolu do komórki uruchamia mechanizm zwrotny hamujący
wewnątrzkomórkową syntezę cholesterolu oraz zmniejszający ekspresję
receptorów dla LDL. Statyny hamują kompetycyjnie reduktazę HMG-CoA
i w ten sposób zmniejszają syntezę cholesterolu. Zahamowanie syntezy
cholesterolu i zmniejszenie jego poziomu w komórce prowadzi do aktywacji
transkrypcji receptorów LDL i wzmożonego wychwytu lipidów oraz do
obniżenia poziomu lipidów w surowicy [38]. Ponieważ synteza cholesterolu
zachodzi w znacznej mierze w nocy, stąd zaleca się podawanie statyn
w czasie kolacji.
36 37
Wymienione powyżej własności statyn sprawiły, że ta grupa leków znajduje
coraz szersze zastosowanie kliniczne i jest systematycznie wprowadzana
jako standard postępowania terapeutycznego lub profilaktycznego w wielu
dziedzinach medycyny. Początkowo była to kardiologia, później zaczęto
stosować statyny u chorych neurologicznych. W badaniu 4S (the Scandinavian
Simvastatin Survival Study), które przeprowadzono na grupie 4444
pacjentów wykazano bowiem, że podawanie symwastatyny w dawce 20-40
mg/dobę średnio przez 5,4 roku u chorych z przewlekłą chorobą wieńcową
w sposób istotny, bo o 48%, zmniejszyło ryzyko występowania szmerów
naczyniowych w tętnicach szyjnych (Rycina 18), a o 19-31% zmniejszyło
ryzyko udaru mózgu (trzeciej przyczyny zgonów w USA) [38, 47, 48].
0
0,5
1,0
1,5
2,0
2,5
0 1 2 3 4 5 6
Odsetek pacjentów (%)
Lata
p<0,008
RR=0,62
placebo n=2223
symwastatyna n=2223
Rycina 18. Przewlekłe podawanie symwastatyny zmniejsza o 48% ryzyko wystąpienia
szmeru naczyniowego w tętnicach szyjnych; relatywne ryzyko (RR) obliczono
za pomocą metody regresji wg Coxa (wg Pedersen i wsp. [47]).
Na podstawie tych samych badań wykazano, że u pacjentów o 38%
zmniejszyło się ryzyko wystąpienia chromania przestankowego lub ryzyko
pogorszenia już istniejących objawów niedokrwienia kończyn dolnych
(Rycina 19).
W świetle obecnego stanu wiedzy, migracja i proliferacja komórek mięśni
gładkich tętnicy jest stałym etapem rozwoju blaszki miażdżycowej w A.O.,
hiperplazji neointimy, restenozy po przezskórnych zabiegach angioplastyki
oraz rozwoju zmian miażdżycowych w przeszczepach narządowych. Nasilona
proteoliza włókien kolagenowych otoczki rdzenia lipidowego blaszki
miażdżycowej sprzyja pęknięciom na powierzchni otoczki i rozwojowi tzw.
blaszki niestabilnej. Udowodniono, że statyny redukują ekspresję metaloproteinaz,
przez co prowadzą do wzrostu zawartości włókien kolagenowych
w otoczce i blaszce miażdżycowej oraz hamują zarówno migrację, jak i
proliferację komórek mięśni gładkich naczyń krwionośnych. Wszystko to
powoduje większą stabilizację blaszki miażdżycowej.
Hipercholesterolemia jest stanem sprzyjającym nadkrzepliwości, m.in.
poprzez aktywację płytek krwi i osłabienie aktywności fibrynolitycznej.
Statyny zmniejszają aktywność płytkową poprzez nasilenie syntezy eNO oraz
zahamowanie ekspresji makrofagów. Ponadto statyny zwiększając poziom
ekspresji tkankowego aktywatora plazminogenu (t-PA) i jednocześnie obniżając
aktywność inhibitora-1 aktywatora plazminogenu (PAI-1), zwiększają
potencjał fibrynolityczny komórek śródbłonka w czasie, gdy dochodzi do
pękania otoczki wokół rdzenia lipidowego [20, 38].
Acetylo-Co A
HMG-Co A
Kwas mewalonowy
IPP
DPP
GPP
FPP
Skwalen (C30)
Cholesterol
izoprenoidy
Białka G
Molekuły adhezyjne
Proliferacja komórki
Reduktaza HMG-Co A
HMG-Co A - 3-hydroksy-3-metylo-glutarylo-koenzym A
IPP - pirofosforan izopentenylu (C5)
DPP - pirofosforan dwumetyloallilu (C5)
GPP - pirofosforan geranylu (C10)
FPP - pirofosforan farnezylu (C15)
STATYNY
(-)
Rycina 17. Schemat biosyntezy cholesterolu i miejsce działania statyn.
38 39
IV. Rola statyn w miażdżycowym niedokrwieniu kończyn dolnych
Zalety statyn w leczeniu choroby niedokrwiennej serca zostały udokumentowane
w wielu programach badawczych i klinicznych. Dotyczy to zarówno
pierwotnej, jak i wtórnej profilaktyki. Podawanie statyn obniża poziom cholesterolu
LDL o 30-40%, a śmiertelność o 25-30%. Jednocześnie podwyższają
poziom HDL cholesterolu o około 10%. Nie do końca poznany został mechanizm,
w jaki do tego dochodzi [14].
Istotne przesłanki pochodzące z badań doświadczalnych na zwierzętach
przemawiają za tym, iż statyny spowalniają postęp miażdżycy i stabilizują
blaszki miażdżycowe. Ostatnio prowadzone za pomocą angiografii badania
wykazały cechy spowolnienia, a nawet regresję istniejących zmian także
u ludzi [20].
Badania pośmiertne wykazały, iż skład blaszki miażdżycowej ma
większy wpływ na toksyczność blaszki, niż stopień zwężenia, jaki ona
powoduje [14, 23]. Powstawanie zmian na powierzchni blaszki miażdżycowej
(najczęściej pęknięcie) zwykle inicjuje nagły początek objawów
klinicznych z układu sercowo-naczyniowego. Badania dowiodły, iż blaszki
bogate w lipidy łatwiej ulegały zmianom na ich powierzchni, niż blaszki
prowadzące do nasilonego zwężenia tętnicy. Takie bogate w lipidy blaszki
są niezwykle trombogenne. Badania angiograficzne prowadzone w celu
oceny wpływu obniżenia poziomu lipidów na zmiany miażdżycowe w ścianie
tętnic wykazały wyraźną zależność pomiędzy stosowaniem statyn obniżających
poziom lipidów a spowolnieniem progresji zmian prowadzących do
zwężenia światła tętnicy wieńcowej i zmniejszeniem częstości występowania
objawów klinicznych choroby niedokrwiennej serca. To sugeruje, iż
statyny mogą prowadzić do regresji i/lub stabilizacji blaszki miażdżycowej
bogatej w lipidy. Pozytywny wpływ statyn został potwierdzony w tętnicach
wieńcowych i szyjnych.
Podejmowane są badania mające na celu wykazanie wpływu statyn
na stabilność blaszki miażdżycowej w innych okolicach, np. aorcie oraz
poszukiwane są sposoby monitorowania stabilności takiej blaszki [14].
Wykorzystując rezonans magnetyczny wysokiej rozdzielczości stwierdzono
0 1 2 3 4 5 6
0
0,5
1,0
1,5
2,0
2,5
3,0
3,5
4,0
4,5
Odsetek pacjentów (%)
Lata
placebo n=2223
symwastatyna n=2223
p<0,008
RR=0,62
Rycina 19. Przewlekłe podawanie symwastatyny zmniejsza o 38% ryzyko wystąpienia
chromania przestankowego lub jego nasilenia; relatywne ryzyko (RR) obliczono
za pomocą metody regresji wg Coxa (wg Pedersen i wsp. [47])
Szereg obecnie prowadzonych prac badawczych nad zastosowaniem
statyn obejmuje między innymi chorych z miażdżycowym niedokrwieniem
kończyn dolnych i pacjentów po transplantacjach narządowych. W tych
ostatnich wykazano m.in., że statyny mają wpływ na proces odrzucania
przeszczepu serca lub nerki poprzez hamowanie aktywności limfocytów T i B,
obniżenie częstości ostrego odrzucania, ograniczenie postępu waskulopatii
przeszczepu oraz zmniejszenie cytotoksyczności komórek typu natural killer.
Wykazano również, że statyny mogą sprzyjać przekształcaniu limfocytów T
w przeciwzapalne limfocyty Th2 i zmniejszać przekształcanie w pozapalne
limfocyty pomocnicze Th1. Mogą więc działać na zapalną składową reakcji
immunologicznej. Może to mieć z kolei wpływ na patologie naczyniowe
w przeszczepionych narządach, a przez to na przeżycie chorych po przeszczepieniu,
zmiany miażdżycowe i/lub autoimmunologiczne uszkodzenia
narządów [20, 35, 38].
40 41
Mondillo i wsp. [41] przeprowadzili randomizowane badania metodą
podwójnie ślepej próby w celu oceny wpływu symwastatyny w dawce 40
mg/dobę na dystans chromania przestankowego u chorych z hipercholesterolemią
(>220 mg/dL). U chorych oceniano podstawowe parametry
biochemiczne surowicy krwi, indeks kostkowo-ramienny, dystans chromania
przestankowego, a także subiektywne testy samooceny pacjenta
(w skali 0-10 punktów) w momencie rozpoczęcia badania, a następnie po
3 i 6 miesiącach stosowania symwastatyny lub placebo. Grupy chorych
otrzymujących symwastatynę (n=43) lub palcebo (n=43) były porównywalne
pod względem danych demograficznych, parametrów biochemicznych krwi,
czynników ryzyka, dystansu chromania, indeksu kostkowo-ramiennego.
Zgodnie z oczekiwaniami, po 3 i 6 miesiącach symwastatyna obniżyła
poziom cholesterolu całkowitego oraz frakcji cholesterolu LDL w stosunku do
grupy pacjentów przyjmujących placebo (p<0,01) oraz w stosunku do wartości
wyjściowych w grupie pacjentów przyjmujących symwastatynę (p<0,01). Nie
zaobserwowano zmian w poziomie frakcji HDL i trójglicerydów (Tabela XIII).
Parametry
Początek badania Po 3 miesiącach Po 6 miesiącach
Cholesterol
całkowity (mg/dL)
symwastatyna
n=43
placebo
n=43
symwastatyna
n=43
placebo
n=43
symwastatyna
n=43
placebo
n=43
260 28 260 26 203 32*# 256 29 205 31*# 262 30
LDL hholesterol
(mg/dL)
189 32 188 34 127 31*# 179 38 124 29*# 191 36
HDL hholesterol
(mg/dL)
39 5 38 7 41 7 36 7 40 7 36 7
Trójglicerydy
(mg/dL)
173 19 182 27 163 23 176 25 160 29 169 29
Tabela XIII. Zmiany w lipidogramie u chorych przyjmujących symwastatynę i placebo (wg Mondillo
i wsp. [41]).
Wartości średnie SD
* p<0.01 symwastatyna vs placebo
# p<0.01 symwastatyna po 3 i 6 miesiącach vs symwastatyna - początek badania
Badania po 6 miesiącach wykazały, iż w grupie pacjentów przyjmujących
symwastatynę dystans chromania uległ wydłużeniu zarówno w stosunku do
chorych przyjmujących placebo, jak i w stosunku do wartości wyjściowych
zmniejszenie się rdzenia lipidowego i przebudowę tętnic szyjnych oraz aorty
brzusznej w wyniku terapii statynami prowadzonej przez dwa lata [15]. Crisby
i wsp. porównując materiał pobrany w trakcie trombendarterektomii tętnic
szyjnych od pacjentów stosujących wcześniej przez 3 miesiące prawastatynę
i od nieleczonych statyną stwierdził, że w wyniku leczenia nastąpiły zmiany
wskazujące na stabilizację blaszki [17].
Obiecujące wyniki uzyskano także w innym badaniu z zastosowaniem
techniki rezonansu magnetycznego. Badania MRI prowadzone in vivo u ludzi
wykazały, że po półrocznym podawaniu statyn nie obserwowano zmian
wielkości blaszki miażdżycowej pomimo wyraźnego obniżenia poziomu
cholesterolu całkowitego i frakcji LDL. Dopiero podawanie statyn przez okres
nie krótszy niż jeden rok spowodowało zmniejszenie wymiaru blaszki miażdżycowej
oraz pola powierzchni przekroju ściany naczynia [14]. Część autorów
nie obserwowała wyraźnego wpływu przewlekłego podawania statyn na pole
przekroju światła tętnicy. Wiadomo, iż objawy kliniczne są najczęściej wynikiem
zmian miażdżycowych zwężających światło tętnicy w stopniu łagodnym
lub średnim. Właśnie te zmiany mają właściwość nagłej, dynamicznej przemiany,
której rezultatem jest wystąpienie objawów klinicznych niedokrwienia.
Wykazano, że nawet morfologicznie niewielkie zmiany wsteczne w obrębie
blaszki miażdżycowej przekładają się na wyraźne zmiany w strukturze
biochemicznej takiej blaszki (ulega ona stabilizacji) [14, 17]. Udowodniono
mianowicie, iż długotrwałe podawanie statyny u pacjentów ze stwierdzoną
blaszką miażdżycową w tętnicy szyjnej zmniejsza zawartość lipidów, utlenowanej
frakcji LDL oraz metaloproteinaz, zmniejsza częstość apoptozy, liczbę
makrofagów, a zwiększa za to zawartość kolagenu w macierzy tej blaszki
miażdżycowej [17].
1. Wpływ symwastatyny na chromanie przestankowe
Chromanie przestankowe dotyczy od 2,2% do 5,8% ogólnej populacji ludzi,
a jego częstość nasila się wraz z wiekiem, zwłaszcza wśród palaczy tytoniu
[41]. Dystans chromania można wydłużyć poprzez zmniejszenie wagi ciała,
ćwiczenia fizyczne, zaprzestanie palenia tytoniu oraz poprzez wdrożenie
farmakoterapii. Efekt terapii powodującej obniżenie poziomu cholesterolu
na wydłużenie dystansu chromania nie jest jednoznaczny. Jednak według
opublikowanych ostatnio danych, symwastatyna zmniejsza częstość objawów
zarówno dławicy piersiowej (dusznicy bolesnej), jak i ryzyko wystąpienia
chromania przestankowego lub skrócenia dystansu chromania.
42 43
2
4
6
8
10
Natężenie bólu kończyny dolnej (punkty)
po 3 miesiącach po 6 miesiącach początek leczenia
symwastatyna
placebo
p<0,005 w stosunku do wartości początkowych
p<0,005 w stosunku do placebo.
p<0,001 w stosunku do wartości początkowych
p<0,05 w stosunku do wartości po 3 miesiącach
Rycina 21. Wpływ symwastatyny i placebo na intensywność bólu o typie chromania prze-
stankowego w kończynach dolnych po 3 i 6 miesiącach leczenia; wykres ram-
kowy ilustruje rozstęp kwartylny, poziomy odcinek - mediana (wg Mondillo
i wsp. [41]).
2
4
6
8
10
Czas odpoczynku po wystapieniu bólu
w kończynie(punkty)
po 3 miesiącach po 6 miesiącach początek leczenia
symwastatyna
placebo
p<0,005 w stosunku do wartości początkowych
p<0,005 w stosunku do placebo
Rycina 22. Wpływ symwastatyny i placebo na długość koniecznego odpoczynku po
wystąpieniu bólu o typie chromania przestankowego po 3 i 6 miesiącach
leczenia; wykres ramkowy ilustruje rozstęp kwartylny, poziomy odcinek -
mediana (wg Mondillo i wsp. [41]).
w obrębie własnej grupy (średnio o 126 metrów; p<0,001). Analogiczną
zależność w obu grupach pacjentów wykazała analiza wartości indeksów
kostkowo-ramiennych oraz analiza wyników testów dotyczących wystąpienia
subiektywnych objawów chorobowych (dystans wolny od bólu kończyny,
nasilenie bólu kończyny, czas koniecznego odpoczynku po wystąpieniu
bólu, ograniczenie wydolności fizycznej pacjenta wynikającej z niedokrwienia
kończyn dolnych) (Ryciny 20-23).
0
2
4
6
8
10
Dystans chromania (punkty)
po 3 miesiącach po 6 miesiącach początek leczenia
symwastatyna
placebo
p<0,005 w stosunku do wartości początkowych
p<0,005 w stosunku do placebo
Rycina 20. Wpływ symwastatyny i placebo na dystans chromania po 3 i 6 miesiącach
leczenia; dystans określono wg punktacji: 0 pkt. - dystans poniżej 10 metrów,
10 pkt. - dystans powyżej 500 metrów; wykres ramkowy ilustruje rozstęp
kwartylny, poziomy odcinek - mediana (wg Mondillo i wsp. [41]).
44 45
Grupa
Chorych
Czas wystąpienia bólu kończyny dolnej
po rozpoczęciu marszu (sekundy)
Symwastatyna 225 36 279 38 320 34
231 41 238 37 221 36
Wartości wyjściowe Po 6 miesiącach Po 12 miesiącach
Placebo
Tabela XIV. Wpływ symwastatyny i placebo na czas wystąpienia bólu o typie chromania przestankowego
(wg Arnow i wsp. [2]).
Po 6 miesiącach: p<0,0001 symwastatyna vs placebo
Po 12 miesiącach:p<0,0001 symwastatyna vs placebo
Dotychczas wykazano wyraźne działanie hypolipemizujące statyn, co
w konsekwencji prowadzi do zmniejszenia zdarzeń sercowo-naczyniowych.
Ponieważ zaobserwowano jedynie umiarkowany wpływ statyn na zmniejszenie
rozmiarów blaszki miażdżycowej, wydaje się, że to inne czynniki,
stymulowane przez statyny, mają bezpośredni wpływ na poprawę wyników
klinicznych. Wydaje się, iż efekt ten wywołują statyny poprzez stabilizację
blaszki miażdżycowej, zahamowanie aktywności komórek odpowiedzi
zapalnej, płytek krwi, trombogenezy oraz poprzez poprawę funkcji śródbłonka
naczyniowego [41].
Należy również przytoczyć wyniki zakończonych w 2000 roku wieloośrodkowych
badań prowadzonych metodą podwójnie ślepej próby, oceniających
miejsce atorwastatyny w leczeniu chorych z przewlekłym niedokrwieniem
kończyn dolnych [40]. Do badania włączono 354 chorych, randomizowanych
do trzech grup: grupa pierwsza (n=120) otrzymywała atorwastatynę w dawce
10 mg/dobę, grupa druga (n=120) otrzymywała atorwastatynę w dawce 80
mg/dobę, grupa trzecia (n=114) otrzymywała placebo. Stosowanie atorwastatyny
przez 12 miesięcy u chorych z chromaniem przestankowym nie wpłynęło
istotnie na maksymalny czas chodzenia - MWT (tj. do chwili, kiedy z powodu
natężenia bólu chory musiał się zatrzymać; MWT - Maximal Walking Time),
natomiast zwiększyło w sposób statystycznie znamienny (p=0,011) aktywność
fizyczną mierzoną za pomocą kwestionariusza LOPAR, oceniającego
tygodniowy wydatek energetyczny chorego (LOPAR - Low Level Physical
Activity Recall). Ponadto, stosowanie atorwastatyny w dawce 80 mg/dobę
wydłużyło czas chodzenia bez bólu PFWT (PFWT- Pain-Free Walking Time)
w porównaniu z grupą placebo o 81 ± 15 sekund vs 39 ± 8 sekund (p=0,025).
Odpowiadało to wydłużeniu czasu chodzenia odpowiednio o 63% vs 38%
w stosunku do wartości wyjściowych [40].
2
4
6
8
10
Ograniczenie wydolności fizycznej (punkty)
po 3 miesiącach po 6 miesiącach początek leczenia
p<0,005 w stosunku do placebo
p<0,001 w stosunku do wartości początkowych
p<0,05 w stosunku do wartości po 3 miesiącach
Rycina 23. Wpływ symwastatyny i placebo na ograniczenie wydolności fizycznej wynikającej
z niedokrwienia kończyn dolnych po 3 i 6 miesiącach leczenia; wykres
ramkowy ilustruje rozstęp kwartylny, poziomy odcinek - mediana (wg Mondillo i
wsp. [41]).
symwastatyna
placebo
Do innego badania, które przeprowadził Arnow i wsp., włączono 60
chorych z II stopniem niedokrwienia kończyn dolnych wg skali Fontaine'a
i średnim indeksem kostkowo-ramiennym 0,63, spośród których 31 otrzymywało
symwastatynę w dawce 40 mg/dobę, a 29 pacjentów placebo [2].
Zmierzono u tych chorych czas, jaki upłynął od momentu rozpoczęcia marszu
na bieżni ruchomej z prędkością 2 mile/godzinę i kątem nachylenia 12,5%
do wystąpienia bólu o typie chromania przestankowego. Po pół roku przeprowadzono
badania kontrolne, w czasie których okazało się, iż u pacjentów
przyjmujących symwastatynę wydłużył się czas wystąpienia bólu kończyny
dolnej od momentu rozpoczęcia marszu na bieżni o 54 sekundy, to jest o 24%
w stosunku do wartości wyjściowych. Po roku czasu, taki sam test wykazał
wydłużenie czasu o 95 sekund, tj. o 42% w stosunku do wartości wyjściowych.
W grupie kontrolnej, w której pacjenci nie przyjmowali statyny, czas od
rozpoczęcia marszu do wystąpienia bólu kończyn dolnych nie zmienił się po
pół roku i po roku przyjmowania placebo w stosunku do wartości wyjściowych
(Tabela XIV).
46 47
plazji dochodzi w wyniku migracji i proliferacji komórek mięśni gładkich oraz
w wyniku przebudowy macierzy pozakomórkowej. Prezentowany jest pogląd,
iż migrację komórek mięśniówki gładkiej zawsze poprzedza degradacja białek
macierzy, tj. proces, któremu towarzyszy podwyższenie aktywności metaloproteinaz
(MMP). Należy w tym miejscu przytoczyć wyniki badań Porter
i wsp., z których wynika, iż istnieje wyraźny związek przyczynowo-skutkowy
pomiędzy wysokim poziomem metaloproteinaz macierzy pozakomórkowej,
m.in. MMP-2 (żelatynazy A), a zwłaszcza MMP-9 (żelatynazy B), a gwałtownie
postępującą hiperplazją śródbłonka żyły odpiszczelowej [24, 50, 51].
Kolejne badania in vitro udowodniły, że podawanie inhibitorów metaloproteinaz,
np. marimastatu, spowalniały migrację komórek mięśni gładkich i rozwój
hiperplazji [49, 50].
Niezwykle interesujące są rezultaty badań, z których wynika, iż statyny
mogą odgrywać zasadniczą rolę w hamowaniu procesu hiperplazji poprzez
zahamowanie migracji i proliferacji komórek mięśni gładkich w naczyniach
krwionośnych (Rycina 24) [50].
0
10
20
30
40
Grubość neointimy (µm)
0 0,5 1,0 5,0
Stężenie symwastatyny (µmol/L)
Rycina 24. Wpływ różnych stężeń symwastatyny na grubość neointimy w przeszczepie
żylnym; **p<0,01 (wg Porter i wsp. [50]).
Jak już wcześniej nadmieniono, mewalonian jest niezbędnym substratem
do syntezy cholesterolu, ale odgrywa także zasadniczą rolę jako prekursor
wielu izoprenoidów. Te z kolei uczestniczą w potranslacyjnej prenylacji
Wielu badaczy dopatruje się pewnej analogii między tętnicami wieńcowymi
i obwodowymi. Badania wykazały, że zmiany miażdżycowe w tętnicach
wieńcowych powodują zmniejszenie syntezy, uwalniania i aktywności tlenku
azotu, czego konsekwencją mogą być ostre objawy choroby wieńcowej.
Zaburzenia przepływu przez zwężoną tętnicę wieńcową mogą również
prowadzić do zwiększonej produkcji mediatorów odpowiedzialnych za skurcz
naczyniowy: endoteliny-1, tromboksanu A2, angiotensyny II. Już krótki okres
podawania statyn może przywrócić prawidłową syntezę tlenku azotu, a także
zmniejszyć zaburzenia funkcji śródbłonka naczyniowego i poprawić zależną
od niego wazomotorykę naczyń wieńcowych [37].
Symwastatyna podawana przewlekle pacjentom z miażdżycą zarostową
tętnic kończyn dolnych powodowała znacznie częściej i w znacznie wyższym
stopniu poprawę dystansu chromania niż poprawę indeksu kostkowo-
-ramiennego. Poprawa kliniczna obserwowana u tych chorych wydaje się
być wynikiem działania statyny nie poprzez zmniejszenie nasilenia zmian
miażdżycowych w tętnicach, a poprzez stabilizację blaszki miażdżycowej
oraz aktywację czynników, o których była mowa wcześniej [41].
Wysoce znamiennymi dla dalszych badań okazały się wyniki Hart Protection
Study Collaborative Group (HPS), opublikowane w 2002 roku w Lancecie
(vol. 360: 7-22). Szereg publikacji, opartych na badaniu HPS, które objęło
20 536 pacjentów, dostarcza jednoznacznych dowodów na to, że leczenie
symwastatyną w dawce 40 mg na dobę powinno być obecnie rutynowo
włączane w przypadku wszystkich chorych z dostatecznie dużym ryzykiem
wystąpienia zdarzenia sercowo-naczyniowego, niezależnie od wyjściowego
poziomu cholesterolu. Autorzy podkreślają, że symwastatyna obniżała
poziom cholesterolu LDL średnio o 1,0 mmol/L i redukowała średnio o 1/3
częstość zawałów mięśnia sercowego, udarów mózgu oraz rewaskularyzacji
naczyń obwodowych [37, 40, 41].
2. Wpływ symwastatyny na hiperplazję śródbłonka naczyniowego
Najlepszym materiałem wykorzystywanym do przeszczepów omijających,
np. aortalno-wieńcowych albo udowo-podkolanowych jest autogenna
żyła odpiszczelowa. Jednak i ona nie zapewnia trwałego dobrego wyniku
odległego. Zwężenie zagrażające drożności przeszczepu żylnego występuje
w około 40% przypadków przeszczepu z żyły odpiszczelowej [50].
Najczęstszą przyczyną zwężenia jest hiperplazja śródbłonka. Dotychczasowe
badania przeprowadzone w warunkach in vitro i in vivo wykazały, iż do hiper-
48 49
Interesujące wyniki badań zostały opublikowane w 2005 roku przez Corpataux
i wsp. [13]. Autorzy obserwowali wpływ statyn na rozwój śródbłonka
hiperplastycznego w żyle pobieranej od pacjentów w czasie wykonywanych
u nich rekonstrukcji naczyniowych za pomocą żyły odpiszczelowej. Pobrany
fragment żyły hodowano w warunkach laboratoryjnych przez 14 dni w środowisku
statyn. Oceniono m.in. wyjściową grubość śródbłonka oraz jego przyrost
w grupie kontrolnej (bez statyny), a także w warunkach ekspozycji na każdą
z sześciu statyn.
Porównano również aktywność żelatynaz MMP-2 i MMP-9 w macierzy
pozakomórkowej przeszczepów żylnych. Okazało się, że wszystkie hodowle
w grupie kontrolnej wykazywały znaczne pogrubienie śródbłonka w porównaniu
do grup statynowych, w których ten wzrost był znacznie mniejszy
(Tabela XV, Rycina 26).
Grupa
Grubość śródbłonka
hiperplastycznego
Mediana
Kontrolna 14-19 17
Symwastatyna 5-10 6
Lowastatyna 5-10 6
Fluwastatyna 5-10 6
Atorwastatyna 6-11 7
Ceriwastatyna 6-10 8
Prawastatyna 7-11 10
Tabela XV. Grubość śródbłonka hiperplastycznego w przeszczepie z żyły odpiszczelowej w grupie
kontrolnej (bez statyny) oraz w grupach eksponowanych na statyny; grubość podano
w .m (wg Corpataux i wsp. [13]).
wielu małych białek, np. białka G, włączając w to rodzinę białek Ras i Rho
(Rycina 17). Okazało się, że hamowanie prenylacji białek jest kluczowym
mechanizmem, dzięki któremu statyny mogą wpływać na funkcję komórek
mięśni gładkich poprzez hamowanie reduktazy 3-hydroksy-3-metylo-
-glutarylo-koenzymu A [50, 60]. Białka Ras i Rho regulują ekspresję genów,
a dodatkowo Rho odgrywa niezwykle ważną rolę w reorganizacji struktury
komórek mięśni gładkich naczyń. Wykazano, że efekt hamujący statyn
na proliferację i migrację mięśniówki gładkiej tętnic jest wynikiem hamowania
prenylacji zarówno białka Ras, jak i białka Rho [13].
Wiele badań potwierdziło również, że statyny hamują aktywność MMP-9
w monocytach, makrofagach, fibroblastach oraz komórkach mięśni gładkich
(Rycina 25) [50, 60].
W 2001 roku opisano wyniki badań klinicznych, jakie przeprowadzono
po roku u pacjentów otrzymujących symwastatynę przez 3 miesiące przed
i 3 miesiące po przeszczepach aortalno-wieńcowych [12]. Wykazano, iż
grupa chorych otrzymujących symwastatynę ma niższy odsetek zwężeń
w przeszczepach aortalno-wieńcowych z żyły odpiszczelowej niż grupa
kontrolna, w której nie stosowano tej statyny.
0
0,5
1,0
1,5
2,0
Aktywność MMP-9
0 0,5 1,0 5,0
Stężenie symwastatyny (µmol/L)
Rycina 25. Wpływ symwastatyny na poziom MMP-9 w macierzy pozakomórkowej
przeszczepu żylnego; *p<0,05, poziome odcinki odpowiadają medianie
(wg Porter i wsp. [50]).
50 51
0
25
50
75
100
Aktywność proMMP-2 w stosunku do grupy
kontrolnej (% redukcji aktywności)
Statyny
Kontrola Symwastatyna Fluvastatyna Ceriwastatyna Lowastatyna Atorwastatyna Prawastatyna
Rycina 27. Porównanie wpływu różnych statyn na aktywność żelatynazy proMMP-2
w macierzy pozakomórkowej przeszczepu żylnego; p<0,03, poziome
odcinki odpowiadają medianie (wg Corpataux i wsp. [13]).
0
25
50
75
100
Aktywność proMMP-9 w stosunku do grupy
kontrolnej (% redukcji aktywności)
Statyny
Kontrola Symwastatyna Fluvastatyna Ceriwastatyna Lowastatyna Atorwastatyna Prawastatyna
Rycina 28. Porównanie wpływu statyn na aktywność żelatynazy proMMP-9 w macierzy
pozakomórkowej przeszczepu żylnego; p<0,03, poziome odcinki odpowiadają
medianie (wg Corpataux i wsp. [13]).
0
50
100
Procentowa redukcjia grubości
nabłonka hiperplastycznego (%)
Statyny
Kontrola Symwastatyna Fluvastatyna Ceriwastatyna Lowastatyna Atorwastatyna Prawastatyna
Rycina 26. Porównanie wpływu różnych statyn na procentową redukcję grubości
nabłonka hiperplastycznego; p=0,004, poziome odcinki odpowiadają
medianie (wg Corpataux i wsp. [13]).
Wykazano również, iż statyny w sposób wyraźny hamowały aktywność
metaloproteinaz w ścianie żyły odpiszczelowej (Rycina 27, 28). Dane te
potwierdzają wcześniejsze obserwacje przeprowadzone przez innych
autorów. Stwierdzili oni mianowicie, że preparowanie chirurgiczne żyły odpiszczelowej,
nawet bardzo delikatne i precyzyjne, powoduje wzrost aktywności
żelatynaz w macierzy pozakomórkowej przygotowywanego przeszczepu
[24]. Prawdopodobnym skutkiem tego są odległe zmiany morfologiczne
w przeszczepie i powikłania w postaci zwężenia i zakrzepicy przeszczepu.
Jak najbardziej uzasadnione wydaje się zatem podawanie statyny, która
dzięki zahamowaniu aktywności metaloproteinaz macierzy pozakomórkowej
oraz poprzez zahamowanie proliferacji i migracji komórek mięśni gładkich,
może zredukować postęp hiperplazji śródbłonka naczyniowego.
52 53
nane po roku u tych pacjentów wykazały zmiany w przeszczepie u 16,6%
otrzymujących statynę oraz u 42,3% pacjentów z grupy kontrolnej, w której
statyny nie podawano [12].
Badania prowadzone przez Abbruzzese i wsp. [1] u chorych z przewlekłym
niedokrwieniem kończyny dolnej, którym wykonano żylny przeszczep
udowo-podkolanowy i którym w okresie pooperacyjnym podawano statyny,
wykazują poprawę wyników odległych. Do badania zostali włączeni pacjenci,
u których pierwotnie wykonano wyłącznie żylny przeszczep udowo-podkolanowy.
Jedną grupę stanowili chorzy (88 chorych; 94 przeszczepy), którzy
w okresie pooperacyjnym przyjmowali statyny (64% symwastatynę, 30%
atorwastatynę, 6% inne statyny), a kontrolną grupę ci, u których statyn
nie stosowano (84 chorych; 95 przeszczepów). Grupy były porównywalne
pod względem płci, występowania cukrzycy, nikotynizmu, nadciśnienia
tętniczego, zaburzeń rytmu serca, przewlekłej niewydolności krążenia, przewlekłej
obturacyjnej choroby płuc, przewlekłej niewydolności nerek i choroby
niedokrwiennej ośrodkowego układu nerwowego. W grupie pacjentów przyjmujących
statyny, częściej niż w grupie kontrolnej, występowała przewlekła
choroba wieńcowa i częściej też wykonywano u nich przeszczepy aortalno-
wieńcowe (w okresie przed włączeniem do badania). Nie stwierdzono
statystycznie znamiennych różnic między grupami pod względem wskazań
do leczenia operacyjnego, typu żylnego przeszczepu udowo-podkolanowego
oraz lokalizacji obwodowego zespolenia. Nie stwierdzono także różnic
w śmiertelności okołooperacyjnej, częstości wczesnej zakrzepicy przeszczepu
(do 30 dnia po operacji), wskaźnika uratowania kończyny dolnej
oraz pierwotnej drożności przeszczepu udowo-podkolanowego po dwóch
latach obserwacji. Wykazano natomiast przewagę wskaźnika wtórnej drożności
przeszczepu udowo-podkolanowego po dwóch latach w grupie chorych
otrzymujących statyny w stosounku do grupy kontrolnej (p<0,02) (Rycina 29,
30). Ogólne ryzyko niewydolności przeszczepu było 3,2 razy wyższe w grupie
pacjentów, którzy nie otrzymywali statyn [1].
Wstępne doniesienia, nielicznych jeszcze prac, dotyczące wpływu statyn
na rozwój i postęp zmian miażdżycowych w żylnych przeszczepach omijających,
zwłaszcza z żyły odpiszczelowej, są niezwykle zachęcające. Ma to
szczególne znaczenie w kontekście znanej od dawna predylekcji żyły odpiszczelowej
do zmian wstecznych po włączeniu jej do krążenia tętniczego [12].
3. Wpływ symwastatyny na wyniki odległe przeszczepów
udowo-podkolanowych
Pomimo znacznego postępu, jaki dokonał się w technikach wewnątrznaczyniowych,
chirurgiczna rewaskularyzacja pozostaje nadal podstawowym
sposobem leczenia chorych z krytycznym niedokrwieniem kończyny dolnej
w odcinku udowo-podkolanowym. Poprawa wyników odległych po rekonstrukcjach
tętniczych w tym odcinku jest jednym z najważniejszych wyzwań
współczesnej chirurgii naczyniowej. Po 5 latach u około 30-50% chorych
dochodzi bowiem do zakrzepicy przeszczepu udowo-podkolanowego, co
może prowadzić do bezpośredniego zagrożenia kończyny, wymusza dodatkowe
interwencje chirurgiczne, pogarsza jakość życia, czy też może wpływać
na wzrost śmiertelności w tej grupie chorych [1, 12, 13]. Co więcej, wiadomo,
że w przypadku przeszczepów żylnych, w blisko 10% przypadków dochodzi
do zakrzepicy w ciągu pierwszych kilku tygodni po operacji. Z piśmiennictwa
wynika, że po pierwszym roku od wykonania rekonstrukcji za pomocą takiego
przeszczepu, w 20% przypadków dochodzi do zwężenia w proksymalnym
zespoleniu, a u blisko połowy chorych pojawia się zwężenie w zespoleniu
obwodowym (nie zawsze jest ono hemodynamicznie istotne) [12].
Ponad dwadzieścia lat badań nie doprowadziło do wyraźnej poprawy
wyników odległych za pomocą leczenia farmakologicznego. Dopiero ostatnio
uzyskano obiecujące, wstępne wyniki leczenia za pomocą statyn. Badania
kliniczne wykazały, iż stosowanie statyn wpływa na obniżenie częstości występowania
zdarzeń sercowo-naczyniowych u chorych z przewlekłą chorobą
wieńcową. Udowodniono także działanie przeciwzapalne, niezależnie od
właściwości obniżających poziom lipidów w surowicy. Wykazano ponadto
wpływ statyn na poprawę czynności śródbłonka naczyniowego, hamowanie
proliferacji i migracji komórek mięśni gładkich naczyń, na zmniejszenie
odczynu zapalnego w endotelium. Wiele badań doświadczalnych udowodniło
hamujący wpływ statyn na ekspresję czynnika tkankowego i na aktywność
metaloproteinaz, które wykazują swój wpływ na powstawanie i przebudowę
blaszki miażdżycowej.
Ostatnio prowadzone przez Christensona i wsp. [12] randomizowane
badania prospektywne wykazały wyraźny spadek powikłań pooperacyjnych
dotyczących przeszczepów żylnych aortalno-wieńcowych u chorych z hipercholesterolemią,
u których obniżono poziom cholesterolu całkowitego za
pomocą podawania symwastatyny. Kontrolne badania angiograficzne wyko-
54 55
IL-6 (interleukina-6) [1, 52]. Niewykluczone, że pewną rolę odgrywa zdolność
statyn do obniżenia poziomu białka C-reaktywnego (CRP) w surowicy
w sposób niezależny od działania obniżającego poziom lipidów [1, 11, 29]
oraz hamowanie aktywacji limfocytów T oraz ich funkcji prezentacji antygenów
[1, 36].
Badania kliniczne prowadzone u chorych z rodzinną hipercholesterolemią,
u których przez dwa lata podawano symwastatynę, wykazały wyraźne
zmniejszenie grubości warstwy środkowej i wewnętrznej tętnic szyjnych
i udowych u tych chorych [54].
Badania nad hiperplazją śródbłonka naczyniowego ujawniły, iż statyny
hamują proliferację komórek mięśni gładkich, ich zdolność do migracji,
a także stymulują zjawisko apoptozy w tych komórkach [50]. Prawdopodobny
jest również mechanizm hamowania przez statyny chemotaktycznego białka-
1 (Monocyte Chemotactic Protein-1), dzięki czemu zahamowana zostaje
migracja monocytów [1]. Zwraca się także uwagę na zdolność statyn do aktywacji
śródbłonkowej syntazy tlenku azotu (eNOS) i likwidacji wynikających
z niedoboru tlenku azotu zaburzeń funkcji śródbłonka i wazomotoryki naczyń
tętniczych [37, 41]. Ostatnie badania doświadczalne wykazały, iż statyny
zwiększają liczbę krążących komórek progenitorowych oraz ich zdolność
do różnicowania się w kierunku komórek śródbłonka. Ten mechanizm może
odgrywać rolę naprawczą w przypadku uszkodzenia śródbłonka, np. przeszczepu
żylnego [59].
Wykazano również działanie statyn na regionalne, śródbłonkowe mechanizmy
fibrynolizy poprzez redukcję poziomu inhibitora-1 aktywatora
plazminogenu oraz wzrost poziomu tkankowego aktywatora plazmionogenu
[7].
4. Symwastatyna a restenozy po przezskórnych zabiegach
naczyniowych
Za pomocą przezskórnych zabiegów wewnątrznaczyniowych można
rozszerzyć zwężoną tętnicę lub udrożnić ją, o ile odcinek niedrożności jest
krótki (5-10 cm). Podczas przezskórnej angioplastyki balonowej dochodzi
zwykle do pękania włókien błony wewnętrznej i warstwy środkowej tętnicy,
a także do wciśnięcia w ścianę tętnicy blaszek miażdżycowych i zorganizowanych
skrzeplin ją pokrywających. Takie jatrogenne uszkodzenie śródbłonka
stymuluje procesy zapalne i regenerujące w tej okolicy, prowadząc często do
restenozy [27].
0
10
20
30
40
50
60
70
80
90
100
Skumulowany wskaźnik
drożności przeszczepu (%)
Czas (miesiące)
0 10 20 30 40 50 60
Rycina 29. Skumulowana pierwotna drożność żylnych przeszczepów udowo-podkolanowych
w grupie pacjentów przyjmujących symwastatynę i placebo; p=0,25
(wg Abbruzzese i wsp. [1]).
Grupa kontrolna
Grupa otrzymująca statynę
0
10
20
30
40
50
60
70
80
90
100
Skumulowany wskaźnik
drożności przeszczepu (%)
Czas (miesiące)
0 10 20 30 40 50 60
Grupa kontrolna
Grupa otrzymująca statynę
Rycina 30. Skumulowana wtórna drożność żylnych przeszczepów udowo-podkolanowych
w grupie pacjentów przyjmujących symwastatynę i placebo; p<0,02
(wg Abbruzzese i wsp. [1]).
Nie do końca poznano i wyjaśniono wszystkie mechanizmy działania
ochronnego statyn na przeszczepy żylne w odcinku udowo-podkolanowym.
Wydaje się, iż istotną rolę odgrywają ich właściwości hamujące reakcje
zapalne. Statyny hamują uwalnianie przez leukocyty niektórych cytokin biorących
udział w reakcjach zapalnych, np. TNF (Tumor Necrosis Factor ),
56 57
syntezę MMP-9 hamuje także powstawanie tętniaka aorty. Stąd pogląd, iż
zahamowanie MMP-9 może powstrzymać powstanie tętniaka [56]. Ponieważ
statyny wykazują hamujące działanie na liczne procesy zapalne, w tym na
aktywność MMP, badacze z Japonii przeprowadzili badania mające na celu
wyjaśnić możliwość zastosowania tej grupy leków u chorych z AAA [42].
Dotychczasowe badania wykazały, iż komórki mięśni gładkich, np. w miejscach
hiperplazji śródbłonka żylnego wydzielają duże ilości MMP-9.
Nagashima i wsp., po przeprowadzeniu badań immunohistochemicznych
ściany tętniakowato zmienionej aorty brzusznej, wykazali w niej liczne nacieki
m.in. z makrofagów i neutrofilów, które były źródłem MMP-9, natomiast
komórki mięśni gładkich nie powodowały podwyższonej aktywności tego
enzymu. Badania prowadzone in vitro dowiodły, że ceriwastatyna hamuje
aktywność MMP-9 w hodowli komórek pochodzących ze ściany tętniaka
i zdolność ta wzrasta proporcjonalnie do stężenia statyny w środowisku
(Rycina 32).
Właściwości statyn, obniżające poziom cholesterolu oraz ich zdolność
oddziaływania na mikrostruktury ściany aorty, pozwalają sądzić, że ta grupa
leków posiada potencjalną wartość terapeutyczną i znajdzie także zastosowanie
w leczeniu chorych z tętniakiem aorty brzusznej [42].
0
200
400
600
800
1000
Stężenie MMP-9 (ng/g suchej tkanki)
Ściana aorty
chorych z grupy
kontrolnej A.O.
(n=8)
Ściana aorty
chorych z tętniakiem
aorty AAA
(n=10)
Rycina 31. Poziom metaloproteinazy MMP-9 w ścianie aorty chorego operowanego z po-
wodu tętniaka aorty brzusznej (grupa badana) i w ścianie aorty chorego opero-
wanego z powodu miażdżycy aorty i tętnic biodrowych (grupa kontrolna)
(wg Nagashima i wsp. [42]).
Powszechnie znane są prace wykazujące w badaniach angiograficznych, iż
inhibitory reduktazy HMG-CoA (statyny) mogą zmniejszać częstość restenoz
po przezskórnej angioplastyce tętnic wieńcowych. Zatem na szczególne
zainteresowanie zasługują opublikowane niedawno wyniki badań klinicznych
prowadzonych przez Hagenaarsa i wsp., wskazujące na korzystny wpływ
podawania symwastatyny pacjentom po zabiegach angioplastyki w odcinku
udowo-podkolanowym [27]. Autorzy wykorzystali śródnaczyniowe badanie
ultrasonograficzne do oceny efektu przezskórnej angioplastki po roku stosowania
symwastatyny u pacjentów z przewlekłym niedokrwieniem kończyny
dolnej. Nie stwierdzono różnic między porównywanymi dwiema grupami
chorych (chorzy otrzymujący symwastatynę w dawce 20-40 mg/dobę vs.
grupa kontrolna - bez statyny) pod względem danych demograficznych,
zaawansowania zmian miażdżycowych w naczyniach i wyjściowego efektu
angioplastyki balonowej. Po roku stwierdzono kliniczne cechy restenozy
w miejscu uprzedniej angioplastyki u 36% pacjentów z grupy kontrolnej,
a restenozę w obrazie angiograficznym aż u 73% pacjentów z tej samej
grupy. Nie stwierdzono cech restenozy u żadnego chorego przyjmującego
symwastatynę. W badaniu ultrasonograficznym, wykonanym po roku od
angioplastyki, nie stwierdzono różnic w zakresie wielkości blaszki miażdżycowej
w obu grupach chorych w stosunku do wielkości wyjściowych blaszki.
Stwierdzono natomiast, że u pacjentów przyjmujących symwastatynę pole
przekroju światła naczynia zmniejszyło się tylko o 4% w stosunku do wartości
wyjściowych, podczas gdy w grupie kontrolnej pole to zmniejszyło się średnio
o 25%, p<0,03 [27].
5. Statyny a tętniak aorty brzusznej
Tętniak aorty brzusznej (AAA) występuje u 2-9% ogólnej populacji ludzi
powyżej 65 roku życia. Według obecnego stanu wiedzy, podstawową rolę
w powstawaniu tętniaka odgrywają procesy rozpadu macierzy pozakomórkowej
ściany aorty, a wielu autorów dodatkowo zwraca uwagę na szczególną
rolę metaloproteinaz (MMP), a zwłaszcza MMP-2, MMP-9 i MMP-12.
Podobnie, jak w ścianie żyły odpiszczelowej, która uległa hiperplazji, tak
i w ścianie AAA stwierdza się znaczące podwyższenie aktywności żelatynazy
B, tj. MMP-9 (Rycina 31) [42]. Zaobserwowano również podwyższenie
stężenia tego enzymu w surowicy u chorych z tętniakiem aorty oraz korelację
między aktywnością tego enzymu a średnicą tętniaka. W zwierzęcym modelu
doświadczalnym wykazano, że zablokowanie genu odpowiedzialnego za
58 59
V. Podsumowanie
Symwastatyna należy do grupy najważniejszych leków stosowanych
w zaburzeniach gospodarki lipidowej. Obniża ona stężenie cholesterolu frakcji
LDL o 30-50% a stężenie trójglicerydów o 10-15% [38]. Podwyższa natomiast
stężenie cholesterolu frakcji HDL o 5-8%. W dużych randomizowanych
badaniach klinicznych wykazano, iż stosowanie statyn w ramach prewencji
zarówno pierwotnej (WOSCOP, AFCAPS / TexCAPS HPS), jak i wtórnej (4S,
LIPID, CARE HPS) zmniejsza częstość występowania zdarzeń naczyniowych
i ma korzystny wpływ na przeżycie tak leczonych chorych [46].
Opublikowane w ostatnich latach dane w sposób jednoznaczny sugerują,
iż pacjenci z miażdżycą zarostową tętnic kończyn dolnych powinni otrzymywać
także statynę, przede wszystkim dlatego, że chroni ich w znacznym
stopniu przed śmiertelnymi powikłaniami miażdżycy. Badania epidemiologiczne
udowodniły, że chorzy ci umierają znacznie częściej niż ich rówieśnicy,
głównie z powodu zawału mięśnia sercowego czy udaru mózgu. U blisko 40%
chorych z przewlekłym niedokrwieniem kończyn dolnych występują istotne
klinicznie zmiany miażdżycowe również w tętnicach wieńcowych i szyjnych.
Znacząca liczba wieloośrodkowych, międzynarodowych, randomizowanych
badań klinicznych wykazała, iż stosowanie statyn, w tym symwastatyny,
w sposób istotny zmniejsza ryzyko zawału mięśnia sercowego i/lub udaru
mózgu.
Dotychczasowe badania wykazują korzystne działanie symwastatyny
u chorych z chromaniem przestankowym, u których przewlekłe podawanie
tego preparatu spowodowało wydłużenie dystansu chromania, zmniejszyło
dolegliwości bólowe oraz zmniejszyło ograniczenie wydolności fizycznej
pacjentów.
Ponieważ hiperplazja śródbłonka naczyniowego jest wynikiem migracji,
a także proliferacji komórek mięśni gładkich naczynia krwionośnego, uzasadniona
wydaje się strategia postępowania terapeutycznego hamującego
zarówno migrację tych komórek, jak i ich proliferację. Takie, dwukierunkowe
działanie zapewnia symwastatyna, hamując powstawanie zwężeń w przeszczepach
żylnych stosowanych jako omijające pomosty naczyniowe.
0
200
400
600
800
1000
Stężenie MMP-9 (ng/g suchej tkanki)
Stężenie ceriwastatyny (.M)
0 0,001 0,01 0,1
P<0,001
Rycina 32. Ceriwastatyna wyraźnie obniża poziom MMP-9 w hodowli komórek pochodzących
ze ściany tętniaka aorty brzusznej (wg Nagashima i wsp. [42]).
60 61
VI. Piśmiennictwo
1. Abbruzzese T.A., Havens J., Belkin M., Donaldson M.C., Whittemore A.D.,
Liao J.K., Conte M.S.: Statin therapy is associated with improved patency
of autogenous infrainguinal bypass grafts. J Vasc Surg 2004, 39: 1178-
1185.
2. Aronow W.S., Nayak D., Woodworth S., Ahn C.: Effect of simvastatin
versus placebo on treadmill exercise time untill the onset of intermittent
claudication in older patients with peripheral arterial disease at six months
and at one year after treatment. Am J Cardiol 2003, 92: 711-712.
3. Baumgartner I., Pieczek A., Manor O., Blair R., Kearney M., Walsh K.,
Isner J.M.: Constitutive expression of phVEGF165 after intramuscular
gene transfer promotes collateral vessel development in patients with
critical limb ischemia. Circulation 1998, 97: 1114-1123.
4. Beckman J.A., Creager M.A., Libby P.: Diabetes and atherosclerosis:
epidemiology, pathophysiology, and management. JAMA 2002, 287:
2570-2581.
5. Beebe H.G., Dawson D.L., Cutler B.S., Herd J.A., Strandness jr. D.E.,
Bortey E.B., Forbes W.P.: A new pharmacological treatment for intermittent
claudication: results of a randomized, multicenter trial. Arch Intern
Med 1999, 159: 2041-2050.
6. Bild D.E., Selby J.V., Sinnock P., Browner W.S., Braveman P., Showstack
J.A.: Lower-extremity amputation in people with diabetes. Epidemiology
and prevention. Diabetes Care 1989, 12: 24-32.
7. Bourcier T., Libby P.: HMG-CoA reductase inhibitors reduce plasminogen
activator inhibitor-1 expression by human vascular smooth muscle and
endothelial cells. Arterioscler Thromb Vasc Biol 2000, 83: 688-692.
8. Burns P., Gough S., Bradbury A.W.: Management of peripheral arterial
disease in primary care. Br Med J 2003, 326: 584-588.
9. CAPRIE Steering Committee. A randomised, blinded trial of clopidogrel
versus aspirin in patients at risk of ischemic events (CAPRIE). Lancet
1996, 348: 1329-1339.
Wykazano również korzystne działanie symwastatyny po radiologicznych
zabiegach wewnątrznaczyniowych takich, jak rozszerzanie, czy stentowanie
tętnicy. Dlatego włączenie symwastatyny do standardowej terapii stwarza
szansę na poprawę wyników odległych u chorych z przewlekłym niedokrwieniem
kończyn dolnych.
Zdolność do hamowania procesu hiperplazji śródbłonka naczyniowego
przez symwastatynę może stać się wskazaniem do jej podania chorym
przewlekle hemodializowanym z powodu schyłkowej niewydolności nerek.
Niezwykle ważnym problemem u tych pacjentów jest utrzymanie stałego
dostępu naczyniowego do dializ. Przetoki tętniczo-żylne zapewniają taki
dostęp, ale nie znano do tej pory skutecznego sposobu ochrony przed
hiperplazją śródbłonka naczyniowego, która stanowi niezwykle ważną przyczynę
odległego powikłania, jakim jest zakrzepica przetoki tętniczo-żylnej.
Być może, iż profilaktyczne zastosowanie symwastatyny u tych chorych,
zapobiegłoby hiperplazji śródbłonka w miejscu zespolenia tętniczo-żylnego
i uchroniło pacjenta przed groźnymi dla życia konsekwencjami nagłego braku
dostępu naczyniowego do hemodializ.
Początkowo, właściwości statyn zdecydowały o ich szerokim zastosowaniu
w kardiologii. Kolejne badania doświadczalne i kliniczne doprowadziły
do rozszerzenia wskazań do stosowania statyn w innych jednostkach
chorobowych i innych specjalnościach, np. w neurologii. Z przedstawionego
materiału wynika także, iż statynę powinno stosować się rutynowo u każdego
chorego z objawami przewlekłego niedokrwienia kończyn dolnych. Aktualnie
prowadzone badania wskażą zapewne nowe, nieznane jeszcze możliwości
tej grupy leków i spowodują dalsze ich rozpowszechnienie.
62 63
21. Donnelly R., Yeung J.M.C.: Management of intermittent claudication: the
importance of secondary prevention. Eur J Vasc Endovasc Surg 2002,
23: 100-107.
22. Dormandy J.A. (red.): Second European Consensus Document on
Chronic Critical Leg Ischemia. Circulation (suppl.), Nov., 1991.
23. Falk E., Shah P.K., Fuster V.: Coronary plaque disruption. Circulation
1995, 92: 657-671.
24. George S.J., Zaltsman A.B., Newby A.C.: Surgical preparative injury and
neointima formation increase MMP-9 expression and MMP-2 activation
in human saphenous vein. Cardiovasc Res 1997, 33: 447-459.
25. Gey D.C., Lesho E.P., Manngold J.: Management of peripheral arterial
disease. Am Fam Physician 2004, 69: 525-532.
26. Glagov S., Weisenberg E., Zarins C.K., Stankunavicius R., Kolettis G.J.:
Compensatory enlargement of human atherosclerotic coronary arteries.
N Engl J Med 1987, 316: 1371-1375.
27. Hagenaars T., Gussenhoven E.J., van Sambeek M.R.H.M., Jukema
J.W., Kranendonk S.E., Bom N.: Effect of simvastatin on restenosis
after percutaneous transluminal angioplasty of femoropopliteal arterial
obstruction. Am J Cardiol 2000, 86: 774-776.
28. Hallett jr. J.W.: Trends in revascularization of the lower extremity. Mayo
Clin Proc 1986, 61: 369-377.
29. Harley S.L., Sturge J., Powell J.T.: Regulation by fibrinogen and its products
of intercellular adhesion molecule-1 expression in human saphenous
vein endothelial cells. Arterioscler Thromb Vasc Biol 2000, 20: 652-658.
30. Harrison E.M., Holdsworth R.J.: How many claudicants should be
prescribed statins? Eur J Vasc Endovasc Surg 2003, 25: 367-368.
31. Hiatt W.: Risk factor modification in intermittent claudication: effect on
life expectancy and walking capacity. Eur Heart J Suppl 2002, 4, suppl.
B, B50-B54.vv
32. Hiatt W.R.: Drug therapy: medical treatment of peripheral arterial disease
and claudication. N Engl J Med 2001, 344: 1608-1621.
33. Hiatt W.R.: Pharmacologic therapy for peripheral arterial disease and
claudication. J Vasc Surg 2002, 36: 1283-1291.
34. Isner J.M., Pieczek A., Schainfeld R., Blair R., Haley L., Asahara T.,
Rosenfield K., Razvi S., Walsh K., Symes J.F.: Clinical evidence of
angiogenesis after arterial gene transfer of phVEGF165 in patient with
ischemic limb. Lancet 1996, 348: 370-374.
10. Carman T.L., Fernandez jr. B.B.: A primary care approach to the
patient with claudication. Am Fam Physician 2000, 61: 1027-
1032.
11. Chester A.H., Morrison K.J., Yacoub M.H.: Expression of vascular
adhesion molecules in saphenous vein coronary bypass grafts. Ann
Thorac Surg 1998, 65: 1685-1689.
12. Christenson J.T.: Pre-operative lipid control with simvastatin
reduces the risk for graft failure already 1 year after myocardial
revascularization. Cardiovasc Surg 2001, 9: 33-43.
13. Corpataux J.M., Naik J., Porter K.E., London N.J.M.: A comparison
of six statins on the development of intimal hyperplasia in a human
vein culture model. Eur J Vasc Endovasc Surg 2005, 29: 177-181.
14. Corti R., Fayad Z.A., Fuster V., Worthley S.G., Helft G., Chesebro
J., Mercuri M., Badimon J.J.: Effects of lipid-lowering by simvastatin
on human atherosclerotic lesions: a longitudinal study by high-
-resolution, noninvasive magnetic resonance imaging. Circulation
2001, 104: 249-252.
15. Corti R., Fuster V., Fayad Z., Worthley S.G., Helft G., Smith D.,
Weinberger J., Wentzel J., Mizsei G., Mercuri M., Badimon J.J.: Lipid
lowering by simvastatin induces regression of human atherosclerotic
lesions: two years' follow-up by high-resolution noninvasive
magnetic resonance imaging. Circulation 2002, 106: 2884-2887.
16. Criqui M.H.: Systemic atherosclerosis risk and the mandate for intervention
in atherosclerotic peripheral arterial disease. Am J Cardiol
2001, 88 (suppl.): 43J-47J.
17. Crisby M., Nordin-Fredriksson G., Shah P.K.: Pravastatin treatment
increases collagen content and decreases lipid content, inflamation,
metalloproteinases, and cell death in human carotid plaques: implications
for plaque stabilization. Circulation 2001, 103: 926-933.
18. Darling R.C., Brewster D.C., Hallett jr. J.W., Darling III R.C.: Aorto-
-iliac reconstruction. Surg Clin North Am 1979, 59: 565-583.
19. Davidson M.H., Jacobson T.A.: How statins work: the development
of cardiovascular disease and its treatment with 3-hydroxy-
-3methylglutaryl coenzyme A reductase inhibitors. Cardiology
Clinical Updates, Medscape, 2001, strona internetowa: http://www.
geocities.com./Heartland/Ridge/4839/statins.html.
20. Davignon J.: The cardioprotective effects of statins. Curr Atheroscler
Rep 2004, 6: 27-35.
64 65
symptoms in the Scandinavian Simvastatin Survival Study (4S). Am J
Cardiol 1998, 81: 333-335.
48. Pedersen T.R., Wilhelmsen L., Faergeman O., Strandberg T.E., Thorgeirsson
G., Troedsson L., Kristianson J., Berg K., Cook T.J., Haghfelt
T., Kjekshus J., Miettinen T., Olsson A.G., Pyörälä K., Wedel H.:
Follow-up study of patients randomized in the Scandinavian Simvastatin
Survival Study (4S) of cholesterol lowering. Am J Cardiol 2000,
86: 257-262.
49. Porter K.E., Loftus I.M., Peterson M., Bell P.R.F., London N.J.M.,
Thompson M.M.: Marimastat inhibits neointimal thickening in a model
of human vein graft stenosis. Br J Surg 1998, 85: 1373-1377.
50. Porter K.E., Naik J., Turner N.A., Dickinson T., Thompson M.M.,
London N.J.M.: Simvastatin inhibits human saphenous vein neointima
formation via inhibition of smooth muscle cell proliferation and
migration. J Vasc Surg 2002, 36: 150-157.
51. Porter K.E., Turner N.A.: Statins for the prevention of vein graft
stenosis: a role for inhibition of matrix metalloproteinase-9. Biochem
Soc Trans 2002, 30: 120-126.
52. Rosenson R.S., Tangney C.C., Casey L.C.: Inhibition of proinflammatory
cytokine production by pravastatin. Lancet 1999, 353: 983-984.
53. Rutheford R.B.: The prevention and management of graft thrombosis.
w: The ischemic leg, Kempczinski R.F. (red.), Yearbook Medical
Publishers, Chicago, 1985, 287-294.
54. de Sauvage Nolting P.R.W., de Groot E., Zwinderman A.H., Buirma
R.J.A., Trip M.D., Kastelein J.J.P.: Regression of carotid and femoral
artery intima-media thickness in familial hypercholesterolemia: treatment
with simvastatin. Arch Intern Med 2003, 163: 1837-1841.
55. Strandness jr. D.E., Eidt J.F.: Peripheral vascular disease. Circulation
2000, 102: 46-51.
56. Thompson R.W.: Basic science of abdominal aortic aneurysms:
emerging therapeutic strategies for an unsolved clinical problem. Curr
Opin Cardiol 1996, 11: 504-518.
57. Tierney S., Fenessy F., Hayes D.B.: Secondary prevention of peripheral
vascular disease. Br Med J 2000, 320: 1262-1265.
58. TransAtlantic Inter-Society Consensus (TASC): Management of peripheral
arterial disease (PAD). Section B: intermittent claudication. Eur
J Vasc Endovasc Surg 2000, 19: S66-S114.
35. Katznelson S.: The effect of HMG-CoA reductase inhibitors on chronic
allograft rejection. Contrib Nephrol 1997, 120: 97-104.
36. Kwak B., Mulhaupt F., Myit S., Mach F.: Statins as a newly recognized
type of immunomodulator. Nat Med 2000, 6: 1399-1402.
37. Laufs U., La Fata V., Plutzky J., Liao J.K.: Upregulation of endothelial
nitric oxide synthase by HMG CoA reductase inhibitors. Circulation 1998,
97: 1129-1135.
38. Laws P.E., Spark J.I., Cowled P.A., Fitridge R.A.: The role of statins in
vascular disease. Eur J Endovasc Surg 2004, 27: 6-16.
39. Mohler III E.R.: Peripheral arterial disease: identification and implications.
Arch Internal Med 2003, 163: 2306-2314.
40. Mohler III E.R., Hiatt W.R., Creager M.A.: Cholesterol reduction with
atorvastatin improves walking distance in patients with peripheral arterial
disease. Circulation 2003, 108: 1481-1486.
41. Mondillo S., Ballo P., Barbati R., Guerrini F., Ammaturo T., Agricola E.,
Pastore M., Borrello F., Belcastro M., Picchi A., Nami R.: Effects of simvastatin
on walking performance and symptoms of intermittent claudication
in hypercholesterolemic patients with peripheral vascular disease. Am J
Med 2003, 114: 359-364.
42. Nagashima H., Aoka Y., Sakomura Y., Sakuta A., Aomi S., Ishizuka N.,
Hagiwara N., Kawana M., Kasanuki H.: A 3-hydroxy-3-methylglutaryl
coenzyme A reductase inhibitor, cerivastatin, suppresses production of
matrix metalloproteinase-9 in human abdominal aortic aneurysm wall. J
Vasc Surg 2002, 36: 158-163.
43. Nazarewski S.: Wyniki chirurgicznego leczenia miażdżycy tętnic kończyn
dolnych u chorych z cukrzycą. Rozprawa doktorska. Akademia Medyczna
w Warszawie, 1990.
44. Ouriel K.: Peripheral arterial disease. Lancet 2001, 358: 1257-1264.
45. Parker R.A., Huang Q., Tesfamariam B.: Influence of 3-hydroxy-3-
-methylglutaryl-CoA (HMG-CoA) reductase inhibitors on endothelial
nitric oxide synthase and the formation of oxidants in the vasculature.
Atherosclerosis 2003, 169: 19-29.
46. Pasierski T., Gaciong Z.: Rozwój i regresja miażdżycy. w: Angiologia, red.
Pasierski T., Gaciong Z., Torbicki A., Szmidt J., Wydawnictwo Lekarskie
PZWL, Warszawa, 2004, 50-58.
47. Pedersen T.R., Kjekshus J., Pyörälä K., Olsson A.G., Cook T.J., Musliner
T.A., Tobert J.A., Haghfelt T.: Effect of simvastatin on ischemic signs and
66
59. Walter D.H., Rittig K., Bahlmann F.H., Kirchmair R., Silver M., Murayama
T., Nishimura H., Losordo D.W., Asahara T., Isner J.M.: Statin therapy
accelerates reendothelialization: a novel effect involving mobilization
and incorporation of bone marrow-derived endothelial progenitor cells.
Circulation 2002, 105: 3017-3024.
60. Wojtowicz-Praga S.M., Dickson R.B., Hawkins M.J.: Matrix metalloproteinase
inhibitors. Invest New Drugs 1997, 15: 61-75.
Wyszukiwarka
Podobne podstrony:
Czynniki ryzyka żylnej choroby zakrzepowo, ###Chirurgia materiały
choroba zakrzepowa, 6 ROK, CHIRURGIA, 6 rok
Zakrzepica żył głębokich, Chirurgia(1)
Powikłania zakrzepowo zatorowe w chirurgii
Chirurgia W4 Patofizjologia zakrzepicy żg, Chirurgia(1)
Leczenie zakrzepowego zapalenia żył powierzchownych kończyn dolnych, CHIRURGIA NACZYNIOWA ═════════
Zakrzepica żył głębokich kończyn, Chirurgia(1)
24. Zakrzepowo-zarostowe stwardnienie tętnic, ratownictwo med, Chirurgia urazowa
29. ZAKRZEPICA ŻYŁ GŁĘBOKICH, ratownictwo med, Chirurgia urazowa
Powikania zakrzepowo zatorowe w chirurgii
Zapobieganie pooperacyjnej zakrzepicy żylnej - Fibak, Chirurgia(1)
praca całość popr, V rok, Chirurgia, żylna choroba zakrzepowo-zatorowa
Zapobieganie pooperacyjnej zakrzepicy żylnej - 9, Chirurgia(1)
Powikłania zakrzepowo zatorowe w chirurgii 2
Chirurgia naczyniowa W3 13 01 2015 Zakrzepica żył głębokich
Leczenie zakrzepicy żył głebokich, 1.Lekarski, III rok, Chirurgia, Choroby wewnętrzne
Mała chirurgia II Sem IV MOD
13 zakrzepowo zatorowa
więcej podobnych podstron