skanuj0021 (Kopiowanie)

Reakcje I rzędu
Równanie trzeciego pierwiastka
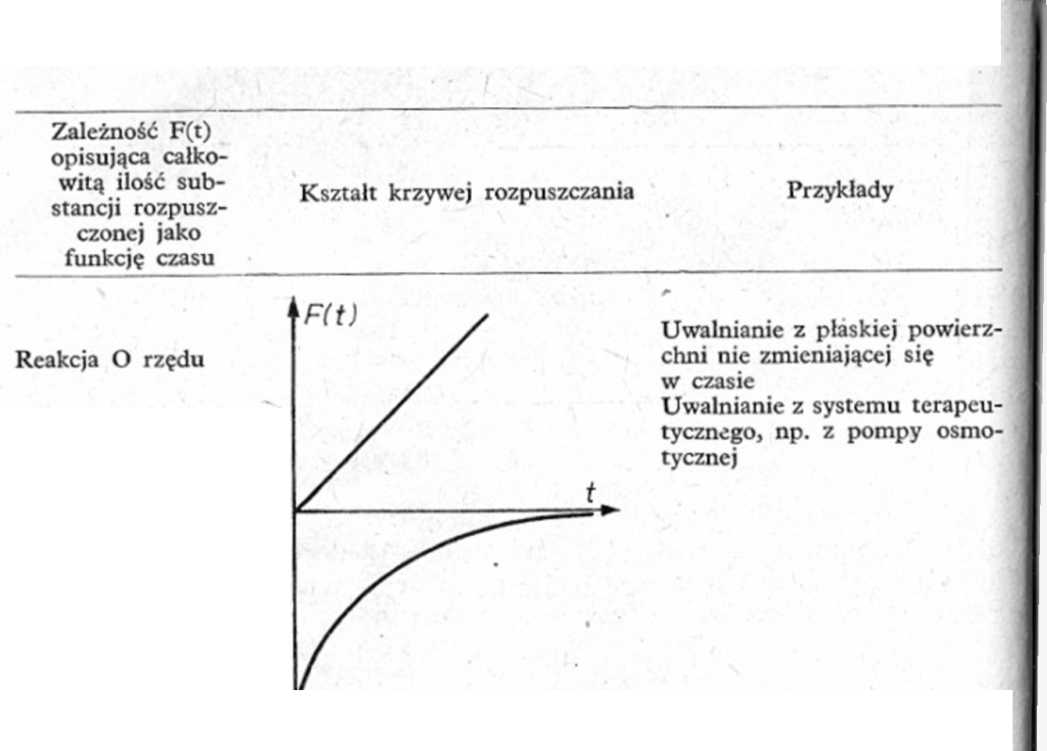
Uwalnianie z pojedynczych cząstek o jednakowej wielkości i kształcie lub z aglomeratów złożonych z cząstek o jednakowej wielkości i kształcie
Równanie drugiego pierwiastka
Rozkład logarytmi-czno-normalny
Funkcja RRSBW

Uwalnianie kontrolowane szybkością dyfuzji z tabletki szkieletowej (z chwilą rozpuszczenia substancji leczniczej w jej wnętrzu)
Uwalnianie z maści
Krzywa rozpuszczania o kształcie sigmoidalnym w przypadku uwalniania z tabletek rozpadających się
Uwalnianie z różnych postaci leku (krzywe rozpuszczania o różnorodnym kształcie)
Ryc. 3.10. Rodzaje funkcji algebraicznych opisujących proces uwalniania substancji leczniczej z postaci leku ,
40 Zarys biofarmacji
W normach farmakopealnych określa się ilość substancji leczniczej, jaka powinna uwolnić się z tabletki lub kapsułki po upływie określonego czasu w ściśle zdefiniowanych warunkach doświadczenia (rodzaj rozpuszczalnika, szybkość obrotów mieszadła lub koszyczka, temperatura).
3.5. Korelacja wyników badań in vitro i in vivo
Do właściwej oceny biofarmaceutycznej leku wymagana jest korelacja odpowiednich parametrów uzyskanych z wyników badań in vivo z odpowiednimi parametrami uzyskanymi w badaniu szybkości rozpuszczania in vitroy czyli wykazanie zależności między tymi wielkościami.
Warunkiem dobrej korelacji jest możliwie wierne naśladowanie warunków występujących in vivo w doświadczeniu in vitro. Aparatura do prowadzenia badań in vitro musi pozwalać na uzyskiwanie powtarzalnych wyników, a badania na ludziach muszą być prowadzone na wystarczająco dużej liczbie osób, z możliwością zastosowania właściwej oceny statystycznej.
Dane in vivo, które można korelować z danymi in vitro:
1. Stężenie substancji leczniczej we krwi (osoczu, surowicy) po określonym czasie t.
2. Maksymalne stężenie substancji leczniczej we krwi (osoczu, surowicy)
Cmoks.*
3. Powierzchnia pod krzywą zmian stężenia substancji leczniczej we krwi (osoczu, surowicy) obliczona dla przedziału czasu od t = 0 do t = oo.
4. Stała szybkości procesu wchłaniania oraz biologiczny okres półtrwa-nia fo,5 (*5o%) obliczony ze stężenia substancji leczniczej we łowi lub jej ilości wydalonej z moczem.
5. Całkowita ilość substancji leczniczej wydalonej z moczem.
6. Stała szybkości eliminacji.
7. Ilość substancji leczniczej wchłoniętej, wyrażona w procentach, jako funkcja czasu uzyskana z badań stężenia leku we krwi lub wydalania /. moczem.
Dane powyższe można korelować z danymi uzyskanymi w badaniach in vitro:
1. Czas potrzebny do rozpuszczenia określonego procentu dawki substancji leczniczej (np. 20%, 50%, 63,2%, 80%).
2. Ilość substancji rozpuszczonej w danym czasie lub jej stężenie w roztworze.
3. Procent substancji rozpuszczonej.
4. Stała szybkości lub czas połowicznego rozpuszczania.
Na ogół uważa się, że czas potrzebny, aby połowa obecnej w postaci leku substancji leczniczej uległa rozpuszczeniu, jest najlepszym parametrem do korelacji danych, ponieważ wartość ta jest miarą wartości średnich dla rozpuszczania in vitro i użycie jej nie wymaga kinetycznej interpretacji danych. Jeżeli proces wchłaniania jest kontrolowany szybkością rozpusz-
Uwalni anie substancji leczniczej 41
Wyszukiwarka
Podobne podstrony:
skanuj0004 82. Reakcje U rzędu przy jednakowych stężeniach początkowych substratów (rozwiązanie równ
skanuj0042 (Kopiowanie) Reakcje utleniania substancji leczniczej to przede wszystkim hydroksylacja c
skanuj0117 (Kopiowanie) o ile są nierozpuszczalne, kontrolują szybkość uwalniania substancji 1 nicze
skanuj0031 (Kopiowanie) 4.2.6. Pinocytoza Pinocytoza jest jedynym rodzajem transportu, w którym cząs
skanuj0008 (Kopiowanie) wego do centralnego, przy czym w obydwu przypadkach są to stałe reakcji I rz
skanuj0070 (Kopiowanie) w którym stałe B i A są określone równaniami: FD (9.8) FD . _ TTe (9.9)
skanuj0014 (Kopiowanie) 3. UWALNIANIE SUBSTANCJI LECZNICZEJ Z POSTACI LEKU Proces wchłaniania poprze
skanuj0020 (Kopiowanie) W tym przypadku szybkość uwalniania jest większa na początku procesu rozpusz
skanuj0061 (Kopiowanie) równań: . Ap+B* 21 A+B (8.25) (8.26) k12 = a+p—k21—ku (8.27) 0,693 =
skanuj0072 (Kopiowanie) tecznie dokładnie za pomocą równania: (9.16)wo<T<. Mówiąc prościej, po
skanuj0091 (Kopiowanie) Uwalnianie substancji leczniczej z podłoża lipidowego zależy od j: temperatu
skanuj0120 (Kopiowanie) Ryc. 9.65. Profil uwalniania chlorku potasowego z doustnego systemu terapeut
skanuj0127 (Kopiowanie) Dawka mgSposób wykorzystania podanych równań ilustrują następujące przykłady
skanuj1 Równania ._rozwiązanie/pierwiastek strona lewa równania X + 3 = 10 strona prawa równania zmi
b) Reakcja II rzędu: równanie kinetyki reakcji = kc skąd k = dc c c°c Dla c 1
Uzupełnij równania chemiczne, określ typ reakcji, podaj substraty produkty, pierwiastki i związki
więcej podobnych podstron