317

A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO
ISBN D4H1II ł-7. © by »N TOS >«}
10 8 RÓWNOWAGI FAZOWE W UKŁADACH JEDNOSKŁADNIKOWYCH
Reakcji (b) towarzyszy natomiast wzrost objętości, gdyż rośnie liczba cząsteczek w fazie gazowej. Prawo przekory informuje nas, że jeśli zwiększymy ciśnienie w ułudzie znajdującym się w stanic równowagi, to układ, podążając do nowego stanu równowagi, będzie zmniejszać swoją objętość, gdyż. w ten sposób przeciwstawia się działaniu zewnętrznemu zmierzającemu do podwyższenia ciśnienia. Zmniejszenie objętości oznacza, że musi zajść reakcja związana ze zmniejszeniem liczby cząsteczek w fazie gazowej, a więc reakcja syntezy amoniaku w przypadku reakcji (a) lub wytworzenia CO> z tlenku węgla w przypadku reakcji (b).
Do tego samego wniosku dojdziemy także, rozważając prawo działania mas. Przypuśćmy, że w warunkach danego ciśnienia i temperatury ustaliła się równowaga chemiczna pomiędzy azotem, wodorem i amoniakiem, lak żc możemy napisać:
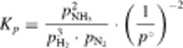
(i\ ł_ j^, »
\P ) Ph, ■ PN: 4 \p j 4
Przypuśćmy następnie, że ciśnienie całkowite w układzie, np. wskutek zmniejszenia jego objętości przy zachowaniu tej samej masy. wzrosło dwukrotnie. Następuje wówczas dwukrotny wzrost wszystkich ciśnień cząstkowych. Iloraz ciśnień przyjmuje teraz wartość
<2 Psu,):
mniejszą od wartości Kr, co wskazuje, żc układ nic znajduje się już w stanic równowagi. Dla jej odzyskania musi wzrosnąć licznik />JHi ilorazu, a zmaleć mianownik Ph, Ps ■ czyli musi nastąpić łączenie się wodoru z azotem z utworzeniem amoniaku. Przewidywaliśmy to już. uprzednio, opierając się na regule le Chatcliera-Brauna,
10.8. RÓWNOWAGI FAZOWE W UKŁADACH JEDNOSKŁADNIKOWYCH 10.8 I. RÓWNOWAGA CIECZ-PARA I CIAŁO STAŁE-PARA
Weźmy pod uwagę cylinder z dającym się przesuwać tłokiem, schematycznie przedstawiony na rys. 10.2. zawierający wodę ciekłą, ponad którą znajduje się przestrzeń wypełniona paią wodną. Doświadczenie uczy, że przesuwając tłok w górę lub w dół, można spowodować bądź parowanie wody. bądź tez przemianę pary wodnej w ciecz <kondensację). Obydwa procesy, stanowiące przemiany fazowe, prowadzą do stanu końcowego, któremu odpowiada określone ciśnienie charakterystyczne dla danej temperatury. Opis ten wskazuje, ze mamy tu do czynienia z typowym procesem dającym się odwrócić, dochodzącym do stanu równowagi. Można zatem napisać
H.O.. v* H O,,
(HhOIC| oznacza cząsteczkę wody w fazie ciekłej, H>0(|:, — w fazie gazowej.) W'a
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« .•»•»».--u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} i 10 PROMIENIE
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II **. © by »N TOS >«} 4 a CZĄSTEC
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 4 9 CZ
A HibUl. IM1U.1 ,Vv»« rw, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 18
A HibUl. IM1U.1 ,Vv»« r„, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 7 CIAŁ
A HibUl. IM1U.1 ,Vv». --u, r 1, buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 250
A HibUl. IM1U.1 ,Vv»« .•»•»»«.--u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 360
A HibUl. IM1U.1 ,Vv»« r.,, r ), buui :uO ISBN D4H1II **. © by »N TOS >«} 374 12
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 12 UTLENIA
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 12 8
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 136 2EL£ I
A HibUl. IM1U.1 ,Vv»« raa, r ), buui :uO ISBN D4H1II ł-7. © t>< WN TOS >«
A HibUl. IM1U.1 ,Vv.. r ), buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 472
A HibUl. IM1U.1 ,Vv»« r.., r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 15 12
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II t-7. © by »N TOS >«} 12
20 A HibUl. IM1U.1 .Vvu .•»•»»«.--u, r ), buui :uO ISBN D4H1II t-7. © by »N TOS »*} 2 iĄDRO
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 69 3 5 OftB
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 3 13 WŁAŚCI
A HibUl. IM1U.1 .Vv»i r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 118
więcej podobnych podstron