141

A HibUl. IM1U.1 ,Vv»« r ), buui :uO
ISBN D4H1II **. © by »N TOS >«}
4 a CZĄSTECZKI WlELOATOMOWE HYBRYDrZAOA OftBITALI 141
W tym rozdziale ograniczymy się tylko do raczej intuicyjnego pokazania, na czym polega konieczność wprowadzenia hybrydyzacji orbitali oraz w jaki sposób ją wykorzystujemy do tworzenia orbitali cząsteczkowych. Posłużymy się w tym celu przykładem cząsteczki metanu. CII* Jest to cząsteczka, w której jądra atomu wodoru zajmują naroża czworościanu foremnego (tetraedru), a jądro atomu węgla jego środek (rys. 4.9). Kąty pomiędzy wiązaniami łączącymi atom węgla z atomami wodoru wynoszą 1(>9 28'. a wszystkie wiązania są równocenne.
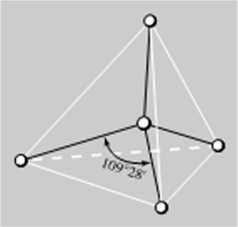
Rys. O. Struktura pr/cstizeim* cząsteczki CH(
Zgodnie z tym. co powiedziano w poprzednich paragrafach, orbitale cząsteczkowe w cząsteczce metanu powstają wskutek nakładania się orbitali walencyjnych atomu węgla: 2\c, 2p, r, 2p. c i 2p:£. z orbitalami walencyjnymi czterech atomów wodoru. Tc ostatnie oznaczymy symbolami: l.vMi. 1%*. lsM i i ls» i- Wyobraźmy sobie najpierw, ze np. oibital l.vH.i atomu wodoru oznaczonego liczb;] I nakłada się z oibiudem 2vc atomu węgla (nakładanie orbitali s przedstawiono na rys. 4.1a). następnie, że oibital ls,l2 atomu wodoru 2 nakłada się z orbitalem 2pt.c atomu węgla, urbtlal lsHJ atomu wodoru 3 z orbitalem 2/Vc > orbital l%4 atomu wodoru 4 — z orbitalem 2p; C atomu węgla (nakładanie orbitalu s i orbilalu p przedstawiono na rys 4.Id). Każda para nakładających się oibitali wytwarzałaby oibital cząsteczkowy wiążący i orbital cząsteczkowy antywią-zący. Zajęcie lak utworzonych czterech orbitali wiążących przez cztery pary elektronowe (łączna liczba elektronów walencyjnych jednego atomu węgla i c/teiech atomów woduru wynosi 8) spowodowałoby utworzenie czterech wiązań między atomem węgla a czterema atomami wodoru. Takie rozumowanie wyjaśniałoby nam w zadowalający sposób, dlaczego atom węgla przyłącza cztery atomy wodoru. Można jednak łatwo wykazać, że utworzone w opisany sposób cztery wiązania różniłyby się swoimi właściwościami od właściwości wiązań w rzeczywistej cząsteczce metanu. Po pierwsze należałoby się spodziewać, zc wiązanie utworzone przez orbital 2s,- atomu węgla i orbital hą atomu wodoru będzie mieć inne właściwości niż wiązanie utworzone przez, orbitale 2/;,,c. 2p,_c. i 2p:.c atomu węgla oraz orbitale l.v atomów wodoru. I-ncrgia odpowiadająca orbitalowi atomowemu 2s jest bowiem różna od eneigit odpowiadającej orbitalom 2p W rzeczy
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 4 9 CZ
A HibUl. IM1U.1 ,Vv»« .•»•»».--u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} i 10 PROMIENIE
A HibUl. IM1U.1 ,Vv». --u, r 1, buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 250
A HibUl. IM1U.1 ,Vv»« .•»•»»«.--u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 360
A HibUl. IM1U.1 ,Vv»« r.,, r ), buui :uO ISBN D4H1II **. © by »N TOS >«} 374 12
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 12 UTLENIA
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 12 8
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 136 2EL£ I
A HibUl. IM1U.1 ,Vv.. r ), buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 472
A HibUl. IM1U.1 ,Vv»« r.., r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 15 12
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II t-7. © by »N TOS >«} 12
20 A HibUl. IM1U.1 .Vvu .•»•»»«.--u, r ), buui :uO ISBN D4H1II t-7. © by »N TOS »*} 2 iĄDRO
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 69 3 5 OftB
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 3 13 WŁAŚCI
A HibUl. IM1U.1 .Vv»i r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 118
A HibUl. IM1U.1 .Vv»i r.., r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 120
A HibUl. IM1U.1 .Vv»i --u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 132
A HibUl. IM1U.1 ,Vv»i r.», r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 164 5
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 5 4 CHARAKT
więcej podobnych podstron