153
A HibUl. IM1U.1 ,Vv»« .•»•»».--u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*}
i 10 PROMIENIE KOWALENCYJNE, DŁUGOŚĆ I ENERGIA WIĄZANIA 153
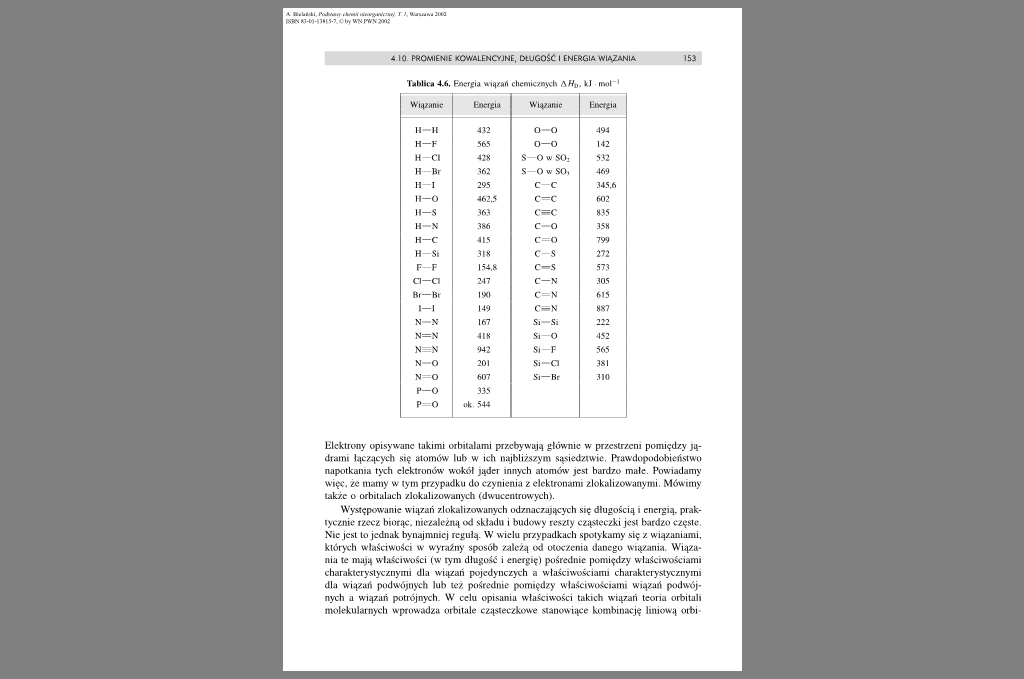
Tablica 4.6. Energia wiązali chemicznych AWb. kj nwl 1
|
Wiązanie |
Energia |
Wiązanie |
Energia |
|
Ił—II |
432 |
0-0 |
494 |
|
X 1 r |
565 |
o—o |
142 |
|
H—Cl |
42* |
s—0 W SO: |
532 |
|
H—Br |
362 |
S—0 w SO. |
469 |
|
H—I |
295 |
c-c |
345.6 |
|
H—O |
462.5 |
C—c |
602 |
|
II—s |
363 |
CSC |
835 |
|
H—N |
386 |
c—o |
.358 |
|
U 1 r |
415 |
c=o |
799 |
|
H —Si |
318 |
c-s |
272 |
|
F—F |
154.8 |
c—s |
573 |
|
a—a |
247 |
c—N |
305 |
|
Bi —Bi |
190 |
C=N |
615 |
|
1—1 |
149 |
C=N |
887 |
|
N—N |
167 |
Si—Si |
2>2 |
|
N=N |
418 |
Si—O |
452 |
|
N=N |
942 |
Si —F |
565 |
|
C 1 7. |
201 |
Si—O |
381 |
|
N=0 |
607 |
Si—Br |
310 |
|
P—0 |
335 | ||
|
p=o |
ok. 544 |
lilcktrony opisywane takimi orbitalami przebywają głównie w przestrzeni pomiędzy jądrami łączących się atomów lub w ich najbliższym sąsiedztwie. Prawdopodobieństwo napotkania tych elektronów wokół jąder innych atomów jest bardzo małe. Powiadamy więc. ze mamy w tym przypadku do czynienia z elektronami zlokalizowanymi. Mówimy także o orbitalach zlokalizowanych (dwucentrowych).
Występowanie wiązań zlokalizowanych odznaczających się długością i energią, praktycznie rzecz biorąc, niezależną od składu i budowy reszty cząsteczki jest bardzo częste. Nic jest to jednak bynajmniej regułą. W wielu przypadkach spotykamy się z wiązaniami, których właściwości w wyraźny sposób zalezą od otoczeniu danego wiązania. Wiązania te mają właściwości (w tym długość i energię) pośrednie pomiędzy właściwościami charakterystycznymi dla wiązań pojedynczych a właściwościami charakterystycznymi dla wiązań podwójnych lub też pośrednie pomiędzy właściwościami wiązań podwójnych a wiązań potrójnych W celu opisania właściwości takich wiązań teona orbitali molekularnych wprowadza orbitale cząsteczkowe stanowiące kombinację liniową otbi
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II **. © by »N TOS >«} 4 a CZĄSTEC
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 4 9 CZ
A HibUl. IM1U.1 ,Vv». --u, r 1, buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 250
A HibUl. IM1U.1 ,Vv»« .•»•»»«.--u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 360
A HibUl. IM1U.1 ,Vv»« r.,, r ), buui :uO ISBN D4H1II **. © by »N TOS >«} 374 12
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 12 UTLENIA
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 12 8
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 136 2EL£ I
A HibUl. IM1U.1 ,Vv.. r ), buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 472
A HibUl. IM1U.1 ,Vv»« r.., r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 15 12
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II t-7. © by »N TOS >«} 12
20 A HibUl. IM1U.1 .Vvu .•»•»»«.--u, r ), buui :uO ISBN D4H1II t-7. © by »N TOS »*} 2 iĄDRO
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 69 3 5 OftB
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 3 13 WŁAŚCI
A HibUl. IM1U.1 .Vv»i r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 118
A HibUl. IM1U.1 .Vv»i r.., r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 120
A HibUl. IM1U.1 .Vv»i --u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 132
A HibUl. IM1U.1 ,Vv»i r.», r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 164 5
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 5 4 CHARAKT
więcej podobnych podstron