234 [1024x768]

KLASYFIKACJA ROZTWORÓW
stąd S8 * O
Roztwory atermalne powstają z cząsteczek składników podobnych do siebie pod względem chemicznym (np. roztwory węglowodorów), ale różniących się znacznie objętościami molowymi.
Istnieje szereg wyrażeń na entropię mieszania roztworów atermalnych; ograniczymy się jedynie do przedstawienia wyrażeń, wynikających z modelu swobodnej objętości.
Jak wiemy, dla izotermiczncgo rozprężania się gazu doskonałego słuszne jest równanie (3.58):
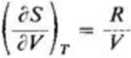
skąd (dla T = const): d S = /?dln V
oraz
AS = S2~S, = /*ln-£- (3.154)
' i
Oujktońć
SWOKODSA
Przez swobodną objętość danego składnika będziemy rozumieli różnicę pomiędzy objętością naczynia, u- którym zawarty jest 1 mol danej substancji, a objętością własną 1 mola cząsteczek. Oznaczmy cząstkowe objętości molowe rozpuszczalnika przez Vx, a substancji rozpuszczonej przez V7, zaś ich objętości swobodne za pomocą indeksu f: V\, V'2.
W modelu swobodnej objętości proces mieszania przedstawia się jako proces rozprężania się 1 mola składnika od swojej objętości swobodnej (równej xx do całkowitej objętości swobodnej roztworu (równej xx V\ +x2 i^). Zgodnie z równaniem (3.154) otrzymamy na entropię mieszania roztworu atermalnego wyrażenie:
/?(nx In
V\
X2Vt2
xlV\+x2V
(3.155)
Roztwory regularne
Pojęcie roztworu regularnego wprowadził do chemii w r. 1929 Hildebrandt dla określenia klasy licznych roztworów, w których entropia mieszania spełnia 1$ Chemia fizyczna dla przyrodników
Wyszukiwarka
Podobne podstrony:
232 [1024x768] Klasyfikacja roztworów Spośród różnych klasyfikacji roztworów , najogólniejszą klasyf
Poprzez intensywne mieszanie roztworu następuje przenoszenie ekstrahowanych składników z surówki do
320 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 329 przestrzeni środkowej, a stąd do przestrzeni k
271 [1024x768] 280 ROZTWORY I RÓWNOWAGI FAZOWE jeżeli nie takie same, to w każdym razie bardzo podob
273 [1024x768] 282 ROZTWORY I RÓWNOWAGI FAZOWI; Przykład Prężności pary chlorobenzenu i bromobenzenu
274 [1024x768] WŁAŚCIWOSO ROZTWORÓW 283 mm Hg. Obliczyć masę cząsteczkową benzaldehydu. Zakładamy, ż
275 [1024x768] 284 ROZTWORY I RÓWNOWAGI FAZOWE czystego rozpuszczalnika i roztworu. Punkt krzepnięci
276 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 285 przy czym m2 — masa substancji rozpuszczonej, m, — masa
277 [1024x768] 286 ROZTWORY I RÓWNOWAGI FAZOWE — Iń jc, =A//. f dr r !rł A Hw / 1 r r,a//* / r-r,
280 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 289 Obliczmy bracę maksymalną dla procesu przeniesienia I mola
281 [1024x768] 290 ROZTWORY J RÓWNOWAGI FAZOWE W tym przypadku nie ma znaczenia, czy para nad roztwo
282 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 291 rtijRT ^ m2RT Mty ’ * " /IV 3
283 [1024x768] 292 ROZTWORY I RÓWNOWAGI FAZOWE (4.37) gdzie //(r„c„, — ciśnienie osmotyczne rzeczywi
285 [1024x768] 294 ROZTWORY 1 RÓWNOWAGI FAZOWE gdzie: L, — ciepło sublimacji, a Lm —ciepło parowania
289 [1024x768] 298 ROZTWORY I RÓWNOWAGI FAZOWF nika w fazie a i 0, a a* i af są aktywnościami tego s
291 [1024x768] 300 ROZTWORY I RÓWNOWAGI FAZOWF.Równowagi ciecz—paradla układów dwuskładnikowych Na r
293 [1024x768] 302 ROZTWORY I RÓWNOWAGI FAZOWEDestylacja Przeanalizujmy dokładniej prosty diagram wr
295 [1024x768] 304 ROZTWORY I RÓWNOWAGI FAZOWE mniej lub bardziej trwałych związków pomiędzy składni
297 [1024x768] 306 ROZTWORY I RÓWNOWAGI FAZOWE przeciwległego do wierzchołka odpowiadającego czystem
więcej podobnych podstron