370 [1024x768]

OGNIWA GALWANICZNE 379
(5102)
co wynika z równości r+ = J —
Z równania (5.102) wynika, że na wartość potencjału dyfuzyjnego na granicy zetknięcia dwóch roztworów elektrolitów, wywierają wpływ dwa czynniki: stosunek aktywności elektrolitu po obydwu stronach membrany oraz różnica w liczbach przenoszenia anionu i kationu.
Korzystając z tego, że liczby przenoszenia elektrolitu można wyrazić za pomocą ruchliwości (5.14) i (5.27):
(5.103)
■*+ u+
* ~ * u++u-
otrzymujemy uproszczoną postać tzw. równania Hendersona na potencjał dyfuzyjny na granicy zetknięcia dwóch roztworów tego samego elektrolitu o różnych stężeniach:
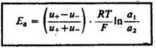
(5.104)
Równanie
Hendersona
Przykład
Obliczyć w temp. 25*C potencjał dyfuzyjny w ogniwie z przenoszeniem o schemacie:
Ag, AgO i N*a (c, - 0,01 M) NaCI (ca - 0.001 M)! AgO. Ag
Liczba przenoszenia jonów sodowych w tych roztworach wynosi t. - 0.392.
W celu rozwiązania tego zadania moglibyśmy posłużyć sic gotowym równaniem Hendersona (5.104), wyprowadzonym dla elektrod 1 rodzaju, i w którym w związku z zastosowaniem do elektrod II rodzaju (Q_/Aga, Ag) należy zmienić znak na przeciwny. Wybierzemy jednak inną drogę, która umożliwi nam prześledzenie otrzymywania wartości potencjału dyfuzyjnego z rozważań termodynamicznych' nad samym procesem przenoszenia elektrolitu przez membranę.
Przy przepływie przez ogniwo ładunku I faradaja. nastąpi (rozważając wyłącznie proces przenoszenia przez membranę) przeniesienie t- gramorównoważników jonów CI" przez membranę z roztworu o stężeniu do roztworu o stężeniu ct zaś r, gramorównoważników jonów Na* w przeciwną stronę. Ten kierunek przenoszenia związany jest z kierunkiem przepływu elektronów w obwodzie zewnętrznym od elektrody lewej ku prawej. Procesy te możemy przedstawić schematycznie:
r.a-(c,)- r-a-(c)
_r»Na*(C|) - t+ Na* (o)_
f-Cl'(ci) + r, Na* (c,) = /-a~(c,) + /.Na*(ca)
Wyszukiwarka
Podobne podstrony:
384 [1024x768] OGNIWA GALWANICZNE 393E°-~ !n(H*)! • (SOi-) = E°--2F In yl • y. ’
347 [1024x768] Ogniwa galwaniczneSilą elektromotoryczna ogniw galwanicznych W czasie elektrolizy wod
348 [1024x768] OGNIWA GALWANICZNE 357 Na zaciskach elektrod platynowych pojawi się teraz różnica pot
350 [1024x768] OGNIWA GALWANICZNE 359 Na elektrodzie ujemnej zachodzi proces utlenienia,
352 [1024x768] OGNIWA GALWANICZNE 361 Elektrochemiczny schemat elektrody wodorowej zapisujemy w post
354 [1024x768] OGNIWA GALWANICZNE 3^3 Jeżeli z drugiej strony, mówimy o SEM półogniw: Zn/Zn2 +Pt. ci
356 [1024x768] OGNIWA GALWANICZNE 365Rodzaje elektrod Elektrody gazowe Należą tu elektroda wodorowa,
358 [1024x768] OGNIWA GALWANICZNE 347 Elektrody oksydacyjno-redukcyjne Nazwa tego typu elektrod jest
360 [1024x768] OGNIWA GALWANICZNE 369 Zatem: . r. K crM- iQH=i [ +(fP)+-(irfH Ponieważ roztwór chinh
362 [1024x768] OGNIWA GALWANICZNE 371 Znaleźć aktywność oraz współczynnik aktywności UCI3 w roztworz
364 [1024x768] OGNIWA GALWANICZNE Klucz elektrolityczny eliminuje potencjał dyfuzyjny, występujący n
366 [1024x768] OGNIWA GALWANICZNE przepływowi przez ogniwo 1F towarzyszyć będzie przeniesienie t+ gr
372 [1024x768] OGNIWA GALWANICZNE Różniczkując to równanie względem temperatury (przy stałym ciśnien
374 [1024x768] OGNIWA GALWANICZNE 383 SEM ogniw zalety na ogól znacznie od temperatury; zależność od
376 [1024x768] OGNIWA GALWANICZNE 385 w którym doświadczalnie mierzona wielkość £ jest liniową funk
378 [1024x768] OGNIWA GALWANICZNE 387 którego SEM zgodnie z reakcją ogniwa: 1/2 H2(ł, + 1/2 Hg.CI,,.
382 [1024x768] OGNIWA GALWANICZNE 391 zatem logyt = -0,5091 • j/cot - 2 log Yz - 2 0,5091
390 [1024x768] OGNIWA GALWANICZNE 399 Przyrównując równania (5.136) i (5.137) otrzymujemy: d In (y±
392 [1024x768] OGNIWA GALWANICZNE Tak wiec «■ lny* **($-!)+ ^ ($-l)dlnm -logy* - 2,41 • e* = 2,41 (1
więcej podobnych podstron