413 [1024x768]
4Z2
ELEKTROCHEMIA
ją zaniedbać i wtedy B = b, zaś pH wyrazi się wzorem: pH *= pAC.+log ab-b--0,5091 \[J + C 1
Układ z częściowo zobojętnionym słabym kwasem jest równoważny mieszaninie wolnego kwasu o stężeniu a—b i jego soli o stężeniu b:
pH « ptf. + log -0,5091 • l// +C • /
stęż. kwasu r
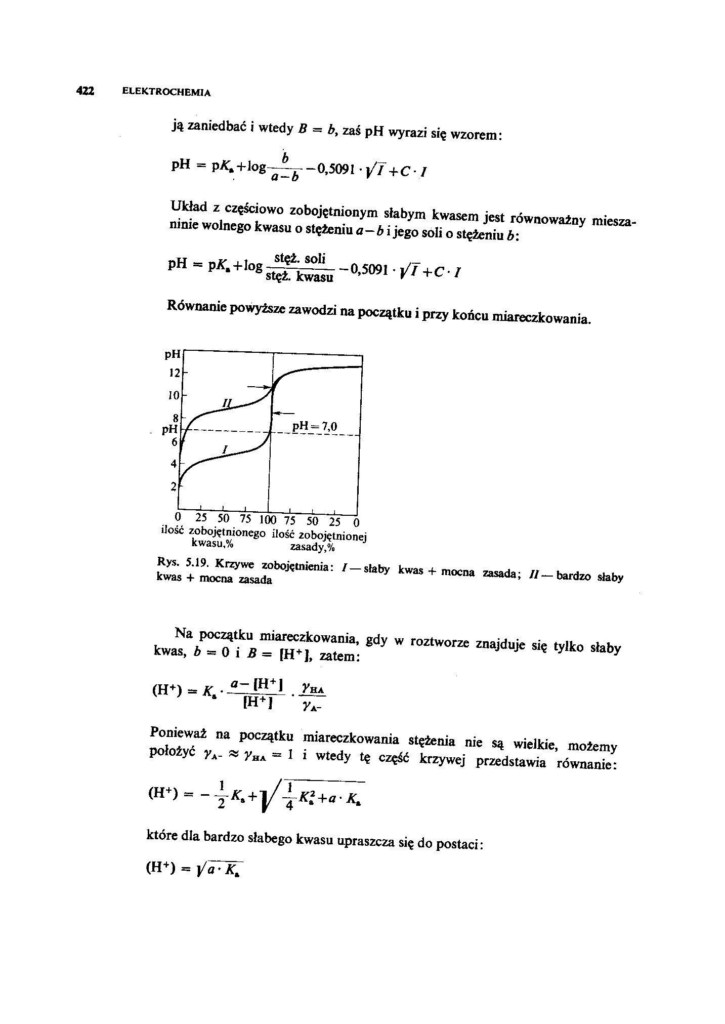
Równanie powyższe zawodzi na początku i przy końcu miareczkowania.
|
pH - 7,0 | |
0 25 50 75 100 75 50 25 0
ilość zobojętnionego ilość zobojętnionej kwasu.% zasady,%
mocna zasada; //—bardzo słaby
Rys. 5.19. Krzywe zobojętnienia: / — slaby kwas kwas + mocna zasada
Na początku miareczkowania, gdy w roztworze znajduje się tylko słaby kwas, b = 0 i B — (H+J, zatem:
(Hł)
Yua.
Ya-
Ponieważ na początku miareczkowania stężenia nie są wielkie, możemy położyć yA. a yHA = 1 i wtedy tę część krzywej przedstawia równanie:
(H*)- ~^K.+y -jKl+a K
które dla bardzo słabego kwasu upraszcza się do postaci:
(Hł) -
Wyszukiwarka
Podobne podstrony:
420 [1024x768] POLARYZACJA ELEKTROLITYCZNA I NADNAPIĘCIE 429 (5.181) zaś szybkość procesu rozpuszcza
361 [1024x768] 370 ELEKTROCHEMIARodzaje ogniw Ogniwa tworzenia Nazwą tą określa się dowolne ogniwo,
421 [1024x768] 430 ELEKTROCHEMIA Tak jest jednakże jedynie wtedy, gdy potencjał elektrody ma wartość
427 [1024x768] 436 ELEKTROCHEMIA w porównaniu do pierwszego (gdyż rj < 0); wtedy hF “* KT V i - i
skrypt025 (2) 25 W gazach o ciśnieniu atmosferycznym. na i cm2 powierzchni elektrody »ja siły znikom
skanuj0020 42 WIELOZNACZNOŚĆ TERMINU NAUKA zbliżyć ją do teorii poznania. Wtedy wypada jej zajmować
strona (05) Już uj rękach pani bobrzyny lśni serweta jak śnieg biała, elektrycznym ją żelazkiem prze
widmo elektromagnetyczne 1 1024x724 WIDMO ELEKTROMAGNETYCZNE PROMIENIOWANIE NIE JONIZUJĄCE PROMIENIO
305 [1024x768] Właściwościroztworów elektrolitów Charakterystyka roztworów elektrolitów Roztwory ele
306 [1024x768] 316 ELEKTROCHEMIAPrzewodnictwo elektrolitów Przewodnictwo W przeciwieństwie do metali
309 [1024x768] 318 ELEKTROCHEMIA do stężenia równego zeru, Kohlrausch wyznaczył tzw. przewodnictwa r
311 [1024x768] 320 ELEKTROCHEMIA Jeżeli stopień dysocjacji elektrolitu wynosi a, to stężenia reagent
315 [1024x768] 324 ELEKTROCHEMIAElektroliza Do pomiaru przewodnictw elektrolitów stosuje się prąd zm
319 [1024x768] 328 ELEKTROCHEMIA Liczba elektronów otrzymanych na anodzie w wyniku reakcji utleniani
325 [1024x768] 334 ELEKTROCHEMIA prawo o niezależnej wędrówce jonów napisać w postaci: A0 - F(u°+uZ)
więcej podobnych podstron