AMINOKWASY
Aminokwasy są podstawowymi elementami białek. Składaj się z: grupy aminowej, grupy karboksylowej, atomu wodoru oraz specyficznej dla każdego aminokwasu grupy R. Wszystkie te elementy skupione są wokół węgla a .
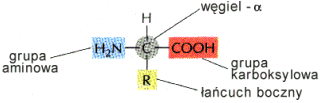
Centralny węgiel połączony jest z czterema różnymi podstawnikami, co powoduje, że jest on asymetryczny. Związane jest to z dwoma możliwymi ułożeniami grup otaczających węgiel.
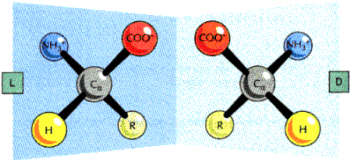
Te dwie formy nazywa się izomerami optycznymi. W przestrzeni trójwymiarowej nie jest możliwa zamiana ich w siebie bez zniszczenia struktury. Są one wzajemnymi odbiciami lustrzanymi. Wszystkie aminokwasy spotykane w organizmach żywych występuj w formie L dlatego, mówiąc o nich, pomija się ten element w nazwie: np. zamiast
o L-alaninie mówi się o alaninie.
W roztworze o pH=7 (obojętnym) aminokwasy występuj w formie jonów obojnaczych. Grupa aminowa posiada ładunek dodatni (NH3+), a grupa karboksylowa - ujemny (COO-). Tak formę nazywamy jonem obojnaczym. Gdy pH otoczenia ulegnie zmianie, zmienia się też stan jonizacji cząsteczki aminokwasu. Wraz ze wzrostem pH (zmniejszenie stężenia jonów H+), zaczyna przeważać forma o niezjonizowanej grupie NH3. Gdy pH spada (wzrost stężenia H+), grupa aminowa ulega jonizacji, podczas, gdy grupa karboksylowa przyjmuje formę COOH.
W białkach występuje zestaw 20 podstawowych aminokwasów. Ten zestaw jest jednolity dla całego świata ożywionego. Choć spotkać można również aminokwasy spoza podstawowej dwudziestki, s one głównie efektem modyfikacji posttranslacyjnych.
Aminokwasy różni się jedynie łańcuchami bocznymi (R) - reszta elementów pozostaje niezmieniona. Grupy boczne różnić się mogą:
kształtem , wielkością, ładunkiem elektrycznym, reaktywnością, zdolności do tworzenia wiązań wodorowych i hydrofobowych
Biorąc pod uwagę właściwości grupy R, aminokwasy można podzielić na: hydrofobowe i hydrofilowe, a w obrębie tej grupy dodatkowo na kwasowe, zasadowe i nienaładowane.
Aminokwasy hydrofobowe
Do tej grupy zaliczamy alaninę, której grupą boczną jest grupa metylowa. Trzy i czterowęglowe łańcuchy boczne posiadają walina, leucyna i izoleucyna. Izoleucyna charakteryzuje się obecności dwóch centrów aktywnych optycznie. Alifatyczny łańcuch boczny proliny zapętlony jest tak, że łączy się również z grupą aminową. Kolejny aminokwas - fenyloalanina - zawiera pierścień fenylowy połączony z grup metylenową (-CH2-).Łańcuchem bocznym tryptofanu jest pierścień indolowy połczony z grup metylową, wodorami i atomem azotu. Ostatnim aminokwasem z grupy hydrofobowych jest metionina. Zawiera ona w swej grupie bocznej atom siarki.
Ta grupa aminokwasów wykazuje silne właściwości hydrofobowe. Ta tendencja do unikania kontaktu z wodą i zdolność do grupowania się mają znaczenie dla stabilizacji struktury białek w środowisku wodnym.
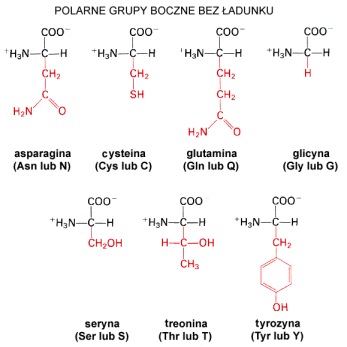
Aminokwasy polarne nie posiadające ładunku
Najprostszym aminokwasem w tej grupie jest glicyna - jej grupę boczną stanowi jedynie atom wodoru. W wyniku tego glicyna nie wykazuje czynności optycznej (nie jest asymetryczna). Tyrozyna posiada łańcuch boczny w postaci pierścienia aromatycznego z dołączoną grupą hydroksylową, która powoduje, że aminokwas ten charakteryzuje się dosyć dużą reaktywnością chemiczną. Cysteina zawiera w swej grupie bocznej atom siarki w postaci grupy hydrosulfidowej (tiolowa, sulfhydrylowa) (SH). Grupa ta jest silnie reaktywna i bierze udział w tworzeniu mostków dwusiarczkowych wpływających na strukturę białek. Kolejnymi aminokwasami polarnymi są seryna i treonina zawierające w alifatycznym łańcuchu bocznym grupy hydroksylowe. Podobnie jak w przypadku tyrozyny, grupy te powoduj wzrost reaktywności. Treonina, obok izoleucyny, jest jednym z dwóch aminokwasów posiadających dwa centra optyczne. Asparagina i glutamina, ostatnie z grupy, są pochodnymi asparaginianu i glutaminianu powstałymi w wyniku dołączenia grupy amidowej.
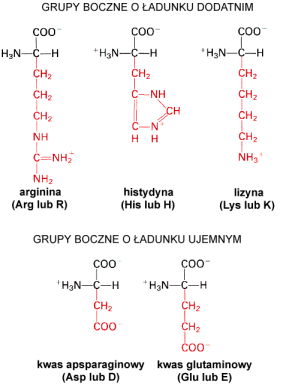
W środowisku o odczynie obojętnym lizyna i arginina mają ładunek dodatni, podczas gdy histydyna łatwo może przechodzić między ładunkiem dodatnim, a obojętnym. Właściwość ta jest wykorzystana w centrach aktywnych enzymów, gdzie histydyna zmieniając stany naładowania katalizuje powstawanie i zrywanie wiązań.
Do tej grupy należą tylko dwa aminokwasy o podobnej budowie: asparaginian (kwas asparaginowy) i glutaminian (kwas glutaminowy). Łańcuchy boczne tych aminokwasów w fizjologicznym zakresie pH posiadaj ładunek ujemny.
Aminokwasy egzogenne (ang. IAA - indispensable amino acids), nazywane też aminokwasami niezbędnymi - jest to grupa aminokwasów, które nie mogą być syntetyzowane w organizmie zwierzęcym i muszą być dostarczane w pożywieniu, w przeciwieństwie do aminokwasów endogennych. Żywienie pokarmami ubogimi w aminkowasy niezbędne może doprowadzić do zaburzeń chorobowych. Do aminkowasów niezbędnych dla człowieka zalicza się 8 aminokwasów, z 2 dodatkowymi (histydyna i arginina) u dzieci.
Aminokwasy egzogenne u człowieka (w nawiasach nazwy angielskie i ich oficjalne skróty), to:
fenyloalanina (phenylalanine, Phe) izoleucyna (isoleucine, Ile) leucyna (leucine, Leu) lizyna (lysine, Lys)
metionina (methionine, Met) treonina (threonine, Thr) tryptofan (tryptophan, Trp) walina (valine, Val)
U innych ssaków, zestaw aminokwasów egzogennych może być w części odmienny, np. dla kotów niezbędnym aminokwasem jest tauryna
1
Wyszukiwarka
Podobne podstrony:
aminokwasy
AMINOKWASY 7
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
8a Syntezy prostych aminokwasów
Wykład katabolizm azotu aminokwasów
aminokwasy 1
Metabolizm aminokwasów
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
cwiczenie 7 Aminokwasy id 125541
aminokwasy wersja IV
3 NOWY Aminokwasy II 2012 2013(1)
Aminokwasy
aminokwasy I
Aminokwasy dzielimy na
Aminokwasy
Aminokwasy i białka
Aminokwasy i białka 2
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
więcej podobnych podstron