
„ WPŁYW SELENU NA RÓWNOWAGĘ
OKSYDACYJNO -ANTYOKSYDACYJNĄ I
FUNKCJĘ KOMÓREK ŚRÓDBŁONKA”

Selen
pierwiastek chem. z grupy 16, powszechnie
występujący w skałach, minerałach, paliwach
naturalnych oraz materiale wulkanicznym.
liczba atomowa
34
masa atomowa
78,96
wartościowość
-2, +4, +6
zawartość w skorupie ziemskiej
(litosfera +
atmosfera + hydrosfera) 5x10
-6
%
1817r.
– pierwszy raz opisany przez szwedzkiego
chemika J. J. Berzeliusa,
1957r
- na znaczenie jego obecności w diecie
zwierząt zwrócili uwagę Schwarz i Flotz,
lata 70-te XX w.
- dowiedziono, że jest
składnikiem peroksydazy glutationowej,
potwierdzono jego obecność w centrum
aktywnym tego enzymu,
1979r.
- pierwszy opisany przypadek skutecznej
suplementacji selenem w przebiegu leczenia
pacjenta z dystrofią mięśniową,

Zawartość selenu w tkankach roślin ściśle koreluje z
ilością tego pierwiastka w glebie, na której rośliny te
wzrastają.
Chiny, Nowa Zelandia i Finlandia to kraje o
glebach ubogich w selen, co znajduje swoje
odzwierciedlenie w występowaniu
endemicznych schorzeń związanych z
niedoborem selenu w diecie . Zaobserwowano,
że w rejonach Chin o wysokiej zachorowalności
na młodzieńczą kardiomiopatię (ch. Keshan)
oraz chondrodystrofię (ch. Kashin-Beck) średnie
stężenie selenu w osoczu przedstawicieli
badanej populacji wynosiło poniżej 90 µg/l.
Tymczasem wśród mieszkańców stanów Dakota
Południowa i Maryland (USA) wartość ta
kształtowała się w zakresie 133-197 µg/l.
W badaniach przeprowadzonych w Stanach
Zjednoczonych za zalecaną dawkę przyjęto 55
µg/d, a za minimalną zaś uznano 21 µg/d.

Głównym źródłem selenu są:
•ziarna zbóż, soi,
•orzechy,
•czosnek,
•wątroba, ryby i jaja,
•niektóre gatunki drożdży
Selen może występować w diecie zarówno pod postacią:
związków organicznych
(np. selenocysteina, selenocystyna,
selenometionina, ebselen), jak i
nieorganicznych
(seleniny i seleniany).
Charakteryzują się one wysoką biodostępnością i dobrze
wchłaniają się w przewodzie pokarmowym.

Aminokwasy zawierające selen – selenocysteina i
Aminokwasy zawierające selen – selenocysteina i
selenometionina – są metabolizowane przy udziale
selenometionina – są metabolizowane przy udziale
β-liaz
β-liaz
do
do
selenków, które są następnie wykorzystywane w syntezie
selenków, które są następnie wykorzystywane w syntezie
selenoprotein .
selenoprotein .
W przeciwieństwie do cynku i miedzi, które są wbudowywane
W przeciwieństwie do cynku i miedzi, które są wbudowywane
do białek posttranslacyjnie, selen jest inkorporowany do
do białek posttranslacyjnie, selen jest inkorporowany do
struktury peptydów już w procesie translacji w formie
struktury peptydów już w procesie translacji w formie
selenoaminokwasu związanego z tRNA zawierającym antykodon
selenoaminokwasu związanego z tRNA zawierającym antykodon
UGA charakterystyczny dla metioniny.
UGA charakterystyczny dla metioniny.
Metabolity selenu mogą podlegać metylacji i w formie mono-,
Metabolity selenu mogą podlegać metylacji i w formie mono-,
di- i trimetylowanych pochodnych są wydalane z moczem.
di- i trimetylowanych pochodnych są wydalane z moczem.
Stwierdzono ponadto, że w produktach roślinnych mogą
Stwierdzono ponadto, że w produktach roślinnych mogą
również występować metylowane pochodne
również występować metylowane pochodne
selenoamonokwasów, które redukowane do selenoalkoholi
selenoamonokwasów, które redukowane do selenoalkoholi
wykazują szczególne właściwości przeciwnowotworowe
wykazują szczególne właściwości przeciwnowotworowe
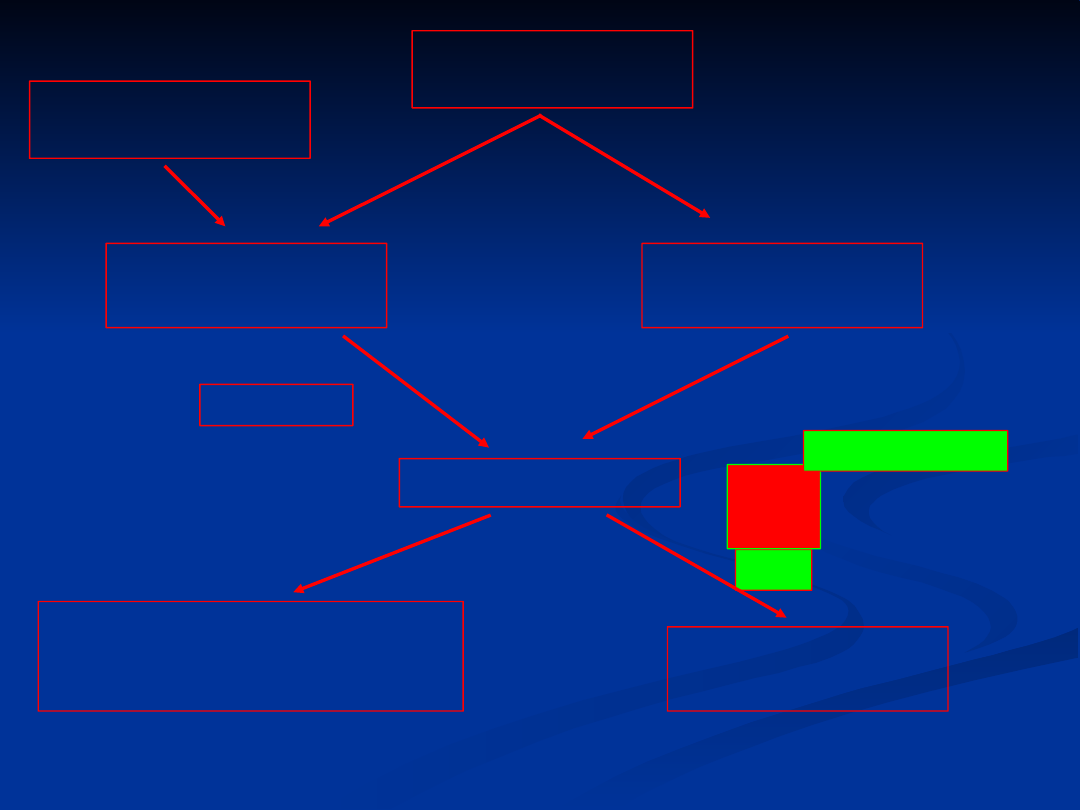
Selenocysteina
selenometioni
na
Składniki
pokarmowe
Białka
strukturalne
Seleniany
seleniny
selenki
Mono-, di- i
trimetylowe
pochodne
wydalane z
moczem
Białka
strukturalne
β-liazy
UG
A
tRNA
selenoamino
kwas

Selen tkankowy w organizmie człowieka (
głównie
nieaktywne biologicznie kompleksy selenu z rtęcią
):
około 60% - wątroba,
15% w nerka,
10% w osocze, a pozostałe 15% w różnych narządach.
Do narządów zawierających duże ilości
wolnego
selenu
należą przede wszystkim: nerki, szyszynka oraz
tarczyca, jak również wątroba, śledziona i kora mózgowa.
Dotychczas zidentyfikowano ponad 30 selenoprotein, z
których dokładnie opisano kilkanaście.
Okazało się, że wykazują one szeroki zakres aktywności
biologicznej:
• są enzymami antyoksydacyjnymi,
• warunkują prawidłowy przebieg spermatogenezy,
• uczestniczą w metabolizmie hormonów tarczycy,
• zapewniają prawidłową funkcję tkanki mięśniowej

Udział selenoprotein w
utrzymaniu równowagi
antyoksydacyjno-oksydacyjnej
ustroju.

peroksydaza glutationowa (GPx)
peroksydaza glutationowa (GPx)
-
katalizuje redukcję nadtlenku wodoru oraz nadtlenków
organicznych w obecności zredukowanego glutationu (GSH)
Enzym ten zbudowany jest z 4 podjednostek, z których każda zawiera
jeden atom selenu wchodzący w skład selenocysteiny centrum aktywnego.
Zidentyfikowano do tej pory 4 typy peroksydazy glutationowej.
1/ tzw. klasyczna peroksydaza glutationowa (cGPx, GPx-1),
postać
komórkowa
(pierwsza poznana forma tego enzymu):
zbudowana jest z podjednostek o m. cz. 21 kDa i odpowiada za redukcję
nadtlenku wodoru i wielu nadtlenków organicznych znajdujących się
wewnątrz komórki.
2/ peroksydaza glutationowa żołądkowo-jelitowa (GI-GPx, GPx-2):
występuje w ścianie przewodu pokarmowego oraz wątrobie i stanowi
element bariery ochronnej przed nadtlenkami i ksenobiotykami
wchłanianymi w świetle przewodu pokarmowgo.
Enzym-SeH + H
2
O
2
-> Enzym-Se-OH + H
2
O
Enzym-Se-OH + GSH -> Enzym-SeSG + H
2
O
Enzym-SeSG + GSH -> Enzym-SeH + GSSG

peroksydaza glutationowa (GPx)
peroksydaza glutationowa (GPx)
3/ tzw. postać osoczowa peroksydazy glutationowej (pGPx, GPx-3):
zdolna wykorzystywać jako donory elektronów nie tylko zredukowaną
formę glutationu, ale również inne osoczowe układy oksydoredukcyjne,
np. system tioredoksyny/ reduktazy tioredoksyny; występująca w
płynach pozakomórkowych i niektórych tkankach mających z nimi
kontakt (nerki, łożysko, wątroba).
4/ tzw. peroksydaza glutationowa wodoronadtlenków fosfolipidów (PH-
GPx, GPX-4):
monomer o m. cz. 18 kDa, występuje wewnątrzkomórkowo i jest
jedynym znanym enzymem zdolnym redukować wodoronadtlenki
fosfolipidów błonowych; w szczególnie dużych ilościach występuje w
komórkach spermatozoidów, biorąc udział w ich dojrzewaniu,
metabolizmie mitochondrialnym i chroniąc je przed apoptozą. Ta
specyficzna lokalizacja skłania niektórych autorów do wyróżnienia piątej
postaci peroksydazy glutationowej –
tzw. sperm nuclei glutatione
peroxidase.
Wszystkie typy peroksydazy glutationowej
tworzą kompleks synergistycznie działających
enzymów, które chronią ustrój przed
szkodliwym działanie reaktywnych form tlenu
(RFT). Szereg badań potwierdziło, że poziom
selenu w diecie ściśle koreluje z aktywnością
antyoksydacyjną peroksydazy glutationowej.
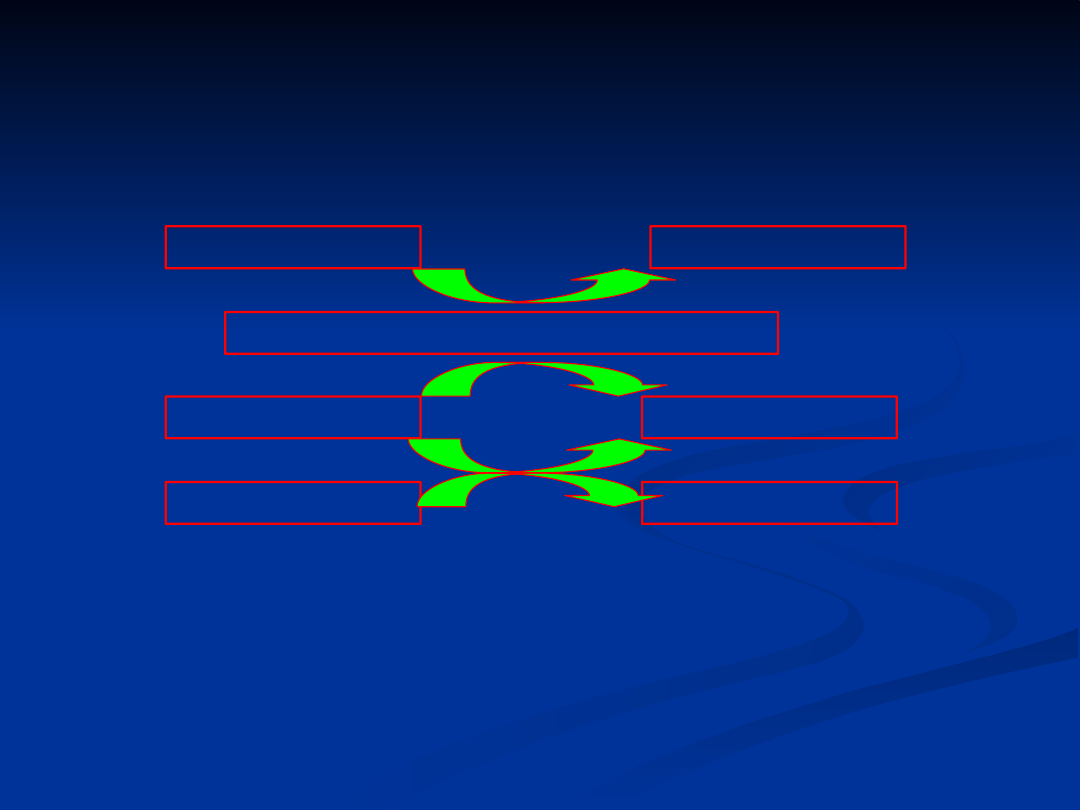
reduktaza tioredoksyny (TRxR)
reduktaza tioredoksyny (TRxR)
- aktywna w tzw. systemie tioredoksyny/reduktaza
tioredoksyny (TRx/TRxR), katalizując reakcję
redukcji tioredoksyny przy udziale NADPH.
Tioredoksyna wykazuje zdolność redukownia
mostków disulfidowych białek, chroniąc je w ten
sposób przed uszkadzającym działaniem stresu
oksydacyjnego.
Badania in vitro potwierdziły, że reduktaza tioredoksyny wykazuje zdolność
redukowania produktów utleniania lipidów
, jak również bierze udział w
metabolizmie
wit. C i K.
Jej obecność stwierdzono także na powierzchni
keratynocytów
, gdzie
prawdopodobnie pełni rolę pierwszego czynnika obrony przed utleniającym
działaniem promieniowania ultrafioletowego.
Potwierdzono również udział reduktazy tioredoksyny w
regulacji procesu
transkrypcji
poprzez wpływ na aktywność czynnika NFκB, białka p53 i receptora
glukokortykoidowego
Niedobór selenu zmniejsza poziom aktywnej formy reduktazy tioredoksyny.
utleniony
substrat
NADPH + H
+
---- TrxR NADP
+
Białko-(SH)
2
Białko-S
2
zredukowany
produkt
Trx-(SH)
2
Trx-S
2

Selenoproteina P
Selenoproteina P
- jest głównym białkiem osoczowym
transportującym selen, choć pewne ilości tego
pierwiastka mogą być również związane z
osoczowymi albuminami.
Jako jedyna spośród selenoprotein zawiera 10
atomów selenu w jednej cząsteczce.
Syntetyzowana i wydzielana przez wszystkie
tkanki ustroju jest głównym źródłem selenu dla
tkanki mózgowej.
W stanach niedoboru selenu w diecie jest
kumulowana w wątrobie jako
główne źródło
selenoaminokwasów
.
Wykazuje
właściwości antyoksydacyjne
: m. in.
zdolność redukowania nadtlenku wodoru w
obecności GSH, a w warunkach stresu
oksydacyjnego(np. w przebiegu procesu
zapalnego) związana z powierzchnią komórek
śródbłonka chroni je przed szczególnie
reaktywnym nadtlenoazotynem (ONOO-).
Ponadto selenoproteina P pełni kluczową rolę w
badaniach nad biologiczną aktywnością selenu
jako najbardziej
czuły wskaźnik jego podaży w
diecie.

Dejodynaza jodotyroksyny
Selen jest również składnikiem 3 izoenzymów dejodynazy
jodotyroksyny, które odpowiadają za obwodową konwersję
tyroksyny w trójjodotyroninę, regulując w ten sposób
biologiczną aktywność hormonów tarczycy. Zaobserwowano,
że niedobór selenu w diecie prowadzi do zaburzeń funkcji
tarczycy, a jego suplementacja może stanowić element terapii
łagodnych postaci niedoczynności tego gruczołu
Ebselen
Szczególna postacią małocząsteczkowego selenozwiązku
organicznego jest ebselen, aktywny biologicznie w swej
natywnej postaci i nie będący jest źródłem selenu do syntezy
selenoenzymów. Wykazuje zdolność redukowania
wodoronadtlenków lipidów i nadtlenku wodoru, jak również
stanowi substrat dla reduktazy tioredoksyny. Ponadto hamuje
aktywność enzymów biorących udział w procesie zapalnym
(lipoksygenazy, syntetazy tlenku azotu, oksydazy NADPH)
oraz ogranicza wybuch tlenowy granulocytów
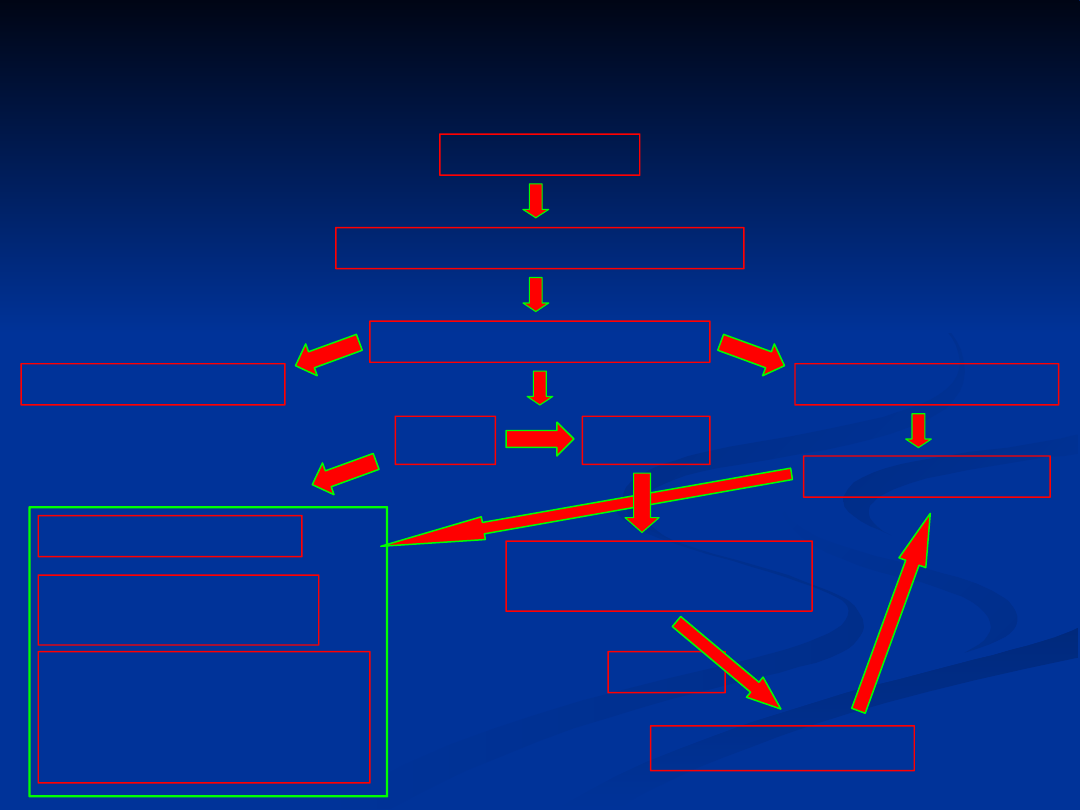
Patomechanizm uszkodzenia i przebudowy ściany
Patomechanizm uszkodzenia i przebudowy ściany
naczyniowej w warunkach zaburzenia
naczyniowej w warunkach zaburzenia
równowagi antyoksydacyjno-oksydacyjnej:
równowagi antyoksydacyjno-oksydacyjnej:
czynnik
stresowy
fagocyty, komórki
śródbłonka (EC)
reaktywne formy tlenu
(RFT)
LDL
TNF-α, IL-1,
INF-γ
uszkodzenie EC
LDL-
ox
komórki zapalne
makrofagi k.
piankowate
limfocyty T CD4+
uszkodzenie EC
fenotyp
trombogenny EC
Wzrost ekspresji
molekuł adhezyjnych
(VCAM, ICAM, ELAM)
na powierzchni EC
MHC
II
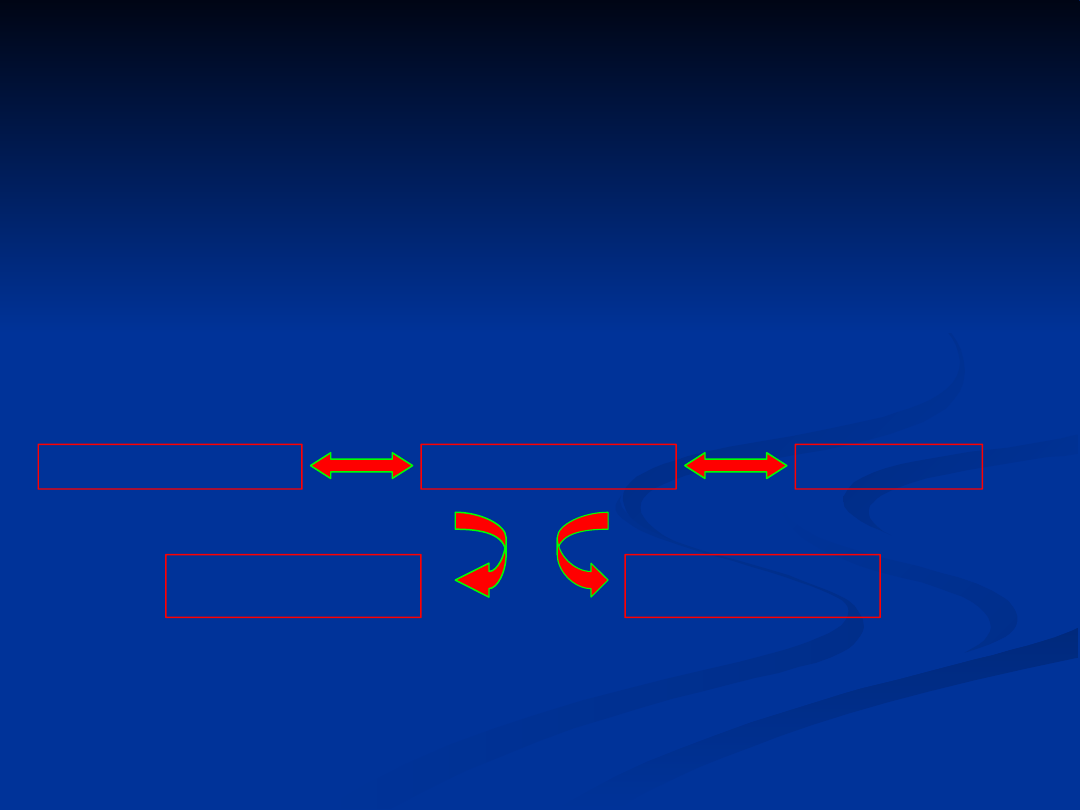
Selenoenzymy dzięki swoim antyoksydacyjnym
właściwościom mogą skutecznie chronić LDL
przed RFT, działając protekcyjnie na komórki
śródbłonka i wyciszając wstępne etapy
aterogenezy, co znalazło potwierdzenie w
badaniach in vitro.
Protekcyjne działanie selenoprotein może również wynikać z ich wpływu na
metabolizm kwasu arachidonowego. Zaobserwowano bowiem, że
peroksydaza glutationowa reguluje aktywność
cyklooksygenazy i
lipoksygenazy kwasu arachidonowego,
zwiększając poziom PGI2 w
stosunku do TXA2 i leukotrienów. Zwiększona produkcja TXA2 powoduje
skurcz naczyniowy i sprzyja agregacji płytek, co może prowadzić do
uszkodzenia komórek śródbłonka, zaburzenia przepływu naczyniowego i w
efekcie znacznie przyspieszyć proces formowania blaszki miażdżycowej.
selenoprote
iny
PGI2/TXA2
PGI2
/
TXA2
PGI2
/TXA2
RFT
Zdolność peroksydazy gluationowej do redukcji wodoronadtlenków nie tylko
przywraca równowagę układu PGI2/TXA2, ale również hamuje aktywność
jądrowego czynnika transkrypcyjnego
NFκB
uważanego za jeden z głównych
wewnątrzkomórkowych czynników promujących aterogenezę
.

Peroksydaza glutationowa i reduktaza
tioredoksyny
odgrywają również istotną rolę w
utrzymaniu prawidłowego poziomu
tlenku azotu
(NO),
który w warunkach fizjologicznych:
•
hamuje agregację płytek krwi,
•
adhezję leukocytów do komórek śródbłonka,
•
proliferację miocytów ściany naczyniowej.
A w warunkach stresu oksydacyjnego:
•
jest prekursorem silnego endogennego
oksydanta jakim jest nadtlenoazotyn (ONOO-)
Zaburzenie równowagi antyoksydacyjno-
oksydacyjnej i prawidłowego stosunku O2-/NO na
korzyść O2- może prowadzić do zmniejszenia
aktywności peroksydazy glutationowej i systemu
tioredoksyny/reduktaza tioredoksyny, a w
konsekwencji do niewydolności bariery
antyoksydacyjnej ustroju.
Efektem tego jest:
• wzrostu przepuszczalności naczyń,
•przylegania leukocytów do komórek śródbłonka
•oraz ich pozanaczyniowej migracji,
co w efekcie zwiększa prawdopodobieństwo
patologicznej przebudowy ściany naczyniowej. W
badaniach na zwierzętach doświadczalnych
udowodniono, że
niedobór selenu w diecie
znamiennie upośledza syntezę NO i zwiększa
podatność komórek śródbłonka na stres
oksydacyjny.

Selenoproteiny zdają się więc odgrywać istotną rolę w
obronie komórek śródbłonka przez stresem oksydacyjnym i
mieć korzystny wpływ na układ sercowo-naczyniowy.
W badaniach na zwierzętach doświadczalnych
zaobserwowano, że niedobór selenu wiązał się z
większy ryzykiem wystąpienia chorób mięśnia
sercowego, krwotoków naczyniowych, a nawet
nagłej śmierci.
Badania epidemiologiczne wykonane na
ludziach nie dały oczekiwanych wyników – nie udało
się udowodnić bezpośredniego związku stężenia
selenu w osoczu z ryzykiem rozwoju miażdżycy.
Przeprowadzone dotychczas obserwacje nie
pozwalają jednoznacznie stwierdzić, czy niedobór
selenu w diecie zwiększa prawdopodobieństwo
zachorowania na choroby układu sercowo-
nczyniowego.
Niemniej badania nad fizjologiczną funkcją
selenoprotein oraz potwierdzony związek ich
aktywności z utrzymaniem równowagi
antyoksydacyjno-oksydacyjnej ustroju pozwalają
przypuszczać, że selen jest ważnym składnikiem
pokarmowym i jego podaż w diecie człowieka może
mieć istotne znaczenie w prewencji chorób układu
sercowo-naczyniowego.
PODSUMOWANIE

DZIĘKUJEMY
ZA UWAGĘ!

Piśmiennictwo:
Alissa E.M., Bahijri S.M., Ferens G.A. The controversy surrounding elenium and
cardiovascular disease: a review of the evidence. Med Sci Monit, 2003, 9(1), RA9-18.
Patrick L. Selenium biochemistry and cancer: a review of the literature. Altern Med Rev,
2004 Sep, 9(3), 239-258.
Zagrodzki P. Selen, a układ odpornościowy. Postępy Hig Med Dosw, 2004, 58, 140.
Arnér E.S.J., Holmgren A., Physiological functions of thioredoxin and thioredoxin reductase.
Eur J Biochem, 2000, 267, 6102-6109.
Burk R.F., Hill K.E., Motley A.K. Selenoprotein metabolism and function: evidence for more
than one function for selenoprotein P. J Nutr, 2003 May, 133(5 Suppl 1), 1517S-20S.
Avissar N.S., Whitin J.C., Allen P.Z., Wagner D.D., Liege P., Cohen H.J. Plasma Selenium-
dependent Glutathione Peroxidase. Cell of origin and secretion. J Biol Chem, 1989 Sep
25, 264(27), 15850-5.
Thomas JP, Geiger PG, Girotti AW. Lethal damage to endothelial cells by oxidized low density
lipoprotein: role of selenoperoxidases in cytoprotection against lipid hydroperoxide- and
iron-mediated reactions. J Lipid Res, 1993 Mar, 34(3), 479-90.
Miller S, Walker SW, Arthur JR, Lewin MH, Pickard K, Nicol F, Howie AF, Beckett GJ.
Selenite protects human endothelial cells from oxidative damage and induces
thioredoxin reductase. Clin Sci (Lond), 2001 May, 100(5), 543-50.
Bjornstedt M, Xue J, Huang W, Akesson B, Holmgren A. The Thioredoxin and Glutaredoxin
Systems Are Efficient Electron Donors to Human Plasma Glutatione Peroxidase. J Biol
Chem, 1994 Nov 25, 289(47), 29382-29384.
Bartosz …..
Hara S, Shoji Y, Sakurai A, Yuasa K, Himeno S, Imura N. Effects of selenium deficiency on
expression of selenoproteins in bovine arterial endothelial cells. Biol Pharm Bull, 2001
Jul, 24(7), 754-9.
Brigelius-Flohe R, Banning A, Schnurr K. Selenium-dependent enzymes in endothelial cell
function. Antioxid Redox Signal, 2003 Apr, 5(2), 205-15.
Hawkes WC, Alkan FZ, Oehler L. Absorption, Distribution and Excretion of Selenium from
Beef and Rice in Healthy North American Men. J. Nutr, 2003 Nov, 133, 3434-3442.
Arthur JR, McKenzie RC, Beckett GJ. Selenium in the Immune System. J. Nutr, 2003 May,
133, 1457S-1459S.
Saito Y, Takahashi K. Characterization of selenoprotein P as a selenium supply protein. Eur J
Biochem, 2002, 269, 5746-5751.

Piśmiennictwo
c.d.:
Muntau AC, Streiter M, Kappler M, Röschinger W, Schmid I, Rehnert A, Schramel P,
Roscher AA. Age-related Reference Values for Serum Selenium Concentrations in
Infants and Children.
, 2002, 48, 555-560.
Ducros V, Ferry M, Faure P, Belin N, Renversez JC, Ruffieux D, Favier A. Distribution of
Selenium in Plasma of French Women: Relation to Age and Selenium Status. Clinical
Chemistry, 2000, 46, 731-733.
brak
Hara S, Shoji Y, Sakurai A, Yuasa K, Himeno S, Imura N. Effects of selenium deficiency on
expression of selenoproteins in bovine arterial endothelial cells. Biol Pharm Bull, 2001
Jul, 24(7), 754-9.
=18
Atkinson JB, Hill KE, Burk RF. Centrilobular endothelial cell injury by diquat in the
selenium-deficient rat liver. Lab Incest, 2001 Feb, 81(2), 193-200.
Ricetti MM, Guidi GC, Tecchio C, Bellisola G, Rigo A, Perona G. Effects of sodium selenite on
in vitro interactions between platelets and endothelial cells. Int J Clin Lab Res, 1999,
29(2), 80-4.
Maddox JF, Aherne KM, Reddy CC, Sordillo LM. Increased neutrophil adherence and
adhesion molecule mRNA expression in endothelial cells during selenium deficiency. J
Leukoc Biol, 1999 May, 65(5), 658-64.
Ricetti MM, Guidi GC, Bellisola G, Marrocchella R, Rigo A, Perona G. Selenium enhances
glutathione peroxidase activity and prostacyclin release in cultured human endothelial
cells. Concurrent effects on mRNA levels. Biol Trace Elem Res, 1994 Oct-Nov, 46(1-
2),113-23.
Perona G, Schiavon R, Guidi GC, Veneri D, Minuz P. Selenium dependent glutathione
peroxidase: a physiological regulatory system for platelet function. Thromb Haemost,
1990 Oct 22, 64(2), 312-8.
Toivanen JL. Effects of selenium, vitamin E and vitamin C on human prostacyclin and
thromboxane synthesis in vitro. Prostaglandins Leukot Med, 1987 Mar, 26(3), 265-80.
Broncel M. Czynniki zapalne w miażdżycy. Problemy Terapii Monitorowanej 2003, 14(2), 77-
84.
McCarty MF. Oxidants downstream from superoxide inhibit nitric oxide production by
vascular endothelium--a key role for selenium-dependent enzymes in vascular health.
Med Hypotheses, 1999 Oct, 53(4), 315-25.
Bianco AC, Salvatore D, Gereben B, Berry MJ, Larsen PR. Biochemistry, Cellular and
Molecular Biology, and Physiological Roles of the Iodothyronine Selenodeiodinases.
Endocrine Reviews, 2002, 23(1), 38–89.

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
Dieta na trądzik powinna być bogata w selen
Metale, SELEN 2 95, SELEN
Metale, SELEN, SELEN
Selen 2
Selen, różności, dietetyka, składniki mineralne
Selen
Selen
SELEN, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
Metale, SELEN 95, SELEN
Selen
cynk i selen
Selen
Ludwik Selen Jak powstają kryzysy ekonomiczne
SELEN
Ludwik Selen Tendencje rozwojowe imperializmu
Selen usuwa rtęć z mózgu i zapobiega rakowi
Selen SAFE FOOD EUFIC
selen
Ludwik Selen Pierwotne nagromadzenie (akumulacja) kapitału
więcej podobnych podstron