
2011-11-09
1
CHEMIA II
Wykład
W
ę
giel i chemia w
ę
gla
Jacek Czerwiński
Pok. 110
Konsultacje - sobota 10
o0
-12
00
j.czerwinski@wis.pol.lublin.pl

2011-11-09
2
Literatura
J. Mc Murry „Chemia Organiczna”, część I i II
R. Morrison, J. Boyd „Chemia Organiczna”
P. Mastalerz „Chemia Organiczna”
G. Kupryszewski „Chemia Organiczna”
Graham Patrick – Chemia organiczna - Krótkie wyklady
Z. Jamrógiewicz
http://www.mlyniec.gda.pl/~chemia/organiczna/organiczna.htm
Chemia organiczna z Windows
http://acn.waw.pl/drwrede/chemiaorganicznazwindows/spis.htm
Czym jest chemia organiczna?
Określenie
„substancja organiczna”
oznaczało dawniej przynależność lub
pochodzenie ze świata zwierzęcego lub
roślinnego.
Związki nieorganiczne - substancje
wyodrębnione z minerałów.

2011-11-09
3
Co to jest chemia organiczna?
Związki organiczne - np. cukier trzcinowy,
terpentyny, barwniki
znano i stosowano od dawna.
Do połowy XIX w. sądzono , mogą je
wytworzyć jedynie organizmy żywe.
do ich wytworzenia potrzebna jest
„siła życiowa”
vis vitalis
Nie można substancji organicznych otrzymać z
nieorganicznych.
Ale:
już na początku XIX w. wiadomo było,
że w skład cząsteczek związków
występujących w przyrodzie ożywionej
wchodzi zaledwie kilka pierwiastków
składnikiem wszystkich związków
organicznych jest
WĘGIEL.

2011-11-09
4
W 1828 r. Fryderyk Wöhler
ogrzewa mieszaninę siarczanu amonowego i
cyjanianu potasowego
otrzymał związek organiczny - mocznik.
związek organiczny można otrzymać z substancji
nieorganicznych bez udziału jakichkolwiek
organizmów żywych!!!
Jeszcze 20 lat i ostatecznie zarzucono teorię „siły
życiowej”.
Związki organiczne można wytwarzać w
laboratorium
Chemia organiczna - chemia związków węgla.
Gmelin 1848, Kekule 1851
2011-11-09
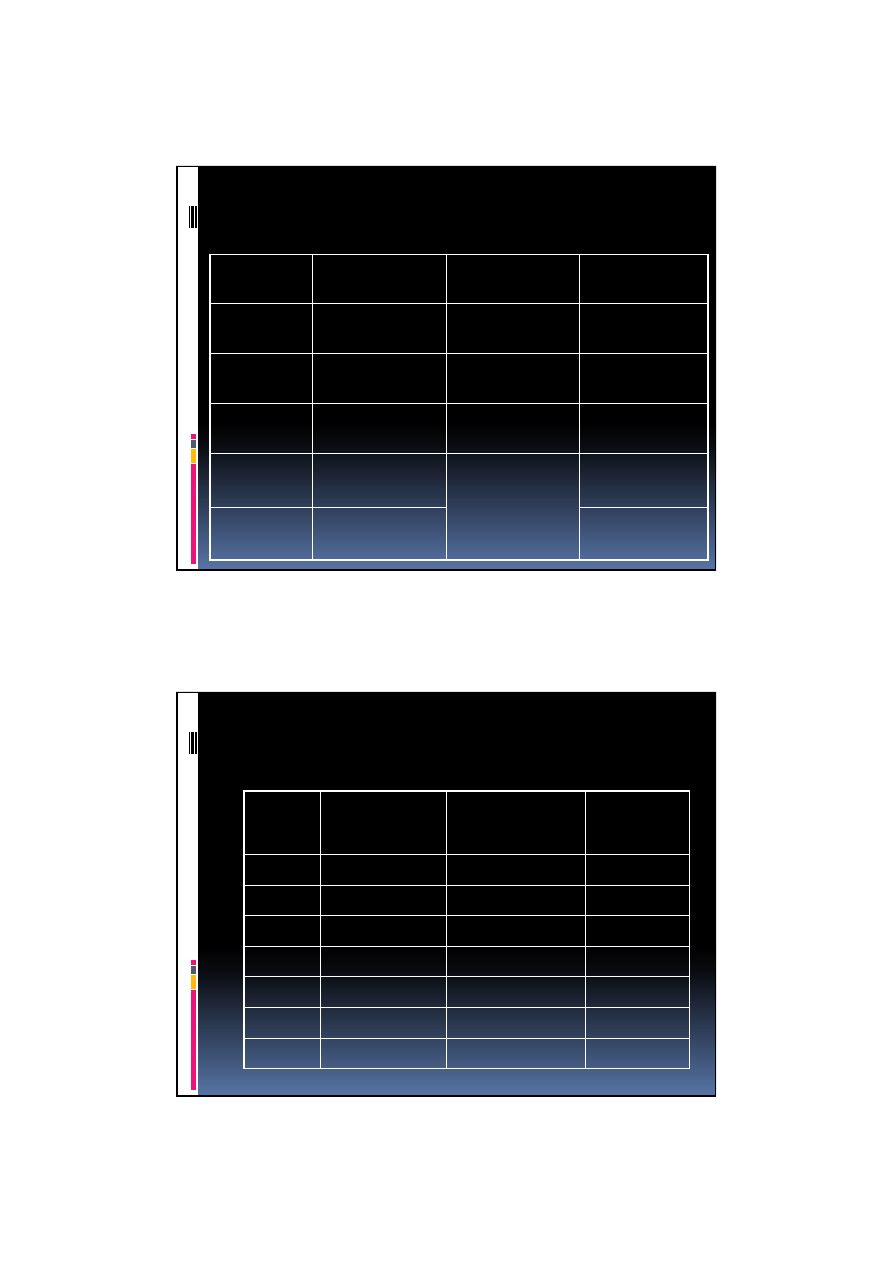
5
WĘGIEL
symbol
C
konfiguracja
elektronowa
1s
2
2s
2
p
2
nazwa
angielska
carbon
izotopy
12
C (98,9%)
13
C (1,1%)
nazwa
łaci
ń
ska
carboneum
temperatura
topnienia
3550
o
C
grupa
14 w
ę
glowce
temperatura
wrzenia
4830
o
C
liczba
atomowa
6
g
ę
sto
ść
(20
o
C, 1013
hPa) [g/cm
3
]
diament
3,47-3,56
masa
atomowa
12,011u
grafit:
2,1-2,3
Podstawowe izotopy
Izotop
Zawartość
izotopu [%]
Okres
połowicznego
zaniku
Typ
rozpadu
9
C
--
127 ms
ß
+
, alfa
10
C
--
19,3 s
ß
+
11
C
--
20,3 min
ß
+
12
C
98,892
--
13
C
1,108
--
14
C
--
5730 lat
ß
-
15
C
--
2,45s
ß
-
2011-11-09
6
Odmiany alotropowe
Grafit
Diament
Grafen
Fulereny i nanorurki
Inne:
Chaoit („biały węgiel”)
Węgiel amorficzny (sadza)
Węgiel metaliczny
Węgiel szklisty
Węgiel linearny
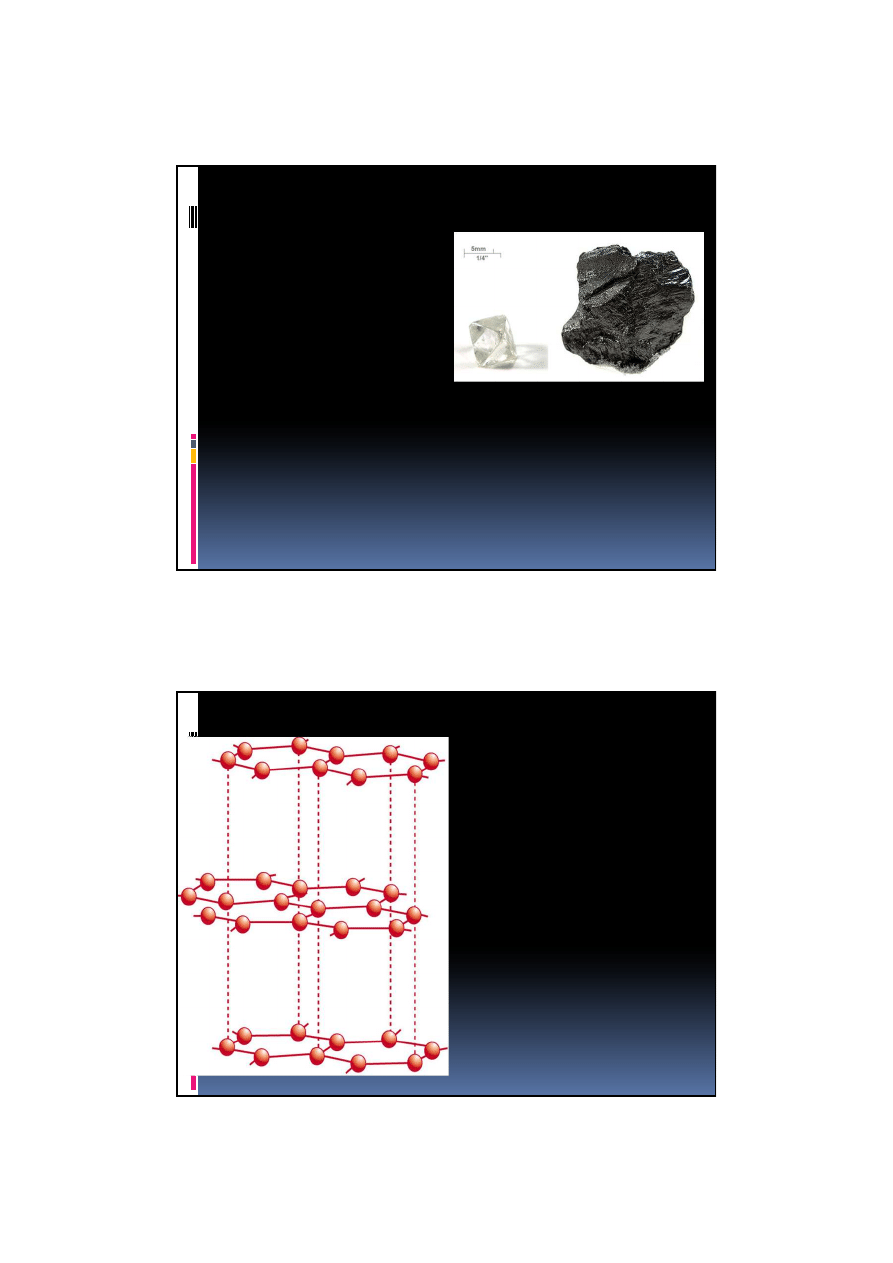
Grafit
hybrydyzacja
sp
2
warstwowy,
układ heksagonalny
piroliza zwi
ą
zków
organicznych,
szare płytki, łupliwy,
nierozpuszczalny,
reaguje z utleniaczami
twardo
ść
6 (Mohs’a)
0,1415 nm
0,335nm

2011-11-09
7
Grafit
Właściwości
Dobrze przewodzi prąd elektryczny i ciepło
Odporny na wysoką temperaturę
W przyrodzie bardzo rzadko spotyka się dobrze
wykształcone kryształy grafitu. Najczęściej występuje w
postaci agregatów łuseczkowych, blaszkowych lub w
formie zbitej masy o szaroczarnej barwie. Jest minerałem
giętkim, ale nie jest sprężysty. Jest krajalny i
nieprzezroczysty, w dotyku jest tłusty i brudzący.
Struktura grafitu składa się z warstw, w których występują
sprzężone, sześcioczłonowe aromatyczne układy cykliczne,
podobne do benzenu. Podobnie jak w benzenie, każde wiązanie C-
C w warstwie ma charakter zdelokalizowanego, "1,5 krotnego"
wiązania aromatycznego. Wiązania te tworzą obszary
zdelokalizowanych
orbitali π
, które, podobnie jak to się dzieje w
metalach umożliwiają swobodny ruch elektronów równolegle do
warstw, dzięki czemu grafit wykazuje stosunkowo wysokie
przewodnictwo elektryczne.
Między warstwami występują jedynie słabe oddziaływania. Ich
charakter tradycyjnie określany jako
oddziaływania Van der Waalsa
w istocie jest
słabym oddziaływaniem metalicznym
.

2011-11-09
8
Odległości między sąsiednimi atomami węgla w jednej warstwie
wynoszą 1.42 Å (czyli 0,142 nm), zaś między warstwami 3,35 Å
(0,335 nm). Powoduje to, że grafit wykazuje znaczną
anizotropię
(czyli kierunkowość) różnych własności fizycznych. Np:
Monokryształy grafitu przewodzą dobrze prąd elektryczny w
kierunku równoległym do warstw i znacznie gorzej w kierunku
prostopadłym.
Grafit techniczny jest zlepkiem niewielkich monokryształów,
wykazuje on wysoką odporność mechaniczną na ściskanie i
niewielką na rozciąganie i ścinanie. Jest więc jednocześnie
twardy, łupliwy i podatny na ścieranie.
Wyjątkowe dobre własności smarujące. Podczas poddawania go
siłom ścinającym ulega on rozdrobnieniu do postaci o
mikrometrycznych rozmiarach drobin. Efekt supersmarowania.
Metaliczny charakter
wiązania w połączeniu z relatywnie małą
ilością biorących w nim udział elektronów (ok. 1 na 10 tys.
atomów) i wielką ruchliwością powoduje, że siła wiązania
warstw jest zbliżona do tej charakterystycznej dla
oddziaływań Van der Waalsa, a jednocześnie przewodność
elektryczna w kierunku prostopadłym do płaszczyzn
grafitowych jest o kilka rzędów wielkości większa od
przewodności charakterystycznej dla kryształów Van der
Waalsa (kryształów molekularnych).
2011-11-09
9
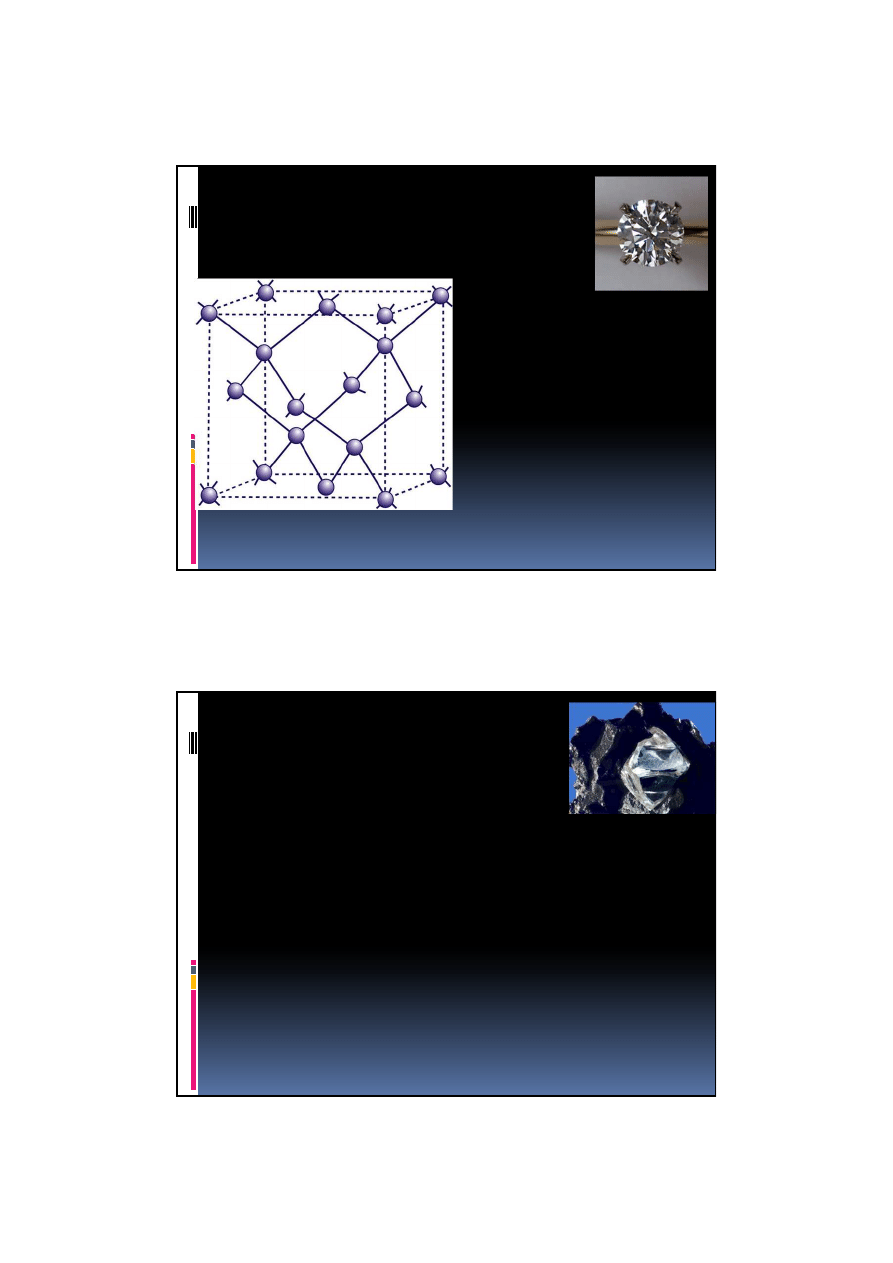
Diament
hybrydyzacja
sp
3
sie
ć
regularna
otrzymywany z
grafitu pod bardzo
wysokim ci
ś
nieniem
bezbarwne
kryształy, b. twardy,
10 Mosh’a
niereaktywny,
nierozpuszczalny
0,154 nm
Diament
Dobra przewodność cieplna:
2000W/(m*K)
wynikającą z efektywnego
przewodnictwa fononowego
Jest
izolatorem
, z wyjątkiem diamentu niebieskiego, który jest
półprzewodnikiem (domieszka B)
Jest trudno topliwy i odporny na działanie kwasów i zasad
Może zawierać wrostki innych minerałów
Tworzy zazwyczaj niewielkie kryształy przyjmujące postać ośmiościanu,
rzadziej sześcianu. Duża część kryształów ma zaokrąglone kształty oraz
wykazuje zbliźniaczenia.
Jest kruchy (rozpryskuje się pod wpływem uderzenia), przezroczysty;
zwykle zawiera śladowe ilości N, Al, B, Mn, Si, Mg, Cr.
Są w nim spotykane różne wrostki mineralne reprezentowane przez:
oliwin, granat, pirop, pirotyn, ilmenit, rutyl, grafit, diopsyd, spinel oraz
wcześniej wykrystalizowane diamenty. Rodzaj tych inkluzji pozwala na
precyzyjne określenie miejsca pochodzenia danego kamienia. Minerał
bardzo rzadki.

2011-11-09
10
Diament
Ze względu na cechy zewnętrzne wyróżnia się kilka typów
diamentów:
bort
– występuje w postaci nieregularnych zrostów
ziarnistych, drobnokrystalicznych skupień,
ballas
– promieniste skupienia kryształów diamentu,
Lonsdaleit
– polimorficzna odmiana diamentu o dużej
gęstości atomowej,
Karbonado
– zwany też czarnym diamentem, występuje w
postaci drobnoziarnistych, porowatych skupień zabarwionych
na czarno, szaro lub ciemnozielono, o różnej wielkości (aż do
wielkości jaja), przypominające z wyglądu koks – spotykane
przede wszystkim w Brazylii.
Inne
CHAOIT – „biały w
ę
giel”
bezbarwne kryształy,
bardzo twardy,
bardzo mało reaktywny,
nierozpuszczalny
W
ę
giel
„metaliczny
”
podobnie jak inne niemetale wyst
ę
puje w tej
postaci przy ci
ś
nieniach
p > 70 GPa

2011-11-09
11
fulereny
Jedna z alotropowych odmian w
ę
gla

2011-11-09
12
Nanorurki
Jednościenne bądź
wielościenne rurki
węglowe o średnicy
nawet poniżej 1nm
Przypominają
pojedyncze warstwy
grafitu (lub kilka
warstw umieszczonych
jedna na drugiej)
zwinięte w pozbawione
denek walce

2011-11-09
13
Grafen
Grafen
– jedna z alotropowych form
węgla, odkryta w 2004 roku przez
grupę brytyjsko-rosyjską. Grafen
zbudowany jest z pojedynczej
warstwy atomów węgla tworzących
połączone pierścienie
sześcioczłonowe i może być
uważany za ostatni element szeregu
wielopierścieniowych
węglowodorów aromatycznych
.

2011-11-09
14
Ponieważ grubość materiału wynosi jeden atom, tę formę
określa się jako dwuwymiarową (dokładniej dwuwymiarową
strukturę atomów węgla ułożonych w sieć heksagonalną).
Długość wiązań węgiel-węgiel wynosi ok. 1,42 Å, czyli 0,142
nanometra. Atomy węgla tworzą w grafenie płaską,
praktycznie dwuwymiarową siatkę o sześciokątnych oczkach,
której struktura przypomina plaster miodu.
Za badania grafenu Andriej Gejm i Konstantin Nowosiołow
otrzymali w roku
2010 Nagrodę Nobla w dziedzinie fizyki
Bardzo dobry przewodnik ciepła – zmierzona przewodność cieplna
wynosi od 4840±440 do 5300±480 W/mK (dla porównania srebro –
429 W/mK)
Posiada niewielką rezystancję
Bardzo wysoka ruchliwość elektronów w temperaturze pokojowej
przy założeniu jedynie rozpraszania na fononach μ = 200 000
cm²/Vs (dla porównania krzem – 1500 cm²/Vs, arsenek galu – 8500
cm²/Vs)
Prędkość przepływu elektronów, wynosząca 1/300 prędkości
światła, umożliwia badanie efektów relatywistycznych dla
elektronu poruszającego się w przewodniku
Jest niemal całkowicie przezroczysty (pochłania tylko 2,3 proc.
światła), przez jego warstwę nie przechodzą nawet atomy helu.
Jest ponad 100 razy mocniejszy niż stal, a zarazem tak elastyczny,
że można go bez szkody rozciągnąć o 20 procent.

2011-11-09
15
Pierwszą definicję
Chemii organicznej
podali Gmelin 1848, Kekule 1851
twierdząc że, "Chemia organiczna jest
chemią związków węgla"
Układ okresowy pierwiastków
1
18
1
H
1
Wodór
He
2
Hel
2
13
14
15
16
17
2
Li
3
Lit
Be
4
Beryl
B
5
Bor
C
6
W
ę
giel
N
7
Azot
O
8
Tlen
F
9
Fluor
Ne
10
Neon
3
Na
11
Sód
Mg
12
Magnez
Al
13
Glin
Si
14
Krzem
P
15
Fosfor
S
16
Siarka
Cl
17
Chlor
Ar
18
Argon
3
4
5
6
7
8
9
10
11
12
4
K
19
Potas
Ca
20
Wap
ń
Sc
21
Skand
Ti
22
Tytan
V
23
Wanad
Cr
24
Chrom
Mn
25
Mangan
Fe
26
Ż
elazo
Co
27
Kobalt
Ni
28
Nikiel
Cu
29
Mied
ź
Zn
30
Cynk
Ga
31
Gal
Ge
32
German
As
33
Arsen
Se
34
Selen
Br
35
Brom
Kr
36
Krypton
5
Rb
37
Rubid
Sr
38
Stront
Y
39
Itr
Zr
40
Cyrkon
Nb
41
Niob
Mo
42
Molibden
Tc
43
Technet
Ru
44
Ruten
Rh
45
Rod
Pd
46
Pallad
Ag
47
Srebro
Cd
48
Kadm
In
49
Ind
Sn
50
Cyna
Sb
51
Antymon
Te
52
Tellur
I
53
Jod
Xe
54
Ksenon
6
Cs
55
Cez
Ba
56
Bar
*
Hf
72
Hafn
Ta
73
Tantal
W
74
Wolfram
Re
75
Ren
Os
76
Osm
Ir
77
Iryd
Pt
78
Platyna
Au
79
Złoto
Hg
80
Rt
ęć
Tl
81
Tal
Pb
82
Ołów
Bi
83
Bizmut
Po
84
Polon
At
85
Astat
Rn
86
Radon
7
Fr
87
Frans
Ra
88
Rad
**
Rf
104
Rutherford
Db
105
Dubn
Sg
106
Seaborg
Bh
107
Bohr
Hs
108
Has
Mt
109
Meitner
Uun
110
Uuu
111
Uub
112
Uut
113
Uuq
114
Uup
115
Uuh
116
Uus
117
Uuo
118
*
Lantanowce
La
57
Lantan
Ce
58
Cer
Pr
59
Prazeodym
Nd
60
Neodym
Pm
61
Promet
Sm
62
Samar
Eu
63
Europ
Gd
64
Gadolin
Tb
65
Terb
Dy
66
Dyspoz
Ho
67
Holm
Er
68
Erb
Tm
69
Tul
Yb
70
Iterb
Lu
71
Lutet
**
Aktynowce
Ac
89
Aktyn
Th
90
Tor
Pa
91
Protaktyn
U
92
Uran
Np
93
Neptun
Pu
94
Pluton
Am
95
Ameryk
Cm
96
Kiur
Bk
97
Bekerel
Cf
98
Kaliforn
Es
99
Einstein
Fm
100
Ferm
Md
101
Mendelew
No
102
Nobel
Lr
103
Lorens

2011-11-09
16
GRUPA 14
-
W
Ę
GLOWCE
konfiguracja ns
2
p
2
stopnie utlenienia -4, +2, +4
C i Si - tendencje do wi
ą
za
ń
atomowych
(zw. IV warto
ś
ciowe)
hybrydyzacja C - sp
3
, sp
2
, sp
hybrydyzacja Si - sp
3
(tylko wi
ą
zania pojedyncze)
C
hemia organiczna
-
chemia związków węgla.
Gmelin 1848, Kekule 1851
Przez analogię
- związki krzemu - „związki krzemoorganiczne”

2011-11-09
17
GRUPA 14
-
W
Ę
GLOWCE
C
CO
CO
2
+ H
2
O = H
2
CO
3
sole - w
ę
glany CaCO
3
Si
SiO
2
+ 2 NaOH
Na
2
SiO
3
+ H
2
O
H
2
SiO
3
, H
2
SiO
3
+ HOH = H
4
SiO
4
krzemiany Na
2
SiO
3
Ge
H
2
GeO
3
, sole - germaniany
Sn
SnO – amfoteryczny
SnOH
SnO
2
- charakter kwasowy
H
2
SnO
3
Pb
PbO
Pb(OH)
2
PbO
2
Pb(OH)
4
H
4
PbO
4
GRUPA 14
-
W
Ę
GLOWCE
Poł
ą
czenia z wodorem
- wszystkie tworz
ą
C
- w
ę
glowodory –
chemia organiczna
Si
- krzemowodory - silany
Ge
- germanowodory
Sn
- tylko SnH
4
Pb
- PbH
4
- bardzo nietrwały
w
ę
gliki, krzemki, germanki - z metalami ,
półprzewodniki
Sn, Pb - z metalami - stopy

2011-11-09
18
Definicja
Chemii organicznej
słuszna do
dziś:
"
Chemia organiczna jest chemią
węglowodorów i ich pochodnych
"
Schurlenmer (1889 )
Związek organiczny
Zawiera połączenie C – H
wiązanie atomowe
2011-11-09
19
Podstawowym pierwiastkiem w
połączeniach organicznych jest
węgiel
.
Atomy węgla posiadają zdolność łączenia
się pomiędzy sobą w nawet bardzo długie
łańcuchy.
Te z kolei mogą być proste lub
rozgałęzione, a poza tym łańcuch może
ulec zamknięciu tworząc pierścień.
Przykłady węglowodorów:

2011-11-09
20
Przykłady węglowodorów:
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
,
,
,
,
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
,
,
Przykłady węglowodorów:
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
2011-11-09
21
Inne związki organiczne:
C
O
C
O
H
C
O
C
S
C
C
N
C
C
C
C
C
N
C
C
C
N
,
,
,
,
,
Rzędowość atomu węgla
atom C połączony tylko z jednym atomem C
- węgiel pierwszorzędowy
atom C połączony z dwoma atomami C
- drugorzędowy
atom C połączony z trzema atomami C
- trzeciorzędowy
atom C połączony z czterema atomami C
-
czwartorzędow
y lub węgiel "neo"
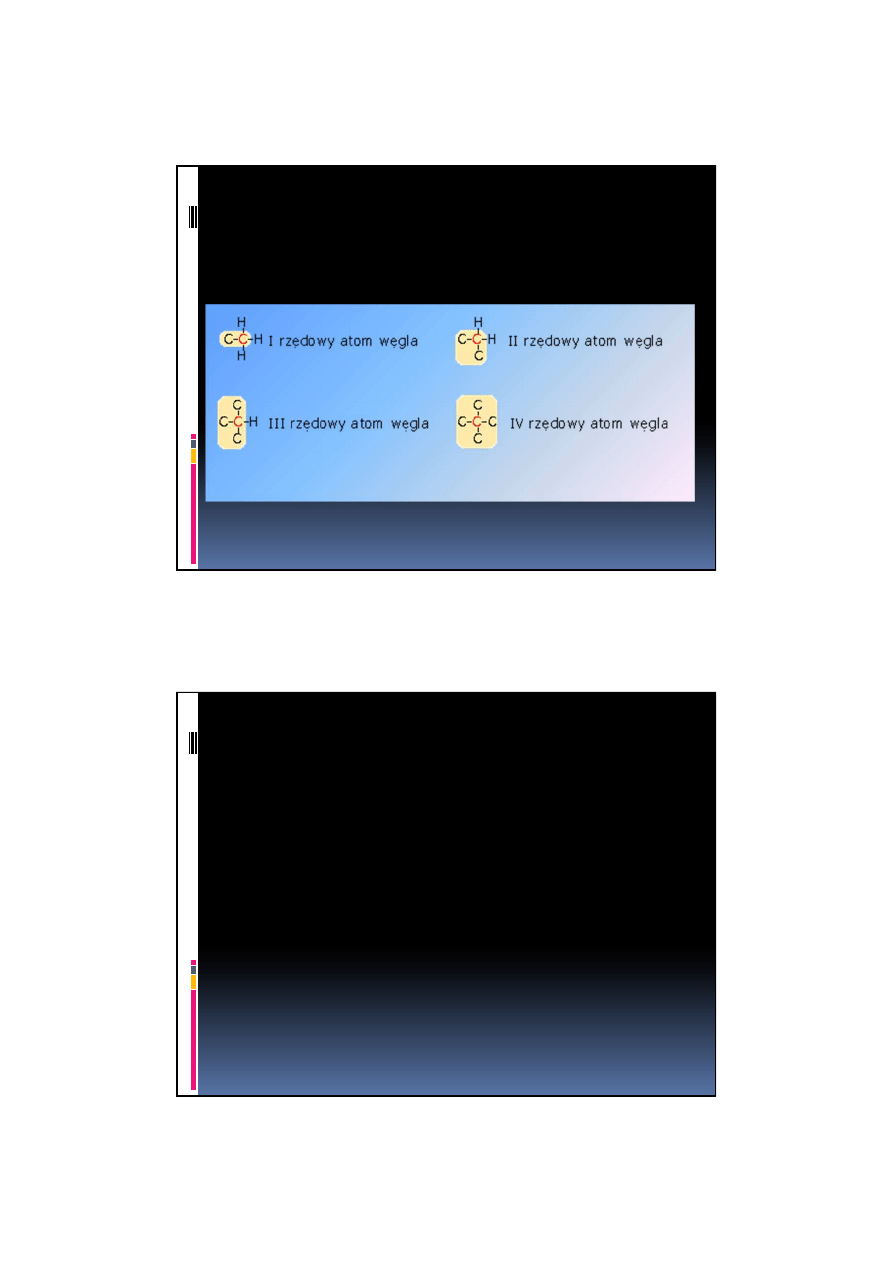
2011-11-09
22
Rzędowość atomu węgla
Podstawową grupą połączeń organicznych są
związki zbudowane z atomów węgla i
wodoru, nazywane
węglowodorami
.
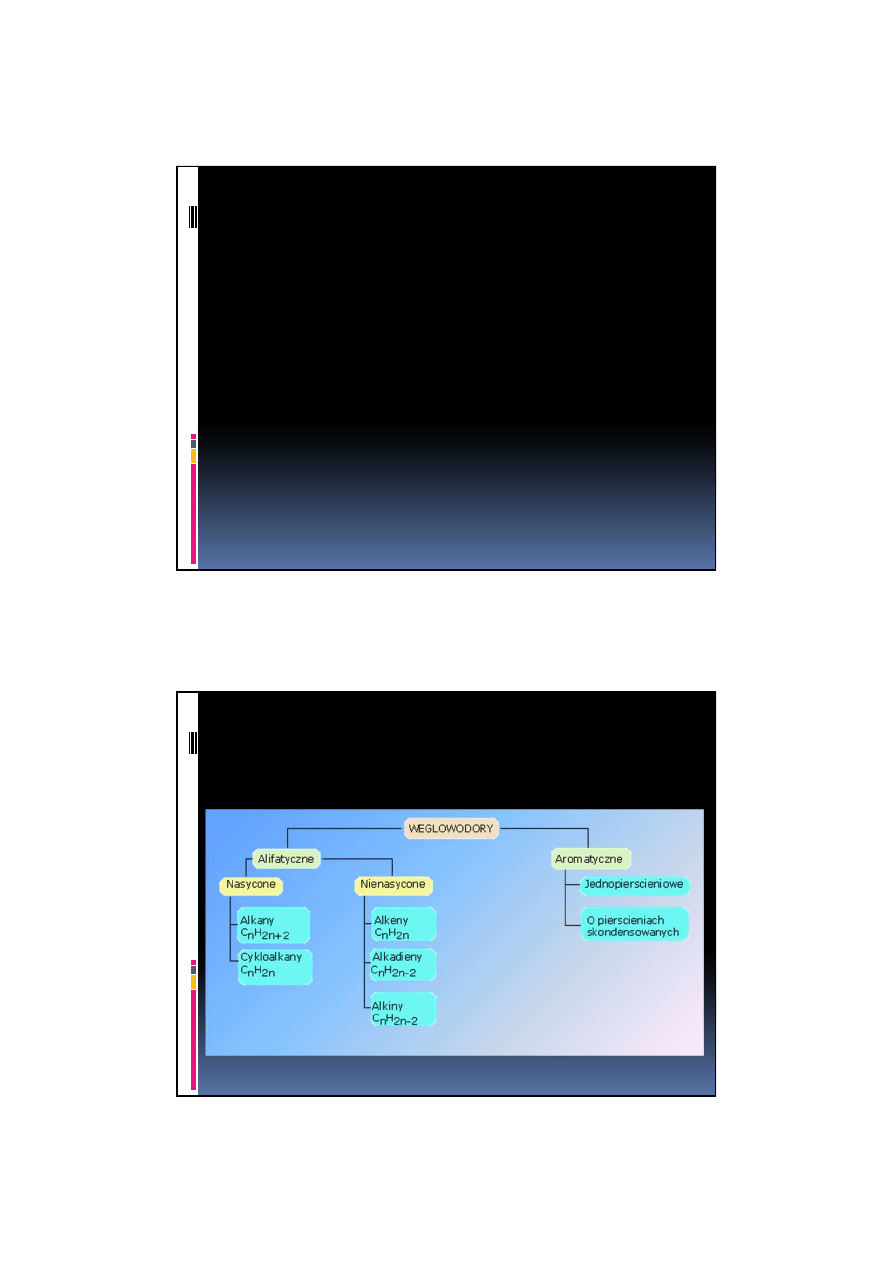
Węglowodory ze względu na budowę
szkieletu węglowego dzielimy na dwie
główne klasy:
węglowodory alifatyczne
węglowodory aromatyczne
.
2011-11-09
23
węglowodory alifatyczne
węglowodory aromatyczne.
Węglowodory alifatyczne się na alkany,
alkeny, alkiny
oraz ich analogi pierścieniowe
(cykloalkany itd.)
Węglowodory – podział:

2011-11-09
24
Podstawowe pojęcia
są to węglowodory nasycone, w których
występują tylko pojedyncze wiązania
węgiel - węgiel
jest to szereg związków, z których każdy
następny zawiera o jedną grupę -CH
2
-
więcej od poprzedniego
Alkany
Szereg homologiczny

2011-11-09
25
Nazwy alkanów
Wszystkie nazwy
alkanów
charakteryzuje końcówka
met
an
CH
4
heks
an
C
6
H
14
et
an
C
2
H
6
hept
an
C
7
H
16
prop
an
C
3
H
8
okt
an
C
8
H
18
but
an
C
4
H
10
non
an
C
9
H
20
pent
an
C
5
H
12
dek
an
C
10
H
22
- an
Wzór ogólny szeregu homologicznego
alkanów
C
n
H
2n+2
2011-11-09
26
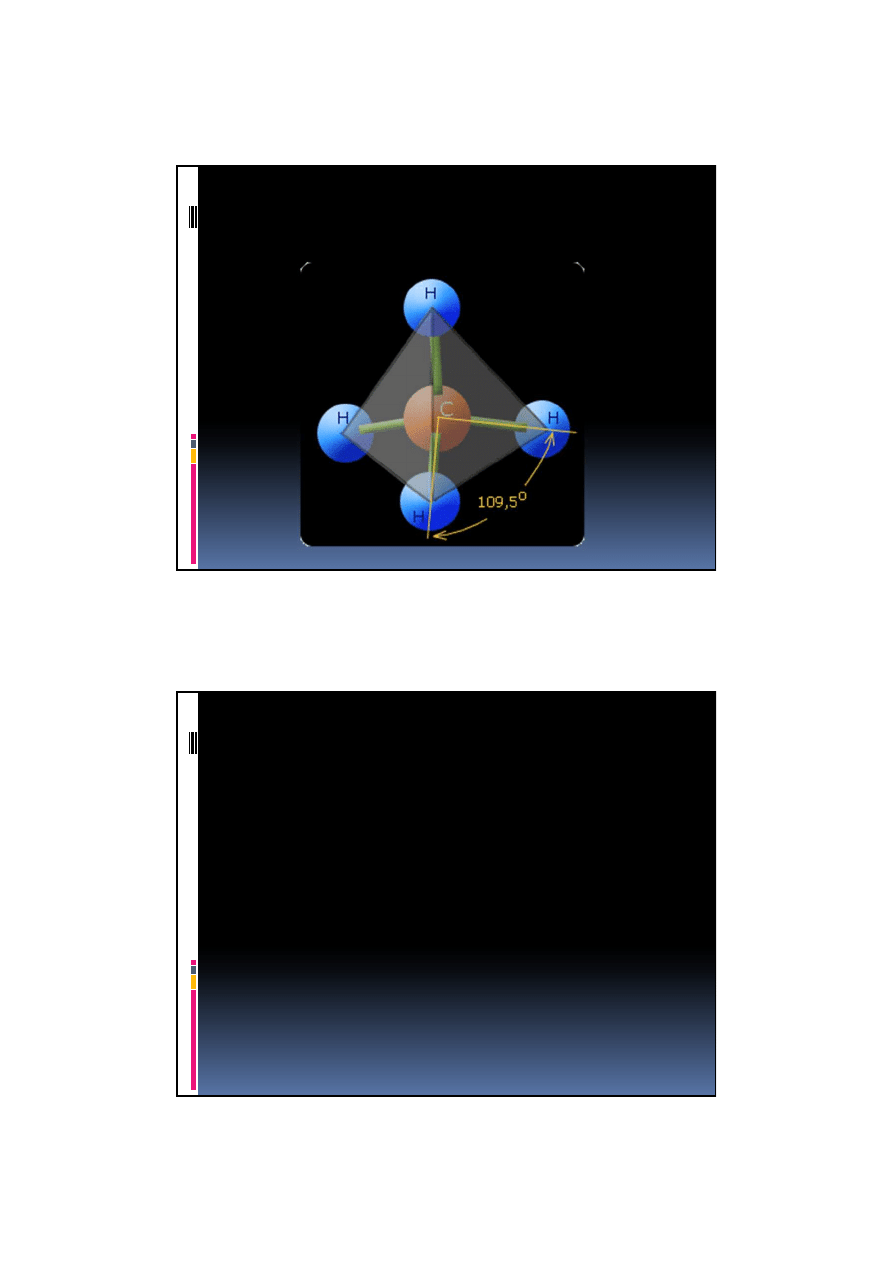
Hybrydyzacja sp
3
Taka struktura jest wynikiem hybrydyzacji sp
3
w atomie węgla
powstałe orbitale wiążące sp
3
, skierowane
są ku wierzchołkom czworościanu.
Takie właśnie rozmieszczenie orbitali
umożliwia maksymalne ich oddalenie i
przyjęcie struktury tetraedrycznej.
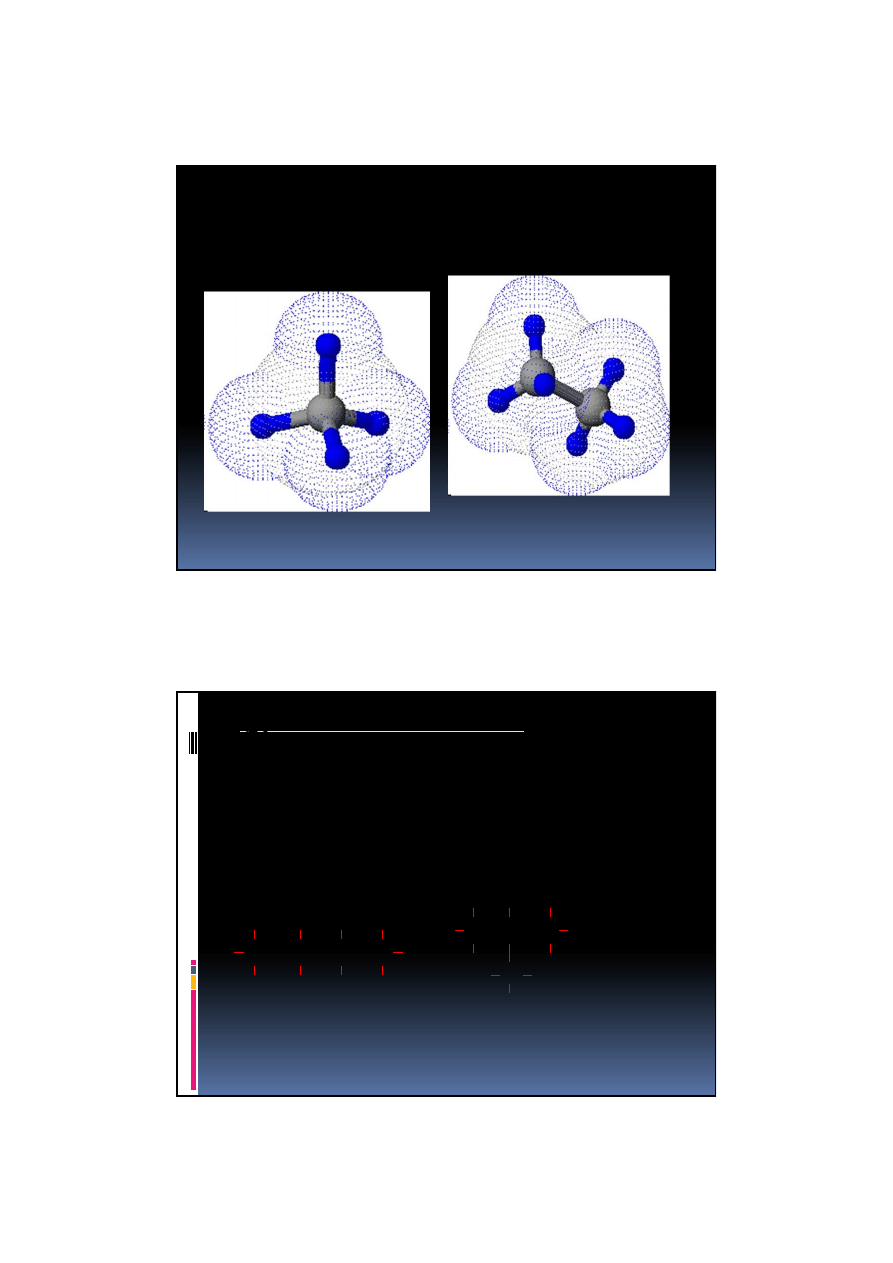
2011-11-09
27
metan
etan
Izomeria łańcuchowa w alkanach
jest to zjawisko występowania dwóch lub
większej liczby związków o takim samym wzorze
sumarycznym, lecz różnej budowie cząsteczek
polega na różnej budowie
łańcucha cząsteczek izomerów
C - C - C
C
izo - butan
(przedrostek izo- oznacza
łańcuch rozgałęziony)
Izomeria
Izomeria łańcuchowa
C
4
H
10
C - C - C - C
n - butan
(przedrostek n- oznacza
prosty łańcuch węgla)
2011-11-09
28
Nazewnictwo
Numery atomów węgla,
przy których są podstawniki
5,6 - di chloro - 4 - etylo - 2,3,3 - tri metylo oktan
Rodzaj
podstawnika w
kolejności
alfabetycznej
Przedrostki określające liczbę
jednakowych podstawników
Nazwa węglowodoru
o najdłuższym łańcuchu
C
C
Cl Cl
C
C
C
-C
1
- C
2
- C
3
- C
4
- C
5
- C
6
- C
7
- C
8
-
Właściwości fizyczne
Im dłuższy łańcuch węglowy, tym wyższa jest
temperatura wrzenia
Alkany o 1 do 4 atomów węgla są gazami
Alkany o 5 do 16 atomach węgla są cieczami
Alkany o co najmniej 17 atomach węgla
są ciałami stałymi
2011-11-09
29
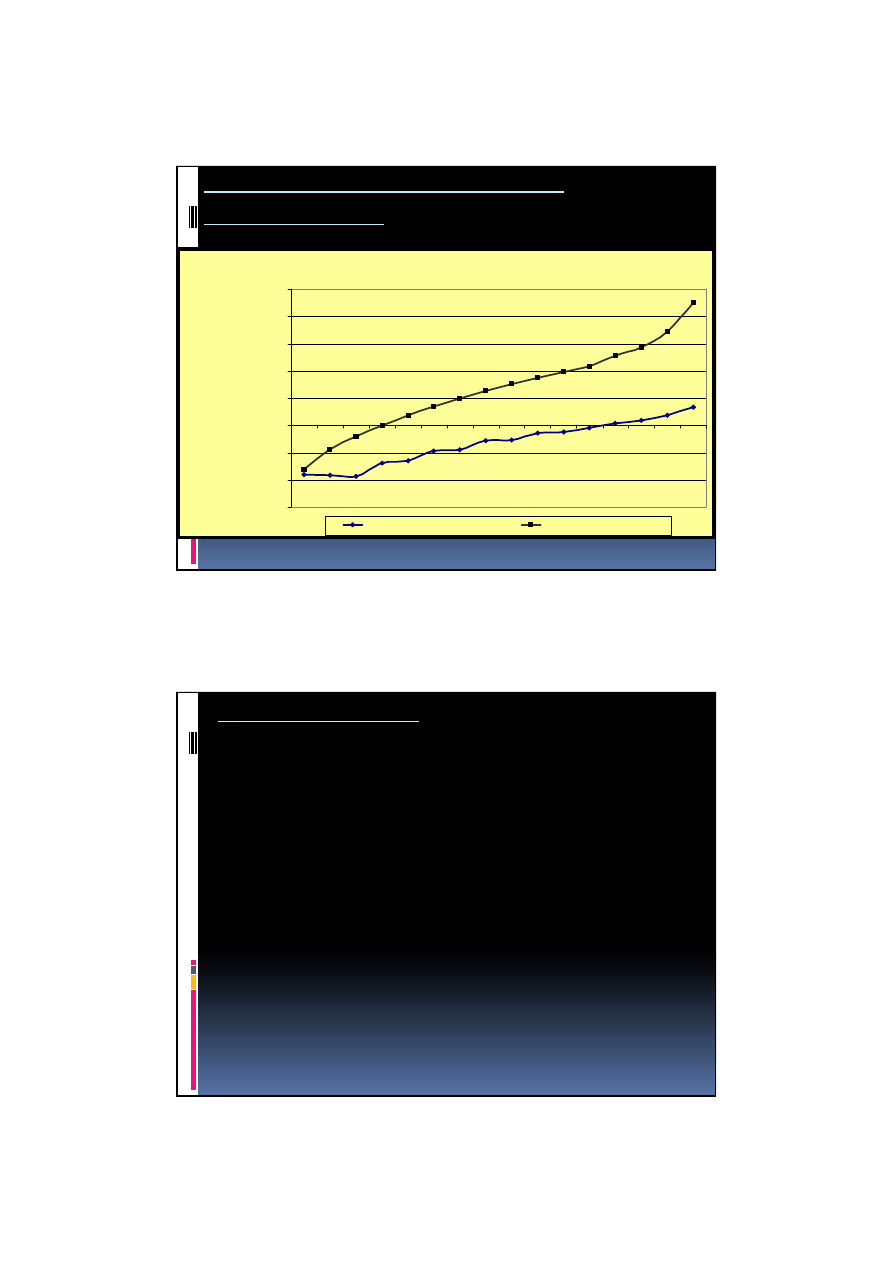
Zależność temperatury topnienia i wrzenia
od długości łańcucha
-300
-200
-100
0
100
200
300
400
500
1
2
3
4
5
6
7
8
9
10
11
12
14
16
20
30
ilo
ść
atomów w
ę
gla
te
m
p
e
ra
tu
ra
0
C
temperatura topnienia
temperatura wrzenia
Właściwości fizyczne
Rozpuszczają się w rozpuszczalnikach
niepolarnych i słabo-polarnych (benzyna,
eter)
Nie rozpuszczają się w wodzie
i rozpuszczalnikach polarnych

2011-11-09
30
Reakcje spalania
alkan + O
2
CO
2
+ H
2
O
CO + H
2
O
C + H
2
O
spalanie całkowite
spalanie niepełne - półspalanie
spalanie niepełne - niecałkowite
Reakcja charakterystyczna
Alkany są chemicznie nieaktywne. Ulegają jedynie
reakcji ............................................... z chlorowcami w
obecności światła
HX
X
R
X
H
R
hν
2
+
−
→
+
−
HBr
Br
CH
Br
CH
3
hν
2
4
+
→
+
substytucji (podstawienia)

2011-11-09
31
Reakcje otrzymywania
4
3
aq
3
4
3CH
4AlCl
12HCl
C
Al
++++
→
→
→
→
++++
2
2
2
1
kat.
2
2
1
R
CH
CH
R
H
R
CH
CH
R
−−−−
−−−−
−−−−
→
→
→
→
++++
−−−−
====
−−−−
Metan otrzymuje się w reakcji węgliku glinu z kwasem
solnym
Wyższe homologi z węglowodorów nienasyconych w
reakcjach przyłączania wodoru
R
1
i R
2
oznacza alkil lub wodór
3
2
2
3
kat.
2
3
3
CH
CH
CH
CH
H
CH
CH
CH
CH
−−−−
−−−−
−−−−
→
→
→
→
++++
−−−−
====
−−−−
Ważna rola w środowisku
•Gaz cieplarniany (jeden z najbardziej
efektywnych)
•Efekt fermentacji metanowej
CH
4
Ważny surowiec w przemyśle chemicznym

2011-11-09
32
W
łaściwości metanu
Bezbarwny i bezwonny gaz, prawie dwukrotnie lżejszy od
powietrza. Występuje jako główny składnik gazu ziemnego
Pojawia się często w kopalniach, stąd nazwa
Wydziela się również z bagnisk wskutek rozkładu gnijących ciał
organicznych, dlatego też bywa nazywany
Jest bardzo łatwo zapalny, z powietrzem tworzy mieszaniny
wybuchowe, dlatego też stanowi duże zagrożenie w górnictwie.
Przy dostatecznie dużym dostępie powietrza, metan spala się
słabo widocznym płomieniem na dwutlenek węgla i wodę
gaz kopalniany
gazem błotnym
INNE ALKANY
Występują w przyrodzie
Gaz ziemny: metan, etan, propan, wyższe do C
7
Ropa naftowa: 30% - 80% mieszaniny alkanów
n-alkany do C
33
izoalkany do C
10
Wosk pszczeli – 10% alkanów do C
31
H
64
Skórka jabłek - C
27
H
56
i C
29
H
60
Liście kapusty - C
29
H
60
i

2011-11-09
33
INNE ALKANY
Zastosowanie:
propan- butan – gaz płynny
izobutan – aerozole - dezodoranty
Wyszukiwarka
Podobne podstrony:
CH II Z wyk 1a
5 Wykład Ch F II zasada1
zarz b9dzanie+finansami+ii+ +wyk b3ad1 QVLGLBWILTDNCJ4ZRMXQBDVVLFLOIC2DZFQIPRY
Biotechnologia II- wyk, Metabolizm to ogół przemian biochemicznych zachodzących w komórkach umożliwi
Organizacja zarzadzanie i funkcje II wyk
II Wyk-ad (studenci) Metody analizy....
zarz b9dzanie+finansami+ii+ +wyk b3ad+3+ 2824 10 2005 29 4IZCMOGXOJNMP5V74PSQ7X6DACOYTF47UQYPCEA
zarz b9dzanie+finansami+ii+ +wyk b3ad+2+ 2817 10 2005 29 WVDK6WE6KAD7RE4XECWU4H2KEA43EGQV32S6EVA
Wykład Ch F II zasada
Semestr II Wyk ad 9
Semetr II Wyk ad 8
Semestr II Wyk ad 7
Semestr II Wyk ad 5
Semestr II Wyk ad 6
Semestr II Wyk ad 4
Semestr II Wyk ad 11
więcej podobnych podstron