PRZECIWCIAŁO - to białko skierowane przeciwko konkretnemu antygenowi;
Wydzielane są przez komórki plazmatyczne (czyli pobudzone limfocyty B) w przebiegu odpowiedzi immunologicznej typu humoralnego;
BUDOWA PRZECIWCIAŁA
-cząsteczka immunoglobuliny składa się z dwóch rodzajów łańcuchów polipeptydowych”
łańcucha lekkiego - L o masie 25 kDa
łańcucha ciężkiego - H o masie 50 kDa.
-L2H2 -skład podjednostek w cząsteczce przeciwciała;
-łańcuch L połączony jest z łańcuchem H wiązaniem dwusiarczkowym;
-łańcuchy H są związane ze sobą przynajmniej jednym wiązaniem dwusiarczkowym;
-łańcuch L zawiera dwie domeny homologiczne;
-każdy z łańuchów H ma cztery domeny immunoglobulinowe;
-przeciwciało przyjmuję konformację przypominającą kształtem literę Y;
__________________________________________________________________________________
- fragment Fc - zawiera dwie końcowe domeny immunoglobulinowe, znajdujące się na końcach karboksylowych każdego łańcucha H; nie wiąże antygenu, pośredniczy w procesach obronnych zwanych funkcjami efektorowymi;
- fragment Fab - utworzone przez 2 domeny immunoglobulinowe z końców aminowych każdego z łańcuchów H i dwie domeny z końców aminowych każdego z łańcuchów L; zdolne do wiązania antygenu;
Każdy z fragmentów Fab zawiera 1 miejsce wiązania antygenu. Ponieważ nienaruszona cząsteczka IgG ma 2 składniki Fab, przeto ma 2 miejsca wiązania antygenu i może się krzyżowo wiązać z licznymi antygenami. Dwa fragmenty Fab i fragment Fc w nienaruszonej cząsteczce IgG połączone są ze sobą elastycznym fragmentem polipeptydowym, który pozwala na zmianę szerokości kąta między podjednostkami Fab. Ten rodzaj ruchliwości zwany jest zmiennością segmentalną(ułatwia tworzenie kompleksów antygen-przeciwciało).
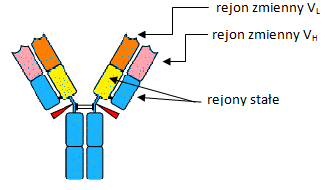
REJONY ZMIENNE I STAŁE
Połowa łańcucha L z końca karboksylowego i ¾ łańcucha H z końca karboksylowego są bardzo podobne we wszystkich przeciwciałach;
Fragment białka na końcu aminowym każdego z łańcuchów jest znacznie zmienny - zawiera 3 hiperzmienne rejony zbudowane z 7 do 12 aminokwasów;
Rejony zmienne - domeny immunoglobulinowe zlokalizowane na końcu aminowym każdego z łańcuchów;
Rejony stałe - pozostałe domeny immunoglobulinowe, bardzo podobne we wszystkich przeciwciałach
REJONY ZMIENNE. Dwa różne przedstawienia rejonów zmiennych łańcucha L (kolor żółty) i łańcucha H (kolor niebieski); regiony determinujące dopasowanie (CDR) są oznaczone kolorem czerwonym. Sześć regionów CDR łączy się razem tworząc miejsce wiązania.
ZWINIĘCIE IMMUNOGLOBULINOWE
Zwiniecie immunoglobulinowe. Domena immunoglobulinowa składa się z dwóch powierzchni o strukturze harmonijki β, połączonych wiązaniem dwusiarczkowym i oddziaływaniami hydrofobowymi. Na jednym z końców takiej struktury znajdują się 3 hiperzmienne pętle (=regiony determinujące dopasowanie=CDR). Trzy pętle (zawierające hiperzmienne sekwencje) tworzą potencjalną powierzchnię wiążącą antygen.
Zmienność sekwencji aminokwasowych w pętlach jest odpowiedzialna za powstanie szerokiego zestawu zróżnicowanych przeciwciał.
Lokalizacja końców N i C na przeciwległych końcach cząsteczki przeciwciała umożliwia rozciągniecie się domen i formowanie łańcuchów L i H.
Regiony kodujące łańcuchy lekkie kappa i gamma oraz region kodujący łańcuch ciężki. [Geny V (zmienności) nie kodują w całości regionu zmiennego łańcuchów L i H]
9. KLASY IMMUNOGLOBULIN
Immunoglobuliny należące do jednej z 5 klas zawierają taki sam łańcuch lekki połączony z innym łańcuchem ciężkim (γ, α, μ, δ lub ε). Dimer IgA oraz pentamer IgM poza łańcuchami L i H mają dodatkowo mały łańcuch polipeptydowy.
10. WŁAŚCIWOŚCI PRZECIWCIAŁ
1.Wiążą antygeny na powierzchni niektórych komórek np.
zakażonych wirusami lub nowotworowych, dzięki czemu
mogą indukować ich zniszczenie przez:
A) aktywację dopełniacza;
B) Indukcję immunofagocytozy;
C) Indukcje cytotoksycznosci komórkowej zależnej od przeciwciał;
2.Wiążąc antygen na powierzchni mikroorganizmów mogą
blokować ich wnikanie np. przez nabłonek jelit;
3. Wiążąc toksyny mogą blokować ich działanie;
11. POWINOWACTWO - siła wiązania pojedynczej determinanty antygenowej przez miejsce wiążące antygen w cząsteczce przeciwciała; siła wiązania antygenu przez pojedynczy paratop;
12. WARTOŚCIOWOŚĆ - to liczba determinantów antygenowych, którą może wiązać cząsteczka przeciwciała;
13. ZACHŁANNOŚĆ (AWIDNOŚĆ) - siła wiązania przeciwciała z cząsteczką wielodeterminantowego antygenu;
14. IZO- ALLO- I IDIOTYPY
IZOTYPOWE - różnice w budowie łańcuchów ciężkich umożliwiają podział na klasy np. IgM iIgE, etc. I podklasy, jak IgG1 czy IgG2. Identyczne w obrębie gatunku (Gosia, Monika i Wojtek mają te same determinanty izotopowe na swoich cząsteczkach IgG).
ALLOTYPOWE - różnice w budowie łańcuchów ciężkich i lekkich, głównie częściach stałych; identyczne u danego osobnika, różne allele tego samego genu (IgG Kasi i Zbyszka skierowane przeciw antygenom A będą się różniły determinantami allotypowymi)
IDIOTYPOWE - różnice w budowie części zmiennych łańcuchów polipeptydowych; unikatowe dla danej klasy limfocytu B; jeden klon limfocytów B wytwarza cząsteczki przeciwciał o identycznych determinantach idiotypowych;
15. Cząsteczka immunoglobuliny traktowana
A) pepsyną:
b) papainą
Wyszukiwarka
Podobne podstrony:
Immunologia ćwiczenia
notatki wykłady ćwiczenia
ćw1-metody izolacji Ig-wysalanie, immunologia, ćwiczenia
Notatki z fizjologii (ćwiczenia), Fizjologia człowieka
Cwiczenia z immunologii, Ćwiczenia z immunologii
ćw1- metody izolacji IgM-sączenie molekularne, immunologia, ćwiczenia
notatki zpr, ćwiczenia
Notatki rachunkowość ćwiczenia
DMI, psychologiaWSFIZ-notatki, semestr 6, R.I. - ćwiczenia
notatki immuno, Lekarski, FARMAKOLOGIA, 2. semestr, 2sem
R 6 ZMIANA POSTAW, ⇒ NOTATKI, I semstr, !ĆWICZENIA, Psychologia społeczna (ćwiczenia)
notatki immuno, 2. Narzady limfatyczne-2, Immunologia rozrodu
WERSJE TESTU APIS i TMR, psychologiaWSFIZ-notatki, semestr 6, R.I. - ćwiczenia
R 3 ATRYBUCJE WNIOSKOWANIE NA PODSTAWIE ZACHOWANIA, ⇒ NOTATKI, I semstr, !ĆWICZENIA, Psychologia spo
Komórki układu immunologicznego ćwiczenia 1
Immunologia cwiczenia id 212060
e notatka Fizyka 2 cwiczenia id 149017
notatki immuno, 10. Dojrzewanie limfocytow, Immunologia rozrodu
więcej podobnych podstron