336 [1024x768]
AKTYWNOŚĆ ELEKTROLITÓW
w którym: /» — efektywna liczba solwatacji, czyli średnia liczba cząsteczek rozpuszczalnika w powłoce solwatacyjnej jonu (np. n = 3,5 dla NaCl), c — stężenie elektrolitu (mol • dm"3), A/,—masa cząsteczkowa rozpuszczalnika
r(mol dm_J) --
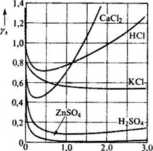
Rys. 5.5. Zależność współczynników aktywności mocnych elektrolitów od stężenia IIj
Równanie Stokesa-Robinsona (5.51) odtwarza wartości doświadczalnych współczynników aktywności w zależności od siły jonowej roztworu aż do około 4—7 M (rys. 5.5).
Hydratacyjne teorie współczynników aktywności
Konieczność uwzględnienia zjawiska hydratacji w obliczeniach współczynników aktywności uzmysławiane* sobie jeszcze przed powstaniem teorii Debye a-Huckela. Pierwszą próbę takich obliczeń podjął Bjerrum w 1919 r.
Teoria Bjerruma
Na cztery lata przed ogłoszeniem teorii Dcbyea-Hiickela, Bjerrum zwrócił uwagę na fakt, żc tworzenie przez jony hydratów, musi wywierać wpływ na ich aktywność. Przyjął on w istocie, że w wodnych roztworach elektrolitów istnieją równowagi typu:
(5.52)
K* +n+ • HjO = {K(H20)„+}+ gdzie K+ oznacza kation.
Wyszukiwarka
Podobne podstrony:
429 [1024x768] 438 ELEKTROCHEMIA w którym: n— liczba elektronów biorących udział w redukcji; F—stała
326 [1024x768] Aktywność elektrolitówAktywności jonów i średnia aktywność elektrolitu W równowagach
328 [1024x768] AKTYWNOŚĆ ELEKTROLITÓW 337 Pomiary średnich współczynników aktywności elektrolitów wy
330 [1024x768] AKTYWNOŚĆ ELEKTROLITÓW Istotną cechą zastosowanej przez Debye’a i Huckela metody jest
332 [1024x768] AKTYWNOŚĆ ELEKTROLITÓW 341 Równanie na zależność gęstości ładunku od odległości r prz
334 [1024x768] AKTYWNOŚĆ ELEKTROLITÓW 343 domo, że praca ładunku q w polu potencjału y> jest równ
338 [1024x768] AKTYWNOŚĆ ELEKTROLITOM W równaniach tych n, oznacza liczbę moli wody, x + jest ułamki
340 [1024x768] AKTYWNOŚĆ ELEKTROLITÓW 349 a korzystając z pojęcia średniego współczynnika aktywności
327 [1024x768] 336 ELEKTROCHEMIA Jeżeli współczynniki aktywności kationu i anionu oznaczyć przez y+
IMAG0222 Efektywna liczba atomowa i ekranowanie elektronów w atomach wieloelektronowych - teoria Sla
319 [1024x768] 328 ELEKTROCHEMIA Liczba elektronów otrzymanych na anodzie w wyniku reakcji utleniani
335 [1024x768] 344 ELEKTROCHEMIAWspółczynnik aktywności w bardziej stężonych roztworach Teoria Debye
439 [1024x768] 448 ELEKTROCHEMIA Średni współczynnik aktywności K2S04 w 0,01 molamym roztworze wodny
341 [1024x768] 350 ELEKTROCHEMIA Współczynnik aktywności y t może być wyliczony z równania (5.50) —
349 [1024x768] 358 ELEKTROCHEMIARównanie Nemsła na SEM ogniw galwanicznych Wyobraźmy sobie ogniwo w
361 [1024x768] 370 ELEKTROCHEMIARodzaje ogniw Ogniwa tworzenia Nazwą tą określa się dowolne ogniwo,
381 [1024x768] 390 ELEKTROCHEMIAMetody wyznaczania współczynników aktywności Wyznaczanie współczynni
385 [1024x768] 394 ELEKTROCHEMIA Wyznaczanie współczynników aktywności metodą izopiestyczną W poprze
więcej podobnych podstron