551 [1024x768]

KOAGULACJA UKŁADÓW KOLOIDALNYCH $61
procesu koagulacji. Kinetykę procesu koagulacji opracował Smoluchowski (1916).
>{ie wchodząc w rozważania ilościowe, możemy stwierdzić, że szybkość procesu koagulacji zależy od kilku czynników.
1) Promień działania sil przyciągania. Ze względu na naturę sił przyciągania (siły van der Waalsa), promień działania sił przyciągania jest bardzo mały —rzędu rozmiarów samych cząstek koloidalnych; jest on jednakże różny dla różnych elektrolitów. Wzrost promienia działania sił przyciągania zwiększa szybkość procesu koagulacji. Należy zaznaczyć, że rozważane siły przyciągania działają również pomiędzy cząstkami koloidalnymi o tym samym ładunku.
2) Szybkość ruchów Browna. Od szybkości ruchów Browna zależy liczba zderzeń cząstek koloidalnych w jednostce czasu — określa ją wielkość współczynnika dyfuzji. Stąd wynika także wpływ temperatury na szybkość procesu koagulacji.
3) Stężenie roztworu koloidalnego. Im większe stężenie roztworu koloidalnego, tym większa liczba zderzeń w jednostce czasu, a zatem i szybkość pro-cesu koagulacji.
4) Stężenie dodanego elektrolitu. Stężenie dodanego elektrolitu wywiera dość złożony wpływ na szybkość procesu koagulacji. Początkowe ilości dodawanego elektrolitu obniżają jedynie wartość potencjału elektrokinetycznego C i nie wywołują procesu koagulacji. Po osiągnięciu progu koagulacji, szybkość koagulacji gwałtownie wzrasta, aby ustali? się nii pewnej wartości. Dalszy wzrost stężenia nie wywołuje już wzrostu szybkości koagulacji (rys. 7.19).
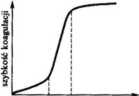
f =• 80 f = 30 C *= 0 stężenie elektrolitu Rys. 7.19. Wpływ stężenia elektrolitu na szybkość procesu koagulacji
Zakres stężeń elektrolitu, w którym następuje jedynie obniżenie wartości potencjału elektrokinetycznego £ (na rys. 7.19 od £ « 80 do £ = 30 mV) nosi nazwę obszaru powolnej koagulacji. Następuje po nim obszar szybkiej koagulacji, w trakcie którego potencjał elektrokinetyczny spada do zera. Należy nadmienić, że dalszy wzrost stężenia elektrolitu może w pewnych przypadkach doprowadzić do peptyzacji związanej z przeładowaniem zolu (zmianą znaku potencjału elektrokinetycznego £)•
M Chemia fizyczna dla przyrodników
Wyszukiwarka
Podobne podstrony:
546 [1024x768] Koagulacjaukładów koloidalnych Trwałość układów koloidalnych Roztwory koloidalne nie
547 [1024x768] KOAGULACJA UKŁADÓW KOLOIDALNYCH S57 Trwałość agregacyjna związana jest z odpornością
549 [1024x768] KOAGULACJA UKŁADÓW KOLOIDALNYCH 559 podwójnej warstwy elektrycznej, odpowiada wartośc
500 [1024x768] Charakterystyka ogólna układów koloidalnych Pojęcie koloidu (greckie *óxAa — klej) zo
502 [1024x768] CHARAKTERYSTYKA OGÓLNA UKŁADÓW KOLOIDALNYCH 5J3 Dowolną cząstkę będziemy uważali za k
503 [1024x768] 514 KOLOIDY Tabela 7.1 Podział układów koloidalnych te względu na stan
504 [1024x768] CHARAKTERYSTYKA OGÓLNA UKŁADÓW KOLOIDALNYCH 515 niecznc jest rozstrzygnięcie, co nale
506 [1024x768] CHARAKTERYSTYKA OGÓLNA UKŁADÓW KOLOIDALNYCH substancję w odpowiednim rozpuszczalniku
516 [1024x768] 527 WŁAŚCIWOŚCI KINETYCZNE UKŁADÓW KOLOIDALNYCH koloidalnej w odległości 6,31 cm od o
518 [1024x768] WŁAŚCIWOŚCI KINETYCZNE UKŁADÓW KOLOIDALNYCH 529 zatem ta = 2-3,14- 750 - 4710rad-s-ł
520 [1024x768] 531 WŁAŚCIWOŚCI KINETYCZNE UKŁADÓW KOLOIDALNYCHCiśnienie osmotyczne roztworów
522 [1024x768] Właściwości optyczne układów koloidalnych Jeżeli za pomocą odpowiedniego układu optyc
524 [1024x768] WŁAŚCIWOŚCI OPTYCZNE UKŁADÓW KOLOIDALNYCH kiem rozpraszającym (rozpuszczalnikiem), ta
526 [1024x768] WŁAŚCIWOŚCI OPTYCZNE UKŁADÓW KOLOIDALNYCH 537 Dla A = 0,1 A = 0.1 • 10"* = I0-*
528 [1024x768] WŁAŚCIWOŚCI OPrYCZNE UKŁADÓW KOLOIDALNYCH 539 Natężenie światła jest równe kwadratowi
więcej podobnych podstron