CCF20090327�018

52 M. CIOŁKOWSKI, E. BUDZISZ
Aktywność związków była porównywalna, zarówno w „tradycyjnej” hodowli komórkowej, jak i dla komórek tworzących sferoidy [10].
W początkowych badaniach nad związkami platyny stwierdzono brak aktywności /ra/w-diamminadichloroplatyny, co spowodowało, iż badacze skoncentrowali się głównie na kompleksach platyny o izomerii cis. Brak aktywności „transplatyny” może być spowodowany tworzeniem przez ten związek odmiennych, w porównaniu z cisplatyną, połączeń z DNA, które charakteryzują się inną budową przestrzenną. Różna jest również zdolność tych połączeń do oddziaływania z proteinami komórkowymi. W ostatnich latach wykazano, że modyfikacja „transplatyny” pozwala uzyskać związki o aktywności przeciwnowotworowej [11, 12]. Do tej grupy należą analogi „transplatyny”, w których cząsteczkę (lub cząsteczki) amoniaku zastąpiono cząsteczką płaskiej aminy aromatycznej, alkiloaminy lub iminoeteru [5]. Również w grupie kompleksów platyny(IV) poszukuje się analogów „transplatyny” o wysokiej cytotoksyczności.
W kolejnym, przytaczanym przez autorów niniejszego opracowania badaniu, porównywano cytotoksyczność kompleksu /ram-dichlorodihydrokso(dimetyloami-na)(izopropyloamina)platyna(IV)(Rys. 3) z cisplatyną i macierzystym kompleksem platyny(ll) [/ra«5-dichloro(dimetyloamina)(izopropyloamina)platyna(ll)] [13].
OH
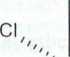
,x'NH2-CH(CH3)2
(CH3)2HNT Cl
OH
Rysunek 3. 7>ws-dichlorodiliydrokso(dimctyloamina)(izopropyloamina)pIatyna(IV) [13]
Eksperymenty dotyczące cytotoksyczności in vilro przeprowadzono na trzech parach linii komórkowych ludzkiego nowotworu jajnika, zarówno wrażliwych, jak i opornych nacisplatynę (oznaczanychjako „cisR”): 41M /41 McisR, CHI /CHlcisR oraz A2780 / A2780cisR.
W stosunku do linii komórkowych wrażliwych na cisplatynę, w zależności od zastosowanej linii komórkowej, kompleks platyny(lV) okazał się porównywalnie skuteczny z cisplatyną (linia A2780: IC50 dla badanego związku 5,7 pM, IC50 dla cisplatyny 4,0 pM) lub też od niej skuteczniejszy (linia CHI: ICJ0 dla badanego związku 7 pM, 1C5() dla cisplatyny 13 pM; linia 4 IM: IC5() odpowiednio 23,5 pM oraz 56 pM). Macierzysty kompleks platyny(II) był aktywniejszy od kompleksu pla-tyny(IV) jedynie w linii komórkowej 41M (wartości IC5(): linia komórkowa A2780 -9,0 pM; linia CHI - 19 pM; linia 41M - 13 pM).
Badania na liniach komórkowych opornych na cisplatynę wykazały większą skuteczność kompleksu platyny(IV) od cisplatyny (linia komórkowa A2780cisR:
win tł*.<ci 1C,() dla kompleksu platyny(I V) 8,4 pM, dla cisplatyny 58 pM; linia CHI cisR odpowiednio 5,7 pM i 50 pM; linia 41 McisR odpowiednio 1,3 pM i 128 pM). Kompleks macierzysty okazał się mniej aktywny (wartości IC5(): linia komórkowa A.’.780cisR - 57 pM, CHlcisR - 15 pM, 41 McisR - 54 pM).
/mina z linii komórkowych opornych na cisplatynę nie wykazała oporności na kompleks platyny(IV). W stosunku do macierzystego kompleksu jedynie komórki linii CIII cisR nie wykazały oporności.
Przeprowadzono również badanie zdolności związków do hamowania wzrostu guzów nowotworowych in vivo na myszach z wszczepionymi podskórnie fragmen-I,imi guza ludzkiego nowotworu jajnika linii CHI. Stwierdzono, że kompleks platy-ny(IV) wyraźnie hamował powiększanie guza, podczas gdy dla kompleksu macierzystego nie stwierdzono żadnej różnicy, w porównaniu z grupą kontrolną. Wynik badania może mieć związek z większą reaktywnością kompleksu platyny(II) i jego inaktywacją w środowisku biologicznym [13].
3. /WIĄZKI PLATYNY(IV) OBJĘTE BADANIAMI KLINICZNYMI
Zanim zostaną zaprezentowane aktualnie badane związki, należy wspomnieć o dwóch pochodnych platyny(IV), które wykazywały dużą aktywność cytotoksyczną w badaniach przedklinicznych, jednak wyniki późniejszych badań klinicznych nie były zadowalające. Są to iproplatyna oraz tetraplatyna (ormaplatyna) (Rys. 4).
a> fproP'3^3 b) tetraplatyna
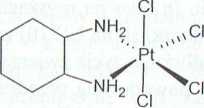
OH
CI/( | 0NHCH(CH3)2
C,^|SłHCH(CH3)2
OH
Rysunek 4. a) iproplatyna - cis, trans, cu-dichlorodihydroksobis(izopropyloamina)platyna(l V); b) tetraplatyna - (l,2-diaminocykloheksan)tetrachloroplatyna(IV) [I, 6]
Iproplatyna (cis, trans, c/.v-dichlorodihydroksobis(izopropyloamina)platyna(l V)) została wyselekcjonowana do badań w związku z wysoką rozpuszczalnością [2], W eksperymentach in vitro stwierdzono porównywalnązcisplatynąaktywność ipro-platyny wobec linii komórkowych mysiej białaczki P388 i mysiego czerniaka B-16 114]. W badaniu in vivo na myszach szczepu NMR1 z wszczepionym ludzkim nowotworem jądra (linie komórkowe wrażliwe na cisplatynę: H12.1, 2I02EP i 1428A oraz linia komórkowa oporna na cisplatynę-H23.1) zaobserwowano mniejsząsku-tcczność iproplatyny od cisplatyny w stosunku do komórek wrażliwych na cispla-
Wyszukiwarka
Podobne podstrony:
CCF20090327�014 44 M CIOŁKOWSKI, E. BUDZISZ Dr hab. n. farm. Ilżbietu Iłud/is/ ukończyła studia na W
CCF20090327�015 46 M. CIOŁKOWSKI, E. BUDZISZ 46 M. CIOŁKOWSKI, E.
CCF20090327�016 48 M. CIOŁKOWSKI, E. BUDZISZ aminy oraz dwie zdolne do wymiany grupy (aniony chlorko
CCF20090327�017 50 M. CIOŁKOWSKI, E. BUDZISZa) Pt(NH3)2CI4b) Pt(NH3)2CI2(OAc)2 c) Pt(NH3)2CI2(OH) Cl
CCF20090327�019 54 M. CIOŁKOWSKI, E BUDZISZ tynę. W przypadku linii komórkowej opornej na cisplatynę
CCF20090327�020 56 M. CIOŁKOWSKI, E. BUDZISZ Satraplatyna została wprowadzona do trzeciej fazy badań
CCF20090327�021 58 M. CIOŁKOWSKI, E. BUDZISZ lowymi w pozycjach aksjalnych [Pt(en)(N,)2(OH)2]. Kompl
1945-1989 + Początkowo aktywność społeczna była duża (uczestnictwo w głosowaniach, odradzanie się
Wyjaśnij, podając trzy argumenty, z czego wynika większa w Polsce aktywność zawodowa mężczyzn w poró
CCF20090605�026 52 stwa nowoczesnego język został zredukowany do jednego z wielu narzędzi. Każde zda
CCF20090605�082 164 nuje masy do rozpieszczonych dzieci93; porównanie to znajduje oddźwięk u tych wł
CCF20090702�006 12 Tadeusz Gadacz SP historia była boską »teodyceą«, podczas gdy czyn był świecki”1,
CCF20090702�026 52 Przerwanie immanencji bądź przyczynę, ustanawiającą wartość siłą własnego ruchu,
CCF20090831�038 52 Przedmowa mianą w ten sposób, że owa nierówność została z niej usunięta, tak jak
CCF20080116�019 428 PODSTAWY KOMUNIKACJI SPOŁECZNEJ teoretycznych i badaniach porównujących konkretn
CCF20080704�011 (2) 52 Komórki śródmiąższowe wydzieląją testosteron, który warunkuje rozwój przewodu
CCF20081011�011 (3) Białka Białka są to związki wysokocząsteczkowe, powstałe w wyniku połączenia sze
CCF20081206�071 drugie, trzeba stopniowo dążyć do osiągnięcia porównywalności etapów kształcenia ora
CCF20081222�011 59. Prawa do zakładania związków zawodowych nie mają: a)
więcej podobnych podstron