CCF20090327�017

Cl
OOCCH3
3'2 2' ’2
OH
o'CI
HtN
31'1/ ,
H3N
Cl
;pt
Pt
HtN
Cl
h3n
Cl
ÓOCCHj
h3n^^ "^ci
OH
d) Pt(en)CI4
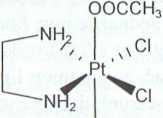
e) Pt(en)CI2(OAc)2 f) Pt(en)CI2(OH)2
-NH,
Cl
/
Pt
~NH,
Cl
*CI
OOCCH3
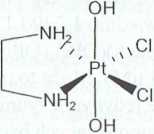
Rysunek 2. Kompleksy platyny(IV), pochodne cisplatyny (a, b, c) i pochodne dichloroetylenodiaminaplatyny(II) (d, e, I): a) diamminatetrachloroplatyna(IV); b) diamminadichlorodioctanoplatyna(IV); c) diamminadichlorodihydroksoplatyna(IV); d) tetrachloro(etylenodiamina)platyna(IV); c) dichloro(etylenodiamina)dioctanoplatyna(IV); f) dichloro(etylenodiamina)dihydroksoplatyna(IV) [8]
W badaniach tych próbowano ustalić:
- zależność między potencjałem redukcji a cytotoksycznością,
- wpływ potencjału redukcji na wchłanianie związku przez komórki,
- wpływ podstawników aksjalnych na lipofilowość kompleksu,
- wpływ lipofilowości kompleksów na wchłanianie związku przez komórki.
W badaniach potencjału redukcji stwierdzono, że zależy on w głównej mierze
od ligandów w pozycji aksjalnej. Analizowane związki uszeregowano pod względem wysokości potencjału redukcji (łatwości redukcji), w zależności od ligandu aksjalnego w następujący szereg (Cl > OAc > OH).
Cytotoksyczność związków była badana in vitro na trzech liniach komórek ludzkiego nowotworu jajnika (A2780, A2780R oraz A2780 473R). Aktywność cytotok-syczna kompleksów okazała się zależna od potencjału redukcji. Im wyższy potencjał (łatwiejsza redukcja), tym wyższą cytotoksyczność wykazywał związek. Jednakże autor zauważa, że iproplatyna, kompleks platyny(IV) o niskim potencjale redukcji, wykazuje dużą aktywność in vivo, co może sugeruje, że badanie toksyczności in vitro nie jest dobrą metodą selekcji kompleksów platyny(IV). Aktywność przeciwnowotworowa iproplatyny była tak wysoka, że została ona wyselekcjonowana do badań klinicznych, w których jednak okazała się mniej aktywna od cisplatyny i karboplatyny [6]. Przyczyną nieoczekiwanej aktywności in vivo hydroksylo-
_'_!_!_!_'_------1— - ~~ A. r*_u, M/1/ł-iilzn L' t A r i r\r\\x/-nlfijo niewielka ilość reaktywnych cząsteczek Pt(il), a niezredukowana część ma .misę dotrzeć do komórki w postaci pro-leku. Kompleksy łatwiej ulegające redukcji tworzą formy zdolne do reakcji z różnymi cząsteczkami biologicznymi (np. albuminami w krwioobiegu) i w ten sposób zmniejsza się ich szansa wniknięcia do wnę-Ii7,n komórki nowotworowej.
I Eksperymenty dotyczące wchłaniania związków przez komórki przeprowadzono In vitro na liniach komórek ludzkiego nowotworu jajnika (A2780 i A2780R). Zaobserwowano analogiczną do aktywności cytotoksycznej zależność między wchłanianiem związku ajego potencjałem redukcji.
Analizując wpływ ligandów aksjalnych na lipofilowość kompleksów stwierdzono, że podstawniki hydroksylowe obniżają wartość log P (zwiększają hydrofilo-wość cząsteczki) kompleksu platyny(IV) w porównaniu z macierzystym kompleksem platyny(II). Podobny, lecz mniejszy wpływ wykazują ligandy chlorkowe. Aniony kwasów karboksylowych zwiększająlipofilowość cząsteczki (wpływ ten rośnie wraz ze wzrostem długości łańcucha).
Obserwowano tendencję do wzrostu wchłaniania kompleksów przez komórki przy wzroście log P. W celu zbadania charakteru tej zależności (liniowa, paraboliczna), należałoby przeprowadzić badania na związkach wykazujących większe różnice w lipofilowości [8].
Kolejna seria badań Halla i in. dotyczyła wpływu środowiska guza na działanie kompleksów platyny(IV) [9-10].
W jednym z eksperymentów badano między innymi aktywność kompleksów platyny(IV) pochodnych [Pt(en)CI2] na wzrost komórek nowotworowych ludzkiego nowotworu jelita grubego linii DLD-1, tworzących in vitro steroidy wielokomórkowe (ang. multicellular tumour spheroids, MCTS). Zaletą takiego systemu jest środowisko bardziej podobne do środowiska guza in vivo (hipoksja, występowanie zarówno komórek aktywnie dzielących się, jak i nieulegających podziałom). W badaniu tym wykazano opóźnione i mniejsze działanie na wzrost guza kompleksów pla-lyny(l V), w poróv naniu ze związkiem macierzystym. Największą aktywnością wykazał się kompleks [Pt(en)Cl4] a nieco mniejszą kompleks [Pt(en)CI2(OH)2], Kompleks (Pt(en)CI2(OAc)2] w najmniejszym stopniu hamował wzrost wielkości sferoi-dów. Wynika z tego, że w badaniu bardziej przypominającym warunki in vivo potencjał redukcji nie jest już głównym czynnikiem wyznaczającym aktywność kompleksów [9],
Porównywano również siłę działania cisplatyny i kompleksów platyny(IV) (|Pt(NI 1,),CIJ, [Pt(NH3)2Cl2(OH)2], [Pt(NH3)2Cl2(OAc)2]) w warunkach normoksji i hipoksji. Hipoksja środowiska, charakterystyczna dla guzów nowotworowych, może wpływać na aktywność związków platyny (zmniejszona jest koncentracja glutationu, ale zwiększa się ilość metalotioneiny oraz aktywność enzymów naprawiających DNA). Badanie przeprowadzono na komórkach ludzkiego niedrobnokomórkowego raka płuc linii H226 oraz H520. Wykazano podobną efektywność tych kompleksów niezależnie od zawartości tlenu w środowisku, w którym hodowano komórki.
Wyszukiwarka
Podobne podstrony:
CCF20090327�021 58 M. CIOŁKOWSKI, E. BUDZISZ lowymi w pozycjach aksjalnych [Pt(en)(N,)2(OH)2]. Kompl
CCF20090327�014 44 M CIOŁKOWSKI, E. BUDZISZ Dr hab. n. farm. Ilżbietu Iłud/is/ ukończyła studia na W
CCF20090327�015 46 M. CIOŁKOWSKI, E. BUDZISZ 46 M. CIOŁKOWSKI, E.
CCF20090327�016 48 M. CIOŁKOWSKI, E. BUDZISZ aminy oraz dwie zdolne do wymiany grupy (aniony chlorko
CCF20090327�018 52 M. CIOŁKOWSKI, E. BUDZISZ Aktywność związków była porównywalna, zarówno w „tradyc
CCF20090327�019 54 M. CIOŁKOWSKI, E BUDZISZ tynę. W przypadku linii komórkowej opornej na cisplatynę
CCF20090327�020 56 M. CIOŁKOWSKI, E. BUDZISZ Satraplatyna została wprowadzona do trzeciej fazy badań
CCF20090704�027 56 Część I W tekście pt. Zasady natury i łaski oparte na rozumie, napisanym na dwa l
CCF20090704�027 56 Część I W tekście pt. Zasady natury i łaski oparte na rozumie, napisanym na dwa l
CCF20090704�027 56 Część I W tekście pt. Zasady natury i łaski oparte na rozumie, napisanym na dwa l
CCF20090701�026 50 E. Cassirer ~ O teorii względności Einsteina nej jedności pomiaru. Jak widać nie
CCF20090702�025 50 Przerwanie immanencji jednak sprawić, aby ideologia, choć już nieszkodliwa, nie p
CCF20090704�024 50 Część I To on jest przede wszystkim istotą niepokojącą i straszliwą, a tym narode
CCF20090831�037 50 Przedmowa Istwo bytu i wiedzy, lecz pozostają w prostej niezlożo-ności wiedzy, są
CCF20090303�023 50 Rodzaje determinizmu by się twierdzić, że w tych dziedzinach udało się nam dokona
CCF20090319�041 50 Różniczkowanie funkcji Oznaczenie pochodnej w symbolach różniczkowych dy_ _ df(x)
CCF20090625�032 50 Groza zjawiska i lęk oczekiwania. II rozumiem tę fazę czasu tragedii, w której tr
CCF20091012�044 50 Biojurysprudencja. Podstawy prawa dla XXI wieku europejskiego. Następnie uległ do
CCF20091211�013 50 Mil i znak tu. Oczekuje się natychmiastowego rezultatu: nieważne, że mit zostanie
więcej podobnych podstron