92736

Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 44

gdzie parametr
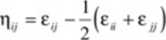
nosi nazwę energii wymiany.
3. Interpretacja energii wymiany.
Jakikolwiek proces zmiany liczby kontaktów, a więc każde przemieszczenie segmentu w obrębie węzłów sieci, może być przedstawiony schematycznie jako powstawanie dwóch kontaktów (i-j) z jednego kontaktu (i-i) i jednego kontaktu (j-j).
(i-i) + (j-j) *=> 2(i-j)
Z takim procesem związana jest zmiana energii Ae = (2Sjj - £„ - £jj), tożsama dwukrotności energii wymiany. Jeśli jest ona zerowa, wszystkie konfiguracje są równoważne energetycznie.
4. Podsumowanie i wnioski:
a) Energia sieci wynika z rozmieszczenia segmentów w węzłach sieci (konfiguracji).
b) Jednoznacznie określa ją liczba kontaktów pomiędzy różnymi segmentami - Ny.
c) Jeśli wszystkie energie wymiany równają się zeru. energia sieci nie zależy od konfiguracji.
5. Roztwór doskonały w świetle teorii siatkowej.
Przyjmujemy najdalej idące uproszczenia, tj:
1) Zerowanie energii wymiany.
2) Jednakowy kształt cząsteczek różnego rodzaju (każda z nich zajmuje jeden węzeł sieci). Konfiguracyjna funkcja podziału będzie miała postać
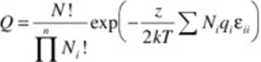
i-i
gdzie N = INi. Iloczyn w mianowniku wynika z nierozróżnialności cząsteczek.
Logarytmując i stosując przybliżenie Stirlinga otrzymujemy
In () = AMn Af - Af - £ Af, In JV, + £ AT, - ^
czyli
In^AMnAf-^TfylnAf,——
6. Potencjał chemiczny wyznaczamy poprzez różniczkowanie po liczbie cząsteczek. Ściśle mówiąc jest to jego część konfiguracyjna.
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 37 3. Oszacowanie liczby znajdujących się la
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 13 N.V 4. W stanie rozważanej równowagi, wsz
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 16 a=A/A-1 fi = -/iyk Pierwszy współczynnik
Chemia fizyczna - lermodyiutmika molekularna 2010/2011 32 Chemia fizyczna - lermodyiutmika molekular
Chemia fizyczna - termodynamika molekularna 2010/2011 1 Wykład 1.8.10.2010 1. Plan
Chemia fizyczna - termodynamika molekularna 2010/2011 50 nadmiarowa entropia nie może znikać. Ściśle
Chemia fizyczna - termodynamika molekularna 2010/2011 9 dziedzin ludzkiej aktywności. Warto zaznaczy
Chemia fizyczna - lermodyiutmika molekiilartui 2010/2011 23 Pauliego - tzn. żadne dwa fermiony w ukł
Chemia fizyczna - termodynamika molekularna 2010/2011 36 Wykład 1010.12.2010 1. Wyprowadzenie równan
Chemia fizyczna - termodynamika molekularna 2010/2011 43 Wykład 12 7.01.2011 1. Parametry struktural
Chemia fizyczna - termodynamika molekularna 2010/2011 8 Wykład 322.10.2010 1. Jaki
Chemia fizyczna - termodynamika molekularna 2010/2011 12 Wykład 4 29.10.2010 1. Trudności w bezpośre
Chemia fizyczna - termodynamika molekularna 2010/2011 20 Wykład 6 (skrócony)12.11.2010 1. Kontynuuje
Chemia fizyczna - termodynamika molekularna 2010/2011 31 Wykład 9 3.12.2010 1. Sym
Chrmia fizyczna - termodynamika molekularna 2010/2011 2 6. Przykład z życia. Chcemy znaleźć temperat
Chemia fizyczna ■ lermitdynamika molekiilarmi 2010/2011 28 4. Zalety równań ruchu
Chemia fizyczna - termodynamika molekularna 2009/2010 37 Wykład 10 11.12.2009 1. Równania stanu w te
Chemia fizyczna - termodynamika molekularna 2009/2010 52 Wykład 13 15.01.2010 1. O
więcej podobnych podstron