92739

Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 13
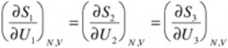
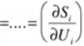
N.V
4. W stanie rozważanej równowagi, wszystkie układy charakteryzują się zatem taką samą wartością powyższych pochodnych. Jak widać, pochodne te mają duże znaczenie. Jak wiadomo z kursu podstawowego termodynamiki, pochodna ta stanowi definicję temperatury
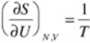
5. Inna definicja zespołu kanonicznego - jest to zbiór układów różniących się mikrostanami kwantowymi, a charakteryzujących się stałą wartością parametrów N,V,T.
6. Zespół kanoniczny można rozszerzyć uzmicnniając liczbę cząsteczek N. zachowując wymóg izolacji całego zbioru i istnienie wzajemnej równowagi pomiędzy układami. Uzyskujemy wtedy wielki zespół kanoniczny.
Podobne wyprowadzenie doprowadzi do stałości temperatury oraz stałości poniższej pochodnej
consl
m,r
dla każdego układu.
u.
Pochodna ta to oczywiście -£■ (udowodnić !). jeśli prawdziwe jest nasze podejrzenie, że
entropia statystyczna jest równoważna entropii fenomenologicznej, zdefiniowanej poprzez II Zasadę.
A zatem można oczekiwać, że wielki zespół kanoniczny to zbiór układów różniących się mikrostanami. a zachowujących tę samą wartość fi.V.T. W przypadku układu wieloskładnikowego, zawierającego cząsteczki różnego rodzaju, można zbudować zespół, w którym stałe są wartości potencjałów chemicznych wszystkich składników.
7. Oczywista (rodność w posługiwaniu się innymi zespołami niż mikrokanoniczny polega na tym, że zasada równych prawdopodobieństw obowiązuje dla zespołu mikrokanonicznego. Aby ułatwić sobie życie sięgnijmy do uzupełnień z matematyki.
8. Dla rozkładu prawdopodobieństwa (P1.p2.--Pn) definiuje się funkcję zwaną entropia informacji (S)
S = - k V pt In pt gdzie k jest stałą proporcjonalności.
Znaczenie entropii informacji wynika z następującego twierdzenia:
Najbardziej prawdopodobny (przypadkowy) rozkład prawdopodobieństwa odpowiada maksymalnej wartości entropii informacji.
Im niższa entropia, tym większa ilość informacji i mniej przypadkowy rozkład. Najbardziej przypadkowy (równomierny) odpowiada największej wartości entropii informacji.
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 37 3. Oszacowanie liczby znajdujących się la
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 44 gdzie parametr nosi nazwę energii wymiany
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 16 a=A/A-1 fi = -/iyk Pierwszy współczynnik
Chemia fizyczna - lermodyiutmika molekularna 2010/2011 32 Chemia fizyczna - lermodyiutmika molekular
Chemia fizyczna - termodynamika molekularna 2010/2011 1 Wykład 1.8.10.2010 1. Plan
Chemia fizyczna - termodynamika molekularna 2010/2011 50 nadmiarowa entropia nie może znikać. Ściśle
Chemia fizyczna - termodynamika molekularna 2010/2011 9 dziedzin ludzkiej aktywności. Warto zaznaczy
Chemia fizyczna - lermodyiutmika molekiilartui 2010/2011 23 Pauliego - tzn. żadne dwa fermiony w ukł
Chemia fizyczna - termodynamika molekularna 2010/2011 36 Wykład 1010.12.2010 1. Wyprowadzenie równan
Chemia fizyczna - termodynamika molekularna 2010/2011 43 Wykład 12 7.01.2011 1. Parametry struktural
Chemia fizyczna - termodynamika molekularna 2010/2011 8 Wykład 322.10.2010 1. Jaki
Chemia fizyczna - termodynamika molekularna 2010/2011 12 Wykład 4 29.10.2010 1. Trudności w bezpośre
Chemia fizyczna - termodynamika molekularna 2010/2011 20 Wykład 6 (skrócony)12.11.2010 1. Kontynuuje
Chemia fizyczna - termodynamika molekularna 2010/2011 31 Wykład 9 3.12.2010 1. Sym
Chrmia fizyczna - termodynamika molekularna 2010/2011 2 6. Przykład z życia. Chcemy znaleźć temperat
Chemia fizyczna ■ lermitdynamika molekiilarmi 2010/2011 28 4. Zalety równań ruchu
Chemia fizyczna - termodynamika molekularna 2009/2010 52 Wykład 13 15.01.2010 1. O
Chemia fizyczna - termodynamika molekularna 2009/2010 37 Wykład 10 11.12.2009 1. Równania stanu w te
więcej podobnych podstron