3582327821
Chemia fizyczna - termodynamika molekularna 2010/2011 20
Wykład 6 (skrócony)
12.11.2010
1. Kontynuujemy całkowanie przy obliczaniu cząsteczkowej funkcji podziału dla jednoatomowego gazu doskonałego.
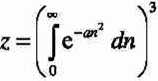
(2xmkTY2
< h2 >
co wynika ze wzoru na poniższą całkę oznaczoną
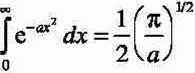
Uwaga! Zastąpienie sumy przez całkę nie zawsze jest uzasadnione. Błąd, który popełniamy przy tej operacji jest tyra mniejszy im mniejsza jest wartość parametru a. Dobrą dokładność zapewniają „odpowiednio” wysokie temperatury i „odpowiednio” duże masy cząsteczek. W praktyce oznacza to konieczność bezpośredniego sumowania dla cząstek elementarnych (nawet dla wysokich temperatur) oraz dla wodoru i helu dla niskich temperatur. Jeśli pominiemy temperatury niezmiernie bliskie zeru bezwzględnemu, dla wszystkich pozostałych sytuacji całkowanie zapewnia wystarczaj ącą dokładność.
Ostatecznie więc funkcja podziału dla N jednoatomowych cząsteczek czystego gazu doskonałego powinna wynosić
^(2iunkT\w\7N _ V»
l h2 J A3N
gdzie
(27tmk T)m
Parametr A nosi nazwę długości termicznej fali de Broglie'a.
Znak zapytania pojawił się dlatego, że bardziej szczegółowa analiza funkcji podziału sugeruje jej niepoprawność (a jednak!). Nie przywiązujmy się zatem do tej formy, ponieważ będzie musiała być skorygowana.
2. Ale sprawdźmy, czy rzeczywiście prowadzi ona do właściwego równania stanu. To ostatnie wynika z elementarnej tożsamości termodynamicznej
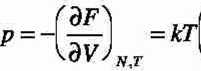
3lnZ
dV
N,T
Stąd, dla InZ = Mn V - 3NhxA(T) otrzymujemy NkT
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - termodynamika molekularna 2010/2011 1 Wykład 1.8.10.2010 1. Plan
Chemia fizyczna - termodynamika molekularna 2010/2011 36 Wykład 1010.12.2010 1. Wyprowadzenie równan
Chemia fizyczna - termodynamika molekularna 2010/2011 43 Wykład 12 7.01.2011 1. Parametry struktural
Chemia fizyczna - termodynamika molekularna 2010/2011 8 Wykład 322.10.2010 1. Jaki
Chemia fizyczna - termodynamika molekularna 2010/2011 12 Wykład 4 29.10.2010 1. Trudności w bezpośre
Chemia fizyczna - termodynamika molekularna 2010/2011 31 Wykład 9 3.12.2010 1. Sym
Chemia fizyczna - termodynamika molekularna 2010/2011 50 nadmiarowa entropia nie może znikać. Ściśle
Chemia fizyczna - termodynamika molekularna 2010/2011 9 dziedzin ludzkiej aktywności. Warto zaznaczy
Chemia fizyczna - termodynamika molekularna 2009/2010 37 Wykład 10 11.12.2009 1. Równania stanu w te
Chemia fizyczna - termodynamika molekularna 2009/2010 52 Wykład 13 15.01.2010 1. O
Chemia fizyczna - termodynamika molekularna 2009/2010 32 Wykład 9 4.12.2009 1. Uogólniona funkcja po
Chemia fizyczna - termodynamika molekularna 2009/2010 20 4. Sprawdzamy ekstensywno
Chemia fizyczna - termodynamika molekularna 2009/2010 1 Wykład 1. 2.10.2009 1. Pla
Chemia fizyczna - termodynamika molekularna 2009/2010 42 Wykładll 18.12.2008 1. Roztwór doskonały w
Chemia fizyczna - termodynamika molekularna 2009/2010 11 Wykład 4 23.10.2009 1.
Chemia fizyczna - termodynamika molekularna 2009/2010 15 Wykład 5 30.10.2009 1. Wa
Chemia fizyczna - termodynamika molekularna 2009/2010 19 Wykład 6 5.11.2009 1. Wątpliwość (wyrażona
Chemia fizyczna - termodynamika molekularna 2009/2010 7 6. Przykład z życia. Chcemy znaleźć temperat
Chemia fizyczna - termodynamika molekularna 2009/2010 38 Chemia fizyczna - termodynamika molekularna
więcej podobnych podstron