3582327800
Chemia fizyczna - termodynamika molekularna 2009/2010 42
Wykładll
18.12.2008
1. Roztwór doskonały w świetle teorii siatkowej.
Zakładamy:
1) Zerowanie energii wymiany.
2) Jednakowy kształt cząsteczek różnego rodzaju (każda z nich zajmuje jeden węzeł sieci). Konfiguracyjna funkcja podziału będzie miała postać
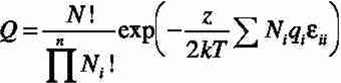
i=1
gdzie N = IN i. Iloczyn w mianowniku wynika z nierozróżnialności cząsteczek. Logarytmując i stosując przybliżenie Stirlinga otrzymujemy to e = N to N - N - £ N, ta AT, + £ AT, czyli
lne = WtoJV-XJV,toJV,-^|rXiv<«A
2. Potencjał chemiczny wyznaczamy poprzez różniczkowanie po liczbie cząsteczek. Ściśle mówiąc jest to jego część konfiguracyjna.
= -kT
f *F\ ,jf dlng^
^ dN* ' ry,Nitt lik/kT = -(hiN+l-hiNk-l-^qkEkk)
—kTlaxk +“#*£**
~—qkc& (potencjał chemiczny dla czystego składnika) I ostatecznie
P-* (2™, p,xk) = p°(r, p) + RZln**
po przejściu do molowego potencjału chemicznego.
Otrzymany wynik jest ogólny i nie ogranicza się tylko do konfiguracyjnej funkcji podziału. Pozostałe elementy funkcji podziału (wynik całkowania po pędach oraz udziały kwantowe) są takie same dla cząsteczki w czystym składniku jak i w mieszaninie i ulegną wykasowaniu podczas wyprowadzenia. A to dzięki temu, że powyższe równanie ma charakter różnicy potencjałów pomiędzy dwoma stanami - składnikiem w mieszaninie i czystą substancją.
3. Otrzymujemy ostatecznie równanie opisujące potencjał chemiczny składnika w roztworze doskonałym, zgodne z jego definicją fenomenologiczną. Założenia, które zostały przyjęte na początku wyprowadzenia, stanowią zatem warunki doskonałości w świetle teorii siatkowej. Są one mniej restrykcyjne niż w tradycyjnej molekularnej interpretacji roztworu doskonałego, gdzie wymaga się, aby wszystkie oddziaływania pomiędzy cząsteczkami były sobie równe.
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - termodynamika molekularna 2009/2010 37 Wykład 10 11.12.2009 1. Równania stanu w te
Chemia fizyczna - termodynamika molekularna 2009/2010 52 Wykład 13 15.01.2010 1. O
Chemia fizyczna - termodynamika molekularna 2009/2010 32 Wykład 9 4.12.2009 1. Uogólniona funkcja po
Chemia fizyczna - termodynamika molekularna 2009/2010 11 Wykład 4 23.10.2009 1.
Chemia fizyczna - termodynamika molekularna 2009/2010 15 Wykład 5 30.10.2009 1. Wa
Chemia fizyczna - termodynamika molekularna 2009/2010 19 Wykład 6 5.11.2009 1. Wątpliwość (wyrażona
Chemia fizyczna - termodynamika molekularna 2009/2010 1 Wykład 1. 2.10.2009 1. Pla
Chemia fizyczna - termodynamika molekularna 2009/2010 7 6. Przykład z życia. Chcemy znaleźć temperat
Chemia fizyczna - termodynamika molekularna 2009/2010 38 Chemia fizyczna - termodynamika molekularna
Chemia fizyczna - termodynamika molekularna 2009/2010 43 M(xlel roztworu doskonałego jest stosowany
Chemia fizyczna - termodynamika molekularna 2009/2010 48 ln(? = ln#- kT ^ i Wyrażenie na potencjał
Chemia fizyczna - termodynamika molekularna 2009/2010 53 poprawki i często bywają w ogóle pomijane.
Chemia fizyczna - termodynamika molekularna 2009/2010 8 wnętrze Słońca - 2 000 000 K Czy istnieje sz
Chemia fizyczna • termodynamika molekularna 2009/2010 12 4. W stanic rozważanej równowagi, wszystkie
Chemia fizyczna - termodynamika molekularna 2009/2010 16 występujący w róźnic/cc zupełnej energii
Chemia fizyczna - termodynamika molekularna 2009/2010 20 4. Sprawdzamy ekstensywno
Chemia fizyczna - termodynamika molekularna 2009/2010 25 ć)H dH —— = q.
Chemia fizyczna - termodynamika molekularna 2009/2010 29 Chemia fizyczna - termodynamika molekularna
Chemia fizyczna • termodynamika molekularna 2009/2010 33 Konfiguracyjna funkcja podziału będzie równ
więcej podobnych podstron