92731
Chemia fizyczna - termodynamika molekularna 2009/2010 29
Chemia fizyczna - termodynamika molekularna 2009/2010 29
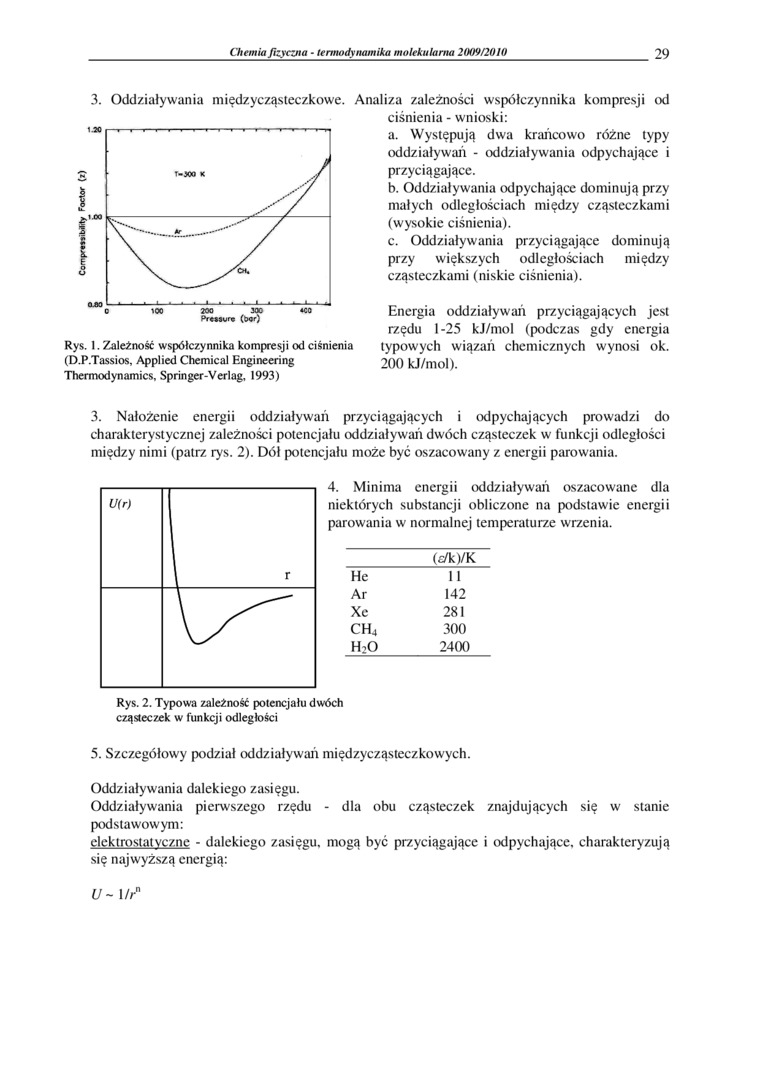
3. Oddziaływania miedz ycząsteczkowe. Analiza zależności współczynnika kompresji od
ciśnienia - wnioski:
(I) JOPOJ

Rys. I. Zależność współczynnika kompresji od ciśnienia (D.P.Tassios, Applied Chemical Engineering Thermodynamics, Springer-Yerlag, 1993)
a. Występują dwa krańcowo różne typy oddziaływali - oddziaływania odpychające i przyciągające.
b. Oddziaływania odpychające dominują przy małych odległościach między cząsteczkami (wysokie ciśnienia).
c. Oddziaływania przyciągające dominują przy większych odległościach między cząsteczkami (niskie ciśnienia).
Energia oddziaływali przyciągających jest rzędu 1-25 kJ/mol (podczas gdy energia typowych wiązań chemicznych wynosi ok. 200 kJ/mol).
3. Nałożenie energii oddziaływań przyciągających i odpychających prowadzi do charakterystycznej zależności potencjału oddziaływali dwóch cząsteczek w funkcji odległości między nimi (patrz rys. 2). Dół potencjału może być oszacowany z energii parowania.
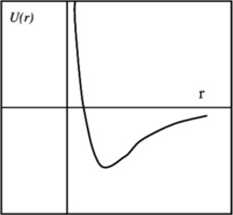
Rys. 2. Typowa zależność potencjału dwóch cząsteczek w funkcji odległości
4. Minima energii oddziaływali oszacowane dla niektórych substancji obliczone na podstawie energii parowania w normalnej temperaturze wrzenia.
_(e/k)/K
H2Q_2400
5. Szczegółowy podział oddziaływali międzycząsteczkowych.
Oddziaływania dalekiego zasięgu.
Oddziaływania pierwszego rzędu - dla obu cząsteczek znajdujących się w stanie podstawowym:
elektrostatyczne - dalekiego zasięgu, mogą być przyciągające i odpychające, charakteryzują się najwyższą energią:
U - \/r
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - termodynamika molekularna 2009/2010 37 Wykład 10 11.12.2009 1. Równania stanu w te
Chemia fizyczna - termodynamika molekularna 2009/2010 52 Wykład 13 15.01.2010 1. O
Chemia fizyczna - termodynamika molekularna 2009/2010 32 Wykład 9 4.12.2009 1. Uogólniona funkcja po
Chemia fizyczna - termodynamika molekularna 2009/2010 7 6. Przykład z życia. Chcemy znaleźć temperat
Chemia fizyczna - termodynamika molekularna 2009/2010 38 Chemia fizyczna - termodynamika molekularna
Chemia fizyczna - termodynamika molekularna 2009/2010 43 M(xlel roztworu doskonałego jest stosowany
Chemia fizyczna - termodynamika molekularna 2009/2010 48 ln(? = ln#- kT ^ i Wyrażenie na potencjał
Chemia fizyczna - termodynamika molekularna 2009/2010 53 poprawki i często bywają w ogóle pomijane.
Chemia fizyczna - termodynamika molekularna 2009/2010 8 wnętrze Słońca - 2 000 000 K Czy istnieje sz
Chemia fizyczna • termodynamika molekularna 2009/2010 12 4. W stanic rozważanej równowagi, wszystkie
Chemia fizyczna - termodynamika molekularna 2009/2010 16 występujący w róźnic/cc zupełnej energii
Chemia fizyczna - termodynamika molekularna 2009/2010 20 4. Sprawdzamy ekstensywno
Chemia fizyczna - termodynamika molekularna 2009/2010 25 ć)H dH —— = q.
Chemia fizyczna • termodynamika molekularna 2009/2010 33 Konfiguracyjna funkcja podziału będzie równ
Chemia fizyczna - termodynamika molekularna 2009/2010 1 Wykład 1. 2.10.2009 1. Pla
Chemia fizyczna - termodynamika molekularna 2009/2010 42 Wykładll 18.12.2008 1. Roztwór doskonały w
Chemia fizyczna - termodynamika molekularna 2009/2010 11 Wykład 4 23.10.2009 1.
Chemia fizyczna - termodynamika molekularna 2009/2010 15 Wykład 5 30.10.2009 1. Wa
Chemia fizyczna - termodynamika molekularna 2009/2010 19 Wykład 6 5.11.2009 1. Wątpliwość (wyrażona
więcej podobnych podstron