92737

Chemia fizyczna - termodynamika molekularna 2010/2011 50
nadmiarowa entropia nie może znikać. Ściśle zatem mówiąc, roztwór regularny nie istnieje -pojawienie się udziału entalpowego w funkcji G*' wnosi swój wkład do nadmiarowej entropii. W praktyce posługujemy się pojęciem roztworu regularnego dla takich układów, w których wpływ nadmiarowej entropii na G* jest pomijalnie mały w porównaniu z udziałem nadmiarowej entalpii.
Zagadnienie znalezienia konfiguracji równowagowej rozwiązuje się dwojako. Obie metody są przybliżone.
2. Przybliżenie kwazychemiczne, czyli pierwsza aproksymacja. Opiera się na zależności g(Nij) zaproponowanej przez Guggenheima. Jest to wyrażenie przybliżone. Funkcja dokładna jest na tyle skomplikowana, że nie może być stosowana w praktycznych zastosowaniach. W wyniku podstawienia do równania (3) otrzymuje się nieliniowy układ równali (układ kwazychemiczny). który należy rozwiązać względem Nij. Dość zaskakująca postać końcowych równali tłumaczy nazwę metody - patrz poniżej
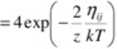
(5)
Widać tutaj analogię do równości pomiędzy ilorazem reakcji (lewa strona) i stałą równowagi rcakcji chemicznej (prawa strona). Stąd właśnie bierze się nazwa „kwazychemiczny". Przypominam, że powstawanie kontaktów' ij można przedstawić jak proces
Przybliżenie kwazychemiczne stanowi eleganckie rozwiązanie problemu znalezienia funkcji podziału dla roztworu regularnego. Jego wadą jest dość skomplikowana forma równań modelowych, szczególnie dla układów złożonych z dużej liczby różnych segmentów.
Jak widać z równania (5). liczby kontaktów zależą od energii oddziaływali pomiędzy nimi. Tak więc stężenia lokalne (bezpośrednio wokół segmentu) różnią się od stężeń średnich.
3. Prostsza (i mniej ścisła metoda) nosi nazwę przybliżenia Brugga-Willianisa. czyli zerowej aproksymacji.
Zakłada się, że pomimo niezerowych energii wymiany, udział kombinatoryczny nie zależy od konfiguracji. Może być zatem taki sam jak w roztworze doskonałym czy atermalnym. Natomiast konfigurację równowagową wyznacza się ignorując różnice pomiędzy stężeniami lokalnymi a średnimi. Czyli przy założeniu swobodnego mieszania.
4. Wyznaczenie równowagowej konfiguracji w przybliżeniu Bragga-Williamsa.
Spośród zq, zewnętrznych kontaktów cząsteczki i. średnio będzie zNifii/z&ijNj kontaktów typu M*. W ogólnym zatem przypadku musi być
zti (i N N
= ' * ’ 1 = Z0,0, N dla kontaktów pomiędzy segmentami typu i-k
gdzie 0, jest ułamkiem kontaktów zewnętrznych określonego typu. zdefiniowanym jako
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - termodynamika molekularna 2010/2011 1 Wykład 1.8.10.2010 1. Plan
Chemia fizyczna - termodynamika molekularna 2010/2011 9 dziedzin ludzkiej aktywności. Warto zaznaczy
Chemia fizyczna - termodynamika molekularna 2010/2011 36 Wykład 1010.12.2010 1. Wyprowadzenie równan
Chemia fizyczna - termodynamika molekularna 2010/2011 43 Wykład 12 7.01.2011 1. Parametry struktural
Chemia fizyczna - termodynamika molekularna 2010/2011 8 Wykład 322.10.2010 1. Jaki
Chemia fizyczna - termodynamika molekularna 2010/2011 12 Wykład 4 29.10.2010 1. Trudności w bezpośre
Chemia fizyczna - termodynamika molekularna 2010/2011 20 Wykład 6 (skrócony)12.11.2010 1. Kontynuuje
Chemia fizyczna - termodynamika molekularna 2010/2011 31 Wykład 9 3.12.2010 1. Sym
Chrmia fizyczna - termodynamika molekularna 2010/2011 2 6. Przykład z życia. Chcemy znaleźć temperat
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 37 3. Oszacowanie liczby znajdujących się la
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 44 gdzie parametr nosi nazwę energii wymiany
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 13 N.V 4. W stanie rozważanej równowagi, wsz
Chemia fizyczna - lermodyiutmika molekulartui 2010/2011 16 a=A/A-1 fi = -/iyk Pierwszy współczynnik
Chemia fizyczna - lermodyiutmika molekularna 2010/2011 32 Chemia fizyczna - lermodyiutmika molekular
Chemia fizyczna - termodynamika molekularna 2009/2010 37 Wykład 10 11.12.2009 1. Równania stanu w te
Chemia fizyczna - termodynamika molekularna 2009/2010 52 Wykład 13 15.01.2010 1. O
Chemia fizyczna - termodynamika molekularna 2009/2010 32 Wykład 9 4.12.2009 1. Uogólniona funkcja po
Chemia fizyczna - termodynamika molekularna 2009/2010 7 6. Przykład z życia. Chcemy znaleźć temperat
więcej podobnych podstron