
1
Chemia Fizyczna
Technologia Chemiczna II rok
Wykład 1
Kierownik przedmiotu:
Dr hab. inż. Wojciech Chrzanowski
Pozostali prowadzący:
ćwiczenia rachunkowe
Dr inż. Marek Kluczkowski
Dr inż. Roman Pastewski
Sam też prowadzę 2 grupy.
Laboratorium:
kierownik laboratorium:
dr inż. Roman Pastewski

2
Chem. Fiz. TCH II/01
2
Kontakt,informacja i konsultacje
• tablica ogłoszeń Katedry Chemii Fizycznej
http://www.pg.gda.pl/chem/Dydaktyka/ lub
http://www.pg.gda.pl/chem/Katedry/Fizyczna
• Konsultacje: wtorki 16-17, czwartki 13-15.
• Chemia „A”; pokój 307
• Telefon: 347-2769
• E-mail: wojtek@chem.pg.gda.pl
Brak czasu i miejsca na omówienie szczegółów technicznych zaliczania
przedmiotu.
Obowiązuje to co już wisi w gablocie i jest w sieci WWW

3
Chem. Fiz. TCH II/01
3
Definicja dziedziny nauki
¾Przedmiot:
Przemiany fizyczne i chemiczne materii (bez wyróżniana jej rodzaju)
i związane z nimi przepływy energii.
¾Metoda:
Matematyczno-fizyczna, tj. tworzenie modeli teoretycznych w
oparciu o obserwacje doświadczalne. Formułowanie hipotez, teorii
oraz praw natury w odniesieniu do swojego przedmiotu.
Co to jest chemia fizyczna?
Przedmiot nie jest tu wyróżniony na zasadzie rodzaju materii, jak w chemii
nieorganicznej, organicznej, czy biochemii, chemii polimerów, peptydów, itp.
Chemia fizyczna jest teorią chemii. Mogą oczywiście istnieć takie przedmioty
jak Fizyczna Chemia Nieorganiczna, Fizyczna Chemia Organiczna.
Nazwę swą Chemia Fizyczna zyskała w XIX wieku, kiedy to zaczęto do chemii
przykładać rygory (i metodę) fizyki.
Działy chemii fizycznej związane z oddziaływaniem specyficznych energii na
materię
Fizyka chemiczna.
Działy (subdyscypliny) chemii fizycznej związane z oddziaływaniem z materią
różnych from (rodzajów) energii:
otochemia, sonochemia.

4
Chem. Fiz. TCH II/01
4
¾ Materią
jest wszystko, co posiada masę (bezwładność, Newton).
Substancją chemiczną nazwiemy czystą, wyodrębnioną postać materii
(miara ilości substancji, jednostka: mol)
¾ Energia
jest to zdolność do wykonania pracy (upr.).
(rodzaje energii, jednostka: dżul, J)
Pojęcia podstawowe (1)
Równoważność materii i energii
E=mc
2
W praktyce, efekty relatywistyczne i kwantowe występują tylko w mikro-
świecie, w skali makroskopowej są one pomijalne.
Jednostki, układ SI.
Rodzaje energii: mechaniczna, cieplna, chemiczna, elektryczna, jądrowa,
promienista (elektromagnetyczna).
Nośniki energii: masa (mechaniczna, cieplna), wiązania chemiczne, pole
elektromagnetyczne.
Prawa zachowania: masy, energii (i pokrewne, np. pędu).

5
Chem. Fiz. TCH II/01
5
Energia kinetyczna – energia ruchu:
E
k
=½mv
2
Pojęcia podstawowe (2)
Energia potencjalna – zależna od położenia:
w polu grawitacyjnym
w polu elektrycznym
(ziemskim)
E
p
=mgh
E
p
=q
1
q
2
/(4
πε
0
r)
Rodzaje energii: kinetyczna i potencjalna, prawo zachowania energii, różne
rodzaje energii kinetycznej (translacji, rotacji, oscylacji).

6
Chem. Fiz. TCH II/01
6
¾Modelem teoretycznym
jest pewien założony
mechanizm zjawiska lub obraz i zespół właściwości obiektu,
najczęściej uproszczony, starający się zawrzeć najistotniejsze jego
cechy.
¾Hipotezą
jest pewne założenie dotyczące istoty badanego
zjawiska, właściwie próba odgadnięcia modelu w oparciu o znane
dotąd znane pojęcia i prawa.
¾Teorią
nazywamy hipotezę zweryfikowaną w wyniku dalszych
badań, gdy zyskuje ona potwierdzenie i stosuje się do większej
liczby przypadków (obiektów, zjawisk), często pokrewnych.
Pojęcia podstawowe (3)
Gdy hipotetyczny model zostanie zweryfikowany i stanie się modelem
teoretycznym, zazwyczaj się go udoskonala, tj. uwzględnia elementy, które
pierwotnie pominięto dla uproszczenia.
Przykłady znanych modeli: kinetyczny model gazu, gaz doskonały, model atomu
wodoru.
Przykłady znanych ważnych hipotez: hipoteza atomowa Daltona, hipoteza
okresowości Mendelejewa (spektakularnie potwierdzone).

7
Chem. Fiz. TCH II/01
7
¾ Prawo natury
(prawo fizykochemiczne) to jasno sformułowany
fragment teorii dotyczący jednego konkretnego zjawiska, czyli
powiązania między różnymi, obserwowalnymi wielkościami
uwikłanymi w to zjawisko.
Sformułowanie werbalne:
Prawo Boyle’a-Mariotte’a:
W stałej temperaturze, objętość gazu zmienia się odwrotnie
proporcjonalnie do jego ciśnienia.
Wzór:
Pojęcia podstawowe (4)
const.
VP
P
V
P
V
;
P
P
V
V
2
2
1
1
1
2
2
1
=
=
=
=
= const.
dla T
Rodzaje praw fizycznych (fizykochemicznych):
Ścisłe (spełniane zawsze), np. prawo Faradaya,
Graniczne, gdy pewna wielkość determinująca obowiązywanie prawa ma zdążać
granicznie do pewnej wartości, najczęściej do zera lub do nieskończoności
(bardzo częste w chemii fizycznej), popularny przykład, prawo Boyle’a-
Mariotte’a.
Empiryczne, przybliżone.
Wzajemna przekładalność sformułowania werbalnego i wzoru (bardzo ważne).
Podobnie jeszcze można przekładać na trzecią postać – graficzną, czyli
wyrażonej wzorem zależności funkcyjnej. Ważna umiejętność i należy ją
ćwiczyć, albo odświeżyć z innych przedmiotów.
8
Chem. Fiz. TCH II/01
8
¾ Termodynamika
¾ Równowagi chemiczne
¾ Równowagi fazowe
¾ Roztwory – charakterystyka termodynamiczna
¾ Elektrochemia: jonika i elektrodyka.
¾ Zjawiska powierzchniowe i koloidy
¾ Kinetyka chemiczna
¾ Podstawy chemii kwantowej.
Główne działy:
9
Chem. Fiz. TCH II/01
9
Układ (definicja)
Układ jest to fragment rzeczywistości poddany
obserwacji bądź rozważaniom teoretycznym i
wyodrębniony z niej fizycznie lub umownie
Poza układem istnieje jego otoczenie.
układ + otoczenie = wszechświat
Wprowadzenie do
termodynamiki
Termodynamika będzie się przewijała właściwie przez całą chemię fizyczną.
Zajmować się tu będziemy przede wszystkim tzw. termodynamiką
fenomenologiczną (opisową w skali makro), a jedynie w niewielkiej części
termodynamiką statystyczną (dochodzi do wniosków w skali makro na podstawie
badania rozkładów statystycznych zachowania się cząsteczek w układach.
Układ jest jednym z podstawowych pojęć termodynamiki.
Układ wyodrębniony „umownie” (mentalnie, w wyobraźni) jest po prostu
obiektem, który wyobrażamy sobie w celach rozważań teoretycznych i nadajemy
mu rozmaite cechy. W zależności od tych cech wyróżniamy 3 główne kategorie
układów.
10
Chem. Fiz. TCH II/01
10
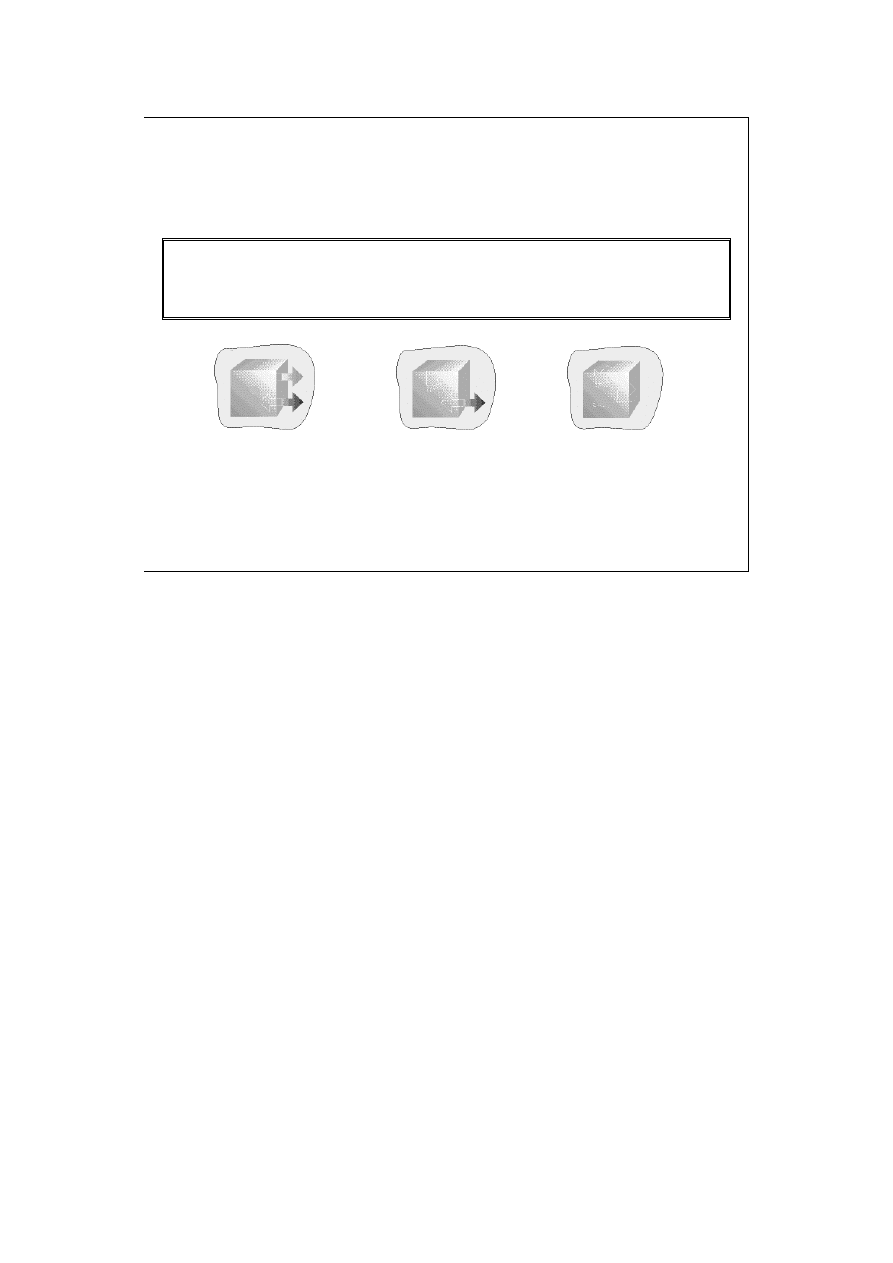
Istnieją trzy rodzaje układów:
9 Otwarte (mogą wymieniać z otoczeniem materię
i energię)
9Zamknięte (mogą wymieniać energię, ale nie
materię)
9Izolowane (nie wymieniają z otoczeniem ani
materii, ani energii).
Wprowadzenie do
termodynamiki
Można też klasyfikować układy inaczej, stosując inne kryteria (np. wyróżniamy
układy jednorodne i niejednorodne; jednoskładnikowe i wieloskładnikowe).
Ten drugi z wymienionych podziałów wydaje się oczywisty, ale omówimy to
bliżej przy okazji równowag fazowych (składniki w sensie termodynamicznym).
Układy jednorodne to takie, w których występuje tylko jedna faza. W układach
niejednorodnych – dwie lub więcej faz. Te pierwsze nazywamy też
homogenicznymi, te drugie – heterogenicznymi.
Fazą nazywamy postać danej materii, która charakteryzuje się jednorodnym
stanem składem chemicznym i stanem fizycznym. Może istnieć więc układ
równocześnie jednoskładnikowy i wielofazowy (np. ciecz i jej para, jeden
składnik – dwie fazy). Dwie odmiany alotropowe pierwiastka też stanowią różne
fazy tego samego składnika, choć bowiem mają ten sam skład chemiczny, to stan
fizyczny (np. układ krystalograficzny) jest odmienny.
11
Chem. Fiz. TCH II/01
11
Rodzaje układów:
otwarte zamknięte izolowane
Wprowadzenie do
termodynamiki

12
Chem. Fiz. TCH II/01
12
Sposoby przekazywania energii:
Na sposób pracy.
Na sposób ciepła (jako ciepło).
Rodzaje pracy
Mechaniczna (objętościowa), praca zmiany
powierzchni, praca elektryczna, praca
odkształcenia.
Wprowadzenie do
termodynamiki
Na początku rozważać będziemy jedynie układy, w których jedyną pracą
wymienianą z otoczeniem jest praca objętościowa.
Praca mechaniczna jest iloczynem siły działającej i drogi (przesunięcia). Stąd 1 J
= 1 N
× 1 mW przypadku gazów jest to praca związana z przesunięciem tłoka
ograniczającego układ (poruszającego się bez tarcia. Jeżeli tłok ogranicza układ
od góry, to praca będzie iloczynem jego przesunięcia i ciężaru.
Jeżeli układ wykonuje pracę, gaz rozpręża się, tłok się podnosi, to pracy
„wykonanej przez układ” przyznajemy znak (-).
Jeżeli to tłok swoim ciężarem zmniejsza objętość układu, to praca „wykonana na
układzie” ma znak (+).
Pamiętajmy, że punktem odniesienia jest dla nas (chemików) UKŁAD. Jeśli to
on zyskuje energię, ma ona znak (+), jeśli ją traci – znak (-).
Niektóre dziedziny i specjaliści (oraz starsze podręczniki) stosują odmienne
konwencje, np. mechanicy, których interesuje uzyskanie energii z układów
(silników, maszyn). Jak my ją uzyskujemy ma znak (+).
13
Chem. Fiz. TCH II/01
13
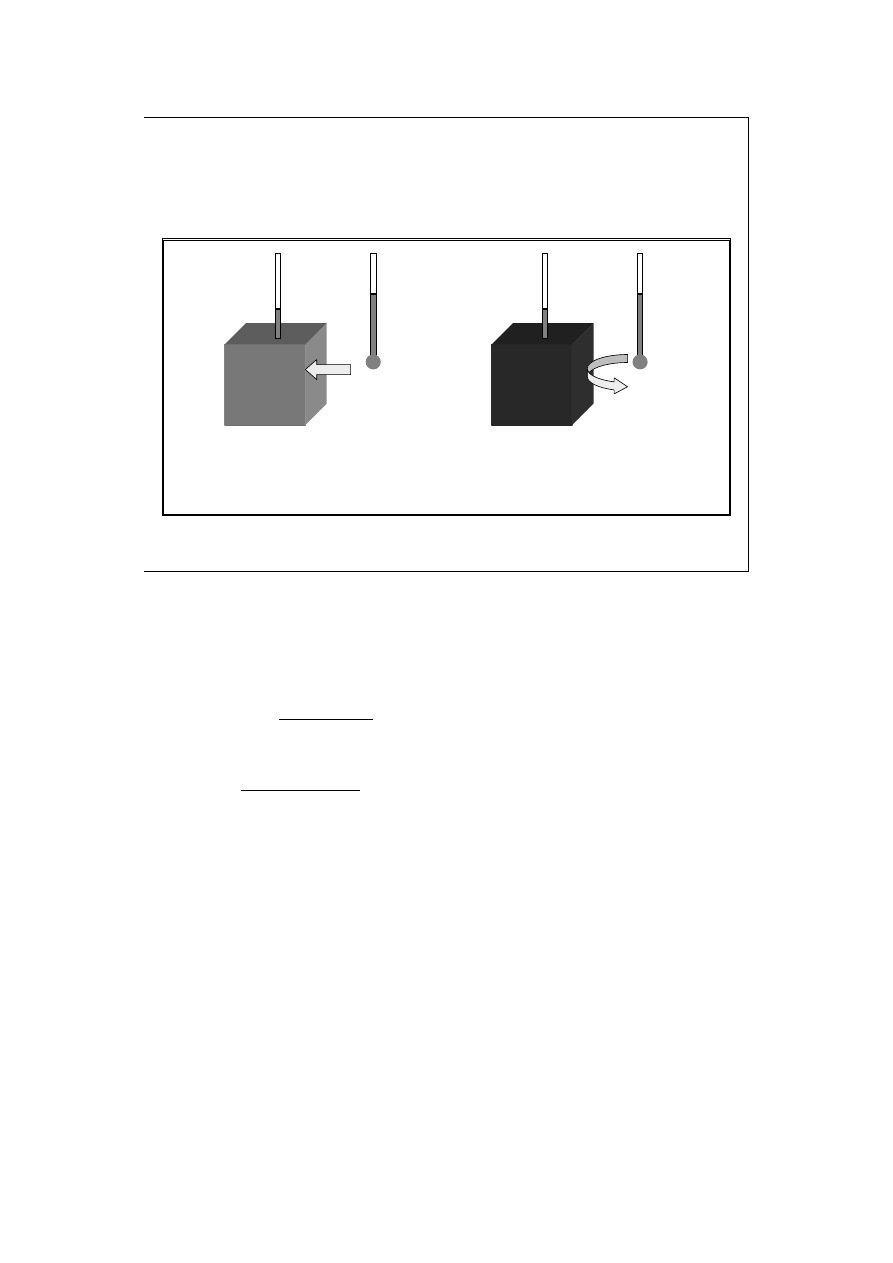
CIEPŁO
Wprowadzenie do
termodynamiki
Jeśli przepływ energii pomiędzy układem a otoczeniem związany jest z różnicą
temperatur pomiędzy nim, to mówimy, że energia przekazywana jest na sposób
ciepła (jako ciepło).
Układy, które mogą wymieniać energię jako ciepło, ograniczone są ściankami
określanymi jako diatermiczne.
Układy, które (mimo istniejącej pomiędzy nimi a ich otoczeniem różnicy
temperatur) nie mogą wymieniać ciepła z otoczeniem, ograniczone są ściankami
nazywanym adiabatycznymi. Podobnie określamy przemiany zachodzące w
takich układach.
Jak widzimy na rysunku, mimo, że w obu przypadkach termometry wskazują
różnicę temperatur (otoczenia wyższa), to ciepło (żółta strzałka) wchodzi do
układu po lewej (zielony), który jest zatem ograniczony ściankami
diatermicznymi, zaś prawy (czerwony) ma ścianki uniemożliwiające przekaz
energii jako ciepła (adiabatyczne).
14
Chem. Fiz. TCH II/01
14
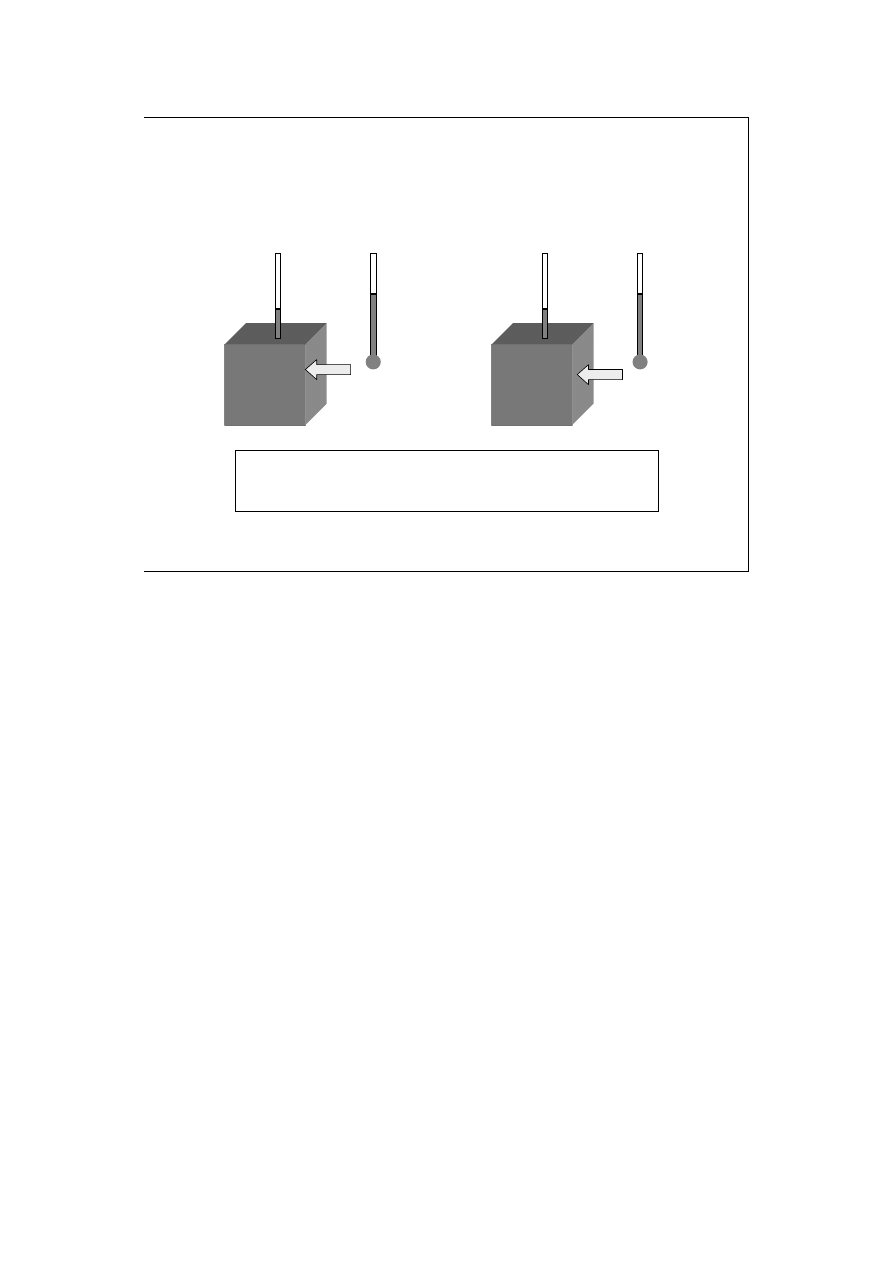
Proces endotermiczny z wymianą
ciepła z otoczeniem
Wprowadzenie do
termodynamiki
przed
po
Przemiany zachodzące w układzie określamy jako egzoenergetyczne, jeśli
towarzyszy im wydzielanie energii, a znak tej energii to (-). W szczególności,
procesowi towarzyszy wydzielanie ciepła, to proces nazywamy egzotermicznym,
a ciepło ma znak (-). Przemiany (procesy) endoenergetyczne (endotermiczne)
zachodzą, gdy energia (ciepło) jest podczas nich pobierana (znak (+)). Na
rysunku widoczny jest przebieg procesu endotermicznego w układzie
umożliwiającym wymianę ciepła. Zaraz po jego rozpoczęciu i bezpośrednio po
zakończeniu temperatury otoczenia i układu są takie same (ustalone), a szybkość
wnikania ciepła jest ustalona (zależy od różnicy temperatur).
15
Chem. Fiz. TCH II/01
15
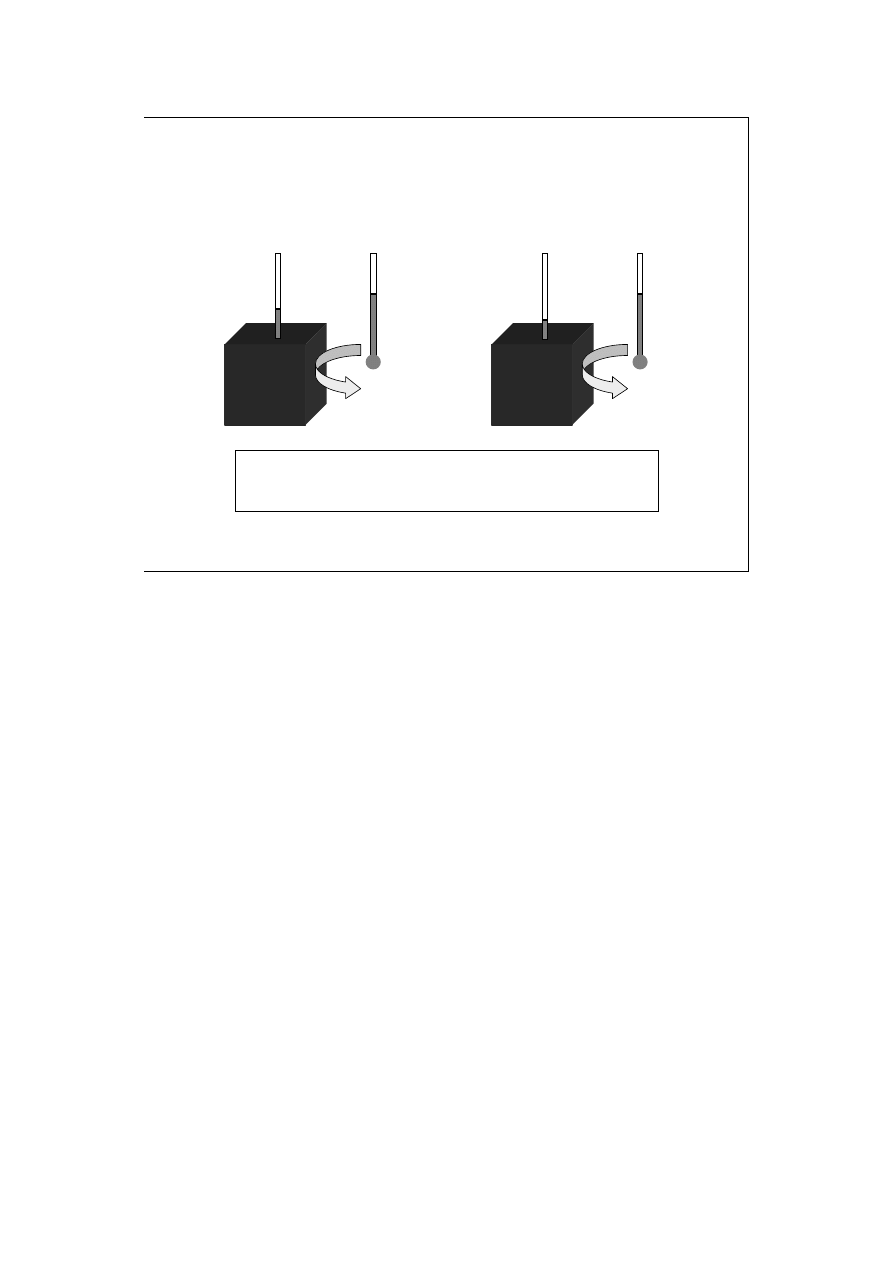
Proces endotermiczny w układzie
z osłoną adiabatyczną
Wprowadzenie do
termodynamiki
przed
po
W tym przypadku, zaraz po rozpoczęciu procesu dane są temperatury otoczenia i
układu (w otoczeniu wyższa).
Ponieważ ciepło nie może przekroczyć bariery adiabatycznej, proces prowadzi do
obniżenia temperatury układu (ciepło jest pobierane z wnętrza samego układu).
Temperatura otoczenia się nie zmienia.
Przy procesie egzotermicznym w układzie z osłoną adiabatyczną sytuacja jest
odwrotna, tzn. po ukończeniu procesu we wnętrzu układu panuje temperatura
wyższa niż na początku.

16
Chem. Fiz. TCH II/01
16
Własności fizyczne układów:
¾ Ekstensywne (addytywne, zależne od ilości i
rodzaju składników, wielkości układu)
(np. masa układu lub objętość układu)
¾ Intensywne nie są addytywne.
(np. temperatura, ciśnienie, gęstość, wielkości
molowe)
Wprowadzenie do
termodynamiki
∑
=
=
n
i
i
x
x
1
W ramach jednej fazy własności intensywne są są stałe, a zmieniają się pomiędzy
fazami (skokowo na granicy).
W układzie jednorodnym znajdującym się w stanie równowagi
termodynamicznej, dowolna własność intensywna jest stała – taka sama dla
całego układu, jak i dla dowolnej jego części.
Dlaczego wielkości molowe są intensywne (np. objętość molowa, masa
molowa)?
Stanem równowagi termodynamicznej nazywamy stan, w którym w układzie nie
zachodzą żadne zmiany. Jeżeli takowe zachodziły samorzutnie, to po dojściu do
stanu równowagi – ustają (o ile na układ nie oddziaływuje otoczenie, ale to jest
warunkiem zmian samorzutnych).

17
Chem. Fiz. TCH II/01
17
Parametry stanu:
Wielkości ekstensywne wystarczające do
całkowitego scharakteryzowania stanu układu.
P, V, T
Równanie stanu:
f(P,V,T)=0
Dla gazu doskonałego: pV=nRT
Wprowadzenie do
termodynamiki
Okazuje się, że dla jednoznacznego scharakteryzowania stanu układu nie trzeba
określać wartości wszystkich jego własności fizycznych. W termodynamice
wystarczą te trzy, a nawet dwa spośród nich, związane są bowiem ze sobą
równaniem stanu.
Równanie stanu gazu rzeczywistego omówimy nieco później ze względu na
konieczność dostosowania wykładu do potrzeb ćwiczeń rachunkowych.

18
Chem. Fiz. TCH II/01
18
Temperatura i „zerowa” zasada
termodynamiki
Dwa ciała, które osiągnęły stan równowagi
cieplnej, mają taką samą temperaturę, a ciepło nie
jest już między nimi wymieniane.
Jeżeli ciało A pozostaje w równowadze termicznej z
ciałem B i z ciałem C, to ciała B i C także pozostają
ze sobą w równowadze termicznej (cieplnej).
Wprowadzenie do
termodynamiki
Temperatura jest to parametr, który posiada identyczną wartość dla wszystkich
ciał znajdujących się w stanie równowagi termicznej.
Zerowa zasada termodynamiki wynika z wcześniej określonych pojęć ciepła
(jako postaci energii wymienianej dzięki istnieniu różnicy temperatur),
równowagi termodynamicznej (w tym przypadku termicznej), oraz kontaktu
diatermicznego, który należy zapewnić między ciałami, aby mogło dojść do
ustalenia się stanu równowagi termicznej.
Postulaty te (twierdzenia przyjmowane bez dowodu) są podstawą pomiaru
temperatury.
19
Chem. Fiz. TCH II/01
19
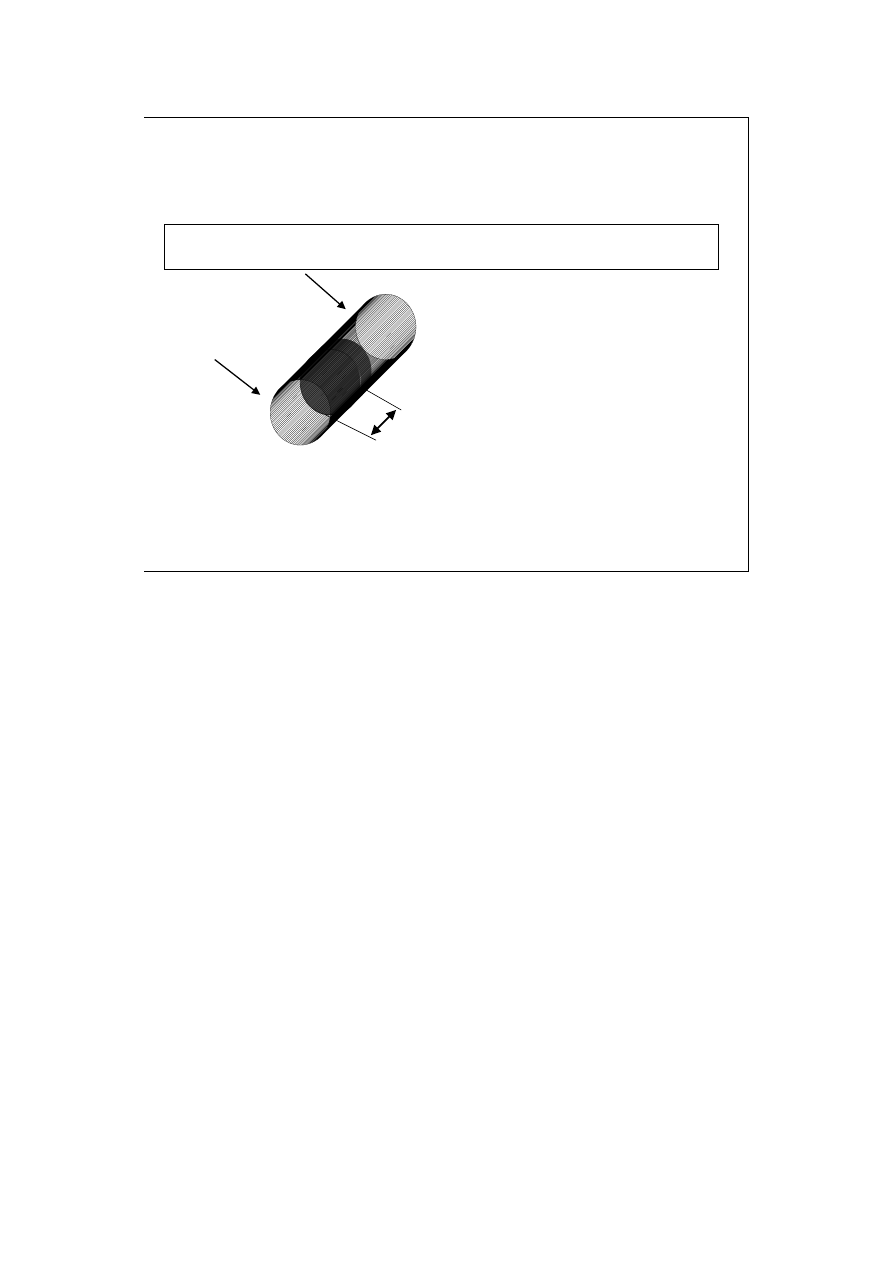
Praca objętościowa
Wprowadzenie do
termodynamiki
dx
P
gazu
P
zewn
dV
P
Sdx
P
dw
zewn
zewn
−
=
−
=
F
S
P
=
⋅
2
r
S
⋅
=
π
Widzimy tutaj „przeźroczysty” cylinder, w którym przesuw tłoka dx został
zaznaczony. Objętość układu zamkniętego tłokiem zmieniła się o dV. Praca
przy rozprężaniu (wykonywana przez układ, dV>0) ma znak (-), przy sprężaniu
(wykonywana na układzie, dV<0) ma znak (+).

20
Chem. Fiz. TCH II/01
20
Praca objętościowa
Wprowadzenie do
termodynamiki
Trzy sposoby wykonywania pracy przez układ:
1. Przeciwko stałemu ciśnieniu zewnętrznemu (P
zewn
= const).
2. Przeciwko zerowemu ciśnieniu zewnętrznemu (ekspansja do
próżni, szczególny przypadek poprzedniego), P
zewn
= 0.
(
)
p
k
zewn
k
p
zewn
k
p
V
V
P
dV
P
dw
w
−
−
=
−
=
=
∫
∫
0
=
w
Jeżeli przypadek 2 trudno sobie wyobrazić w układzie z tłokiem, to należy
uprzytomnić sobie, że tłok jest nieważki i porusza się bez oporów. Oto, co
nazywamy układem wyobrażonym. Fizyczna realizacja może być trudna
(podobnie jak przegrody adiabatycznej).

21
Chem. Fiz. TCH II/01
21
Praca objętościowa (c.d.)
Wprowadzenie do
termodynamiki
3. Sposób kwasistatyczny: P
zewn
= P
gazu
±dP, w szczególności
izotermicznie.
dV
V
nRT
dw
−
=
∫
∫
=
−
=
=
k
p
k
p
k
p
V
V
nRT
V
dV
nRT
dw
w
ln
dP jest nieskończenie małą różnicą ciśnienia.
Zatem w sposobie tym ciśnienie zewnętrzne jest cały czas „prawie” takie samo
jak ciśnienie gazu. Oczywiście proces trwałby wtedy nieskończenie długo,
bowiem byłby bardzo powolny, stąd nazwa.
22
Chem. Fiz. TCH II/01
22
Praca objętościowa (c.d.)
Wprowadzenie do
termodynamiki
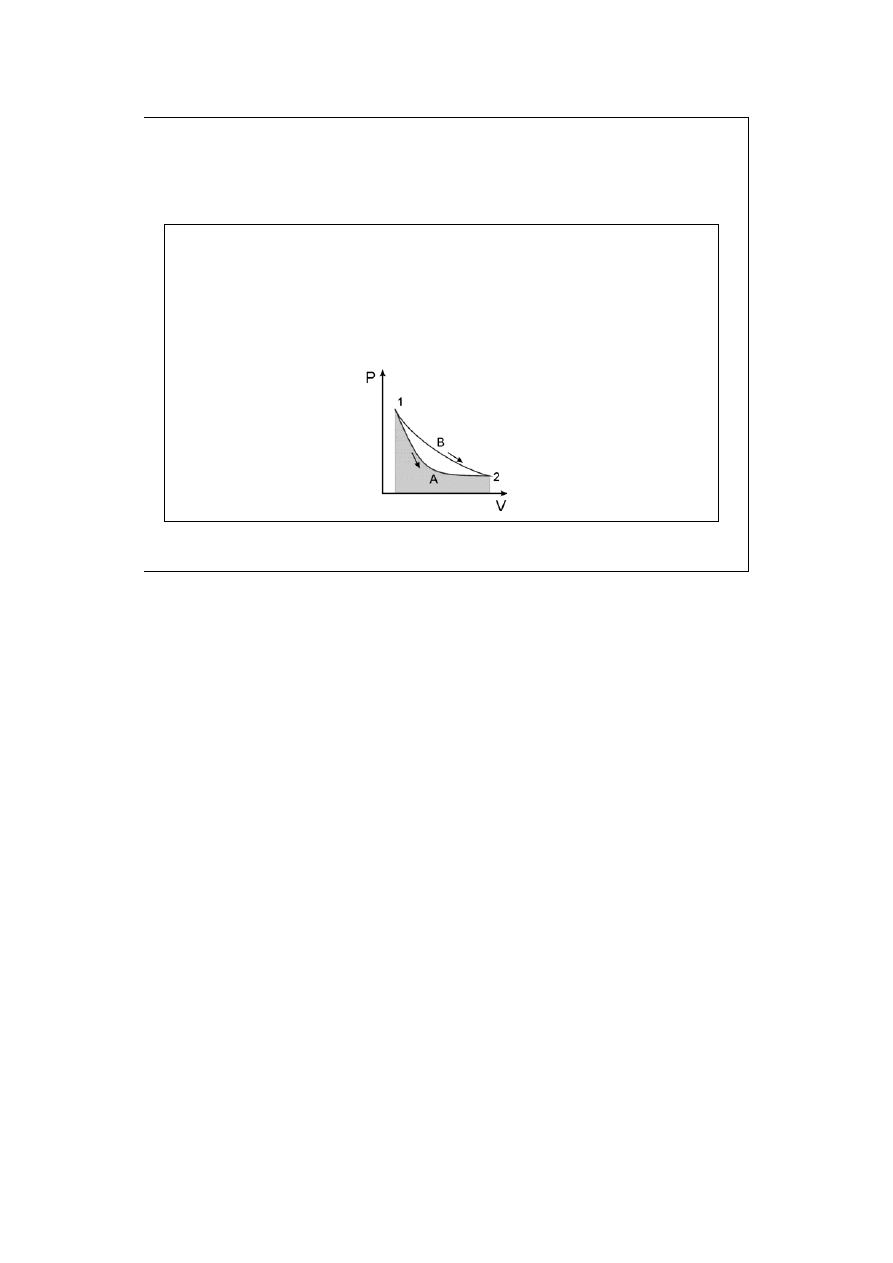
Praca objętościowa zależy od drogi jaką realizowana jest
przemiana. Jest ona całką z funkcji P=f(V)dV i polem
powierzchni pod wykresem w układzie współrzędnych P-V.
Praca objętościowa jest w sposób oczywisty różna dla drogi A (pokazana jako
zacieniowane pole) i B.
|w
A
| < |w
B
|

23
Chem. Fiz. TCH II/01
23
Kto to jest?
Wasz wykładowca (dla nieobecnych na wykładzie)
Wyszukiwarka
Podobne podstrony:
chf tch I wykl 001c
chf tch I wykl 001c
chf tch I cr 001c
chf tch I wykl 010Ac
chf tch I wykl 004c
chf tch I wykl 010a
chf tch I wykl 007c
chf tch I wykl 012c
chf tch I wykl 005b
chf tch I wykl 004b
chf tch I wykl 006b
chf tch I wykl 008c
chf tch I wykl 009c
chf tch I wykl 003c
chf tch I wykl 002c
chf tch I wykl 005c
chf tch I wykl 010c
chf tch I wykl 006c
więcej podobnych podstron