Chem. Fiz. TCH II/10
1
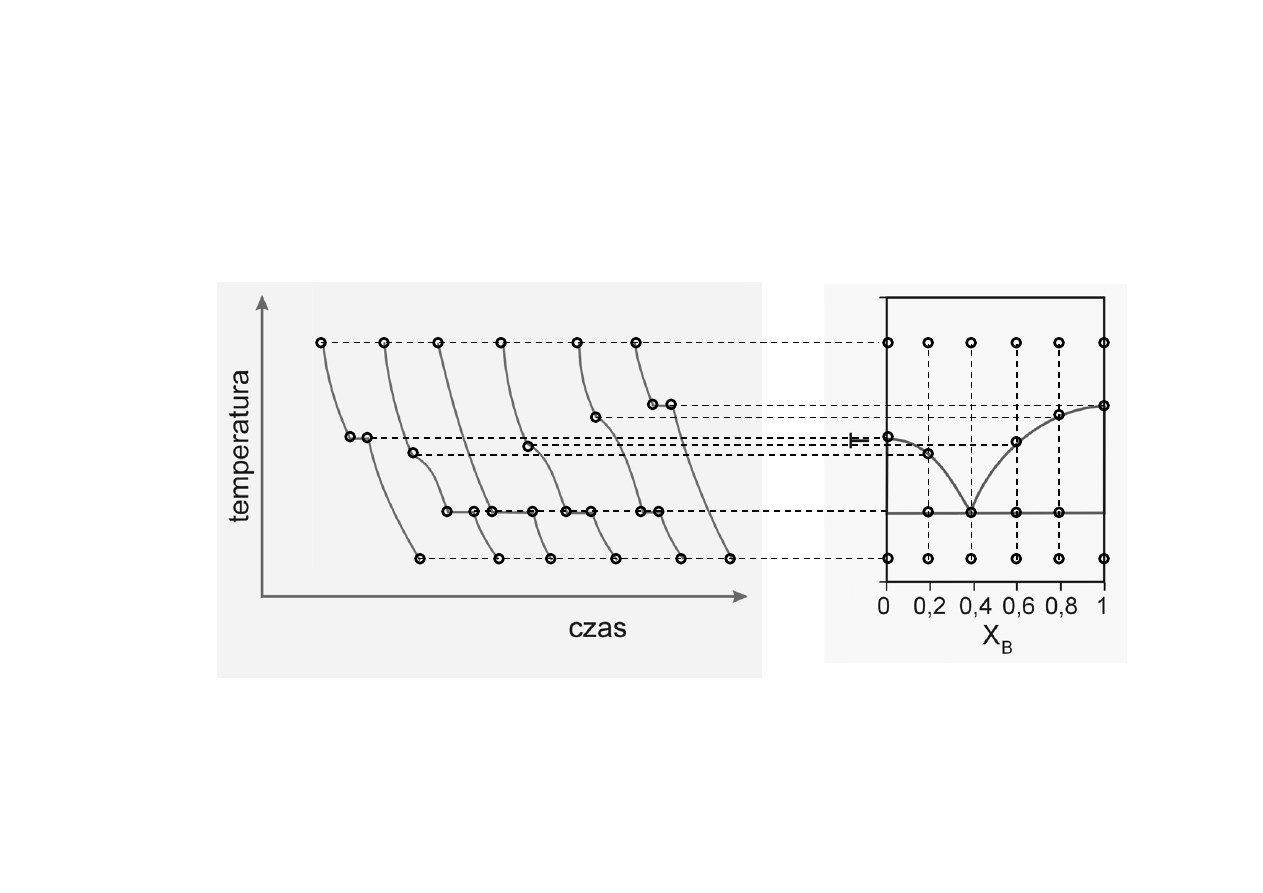
Analiza termiczna
Krzywe stygnięcia
0
0,2 0,4
0,6 0,8 1,0
T
p
T
A
T
k
a
b
c
d
e
f
g h
i
j
k l
m
n
o
p
q
r
s
t
u
v
w
x
y
z
α
T
E
T
B
P = const
Chem. Fiz. TCH II/10
2
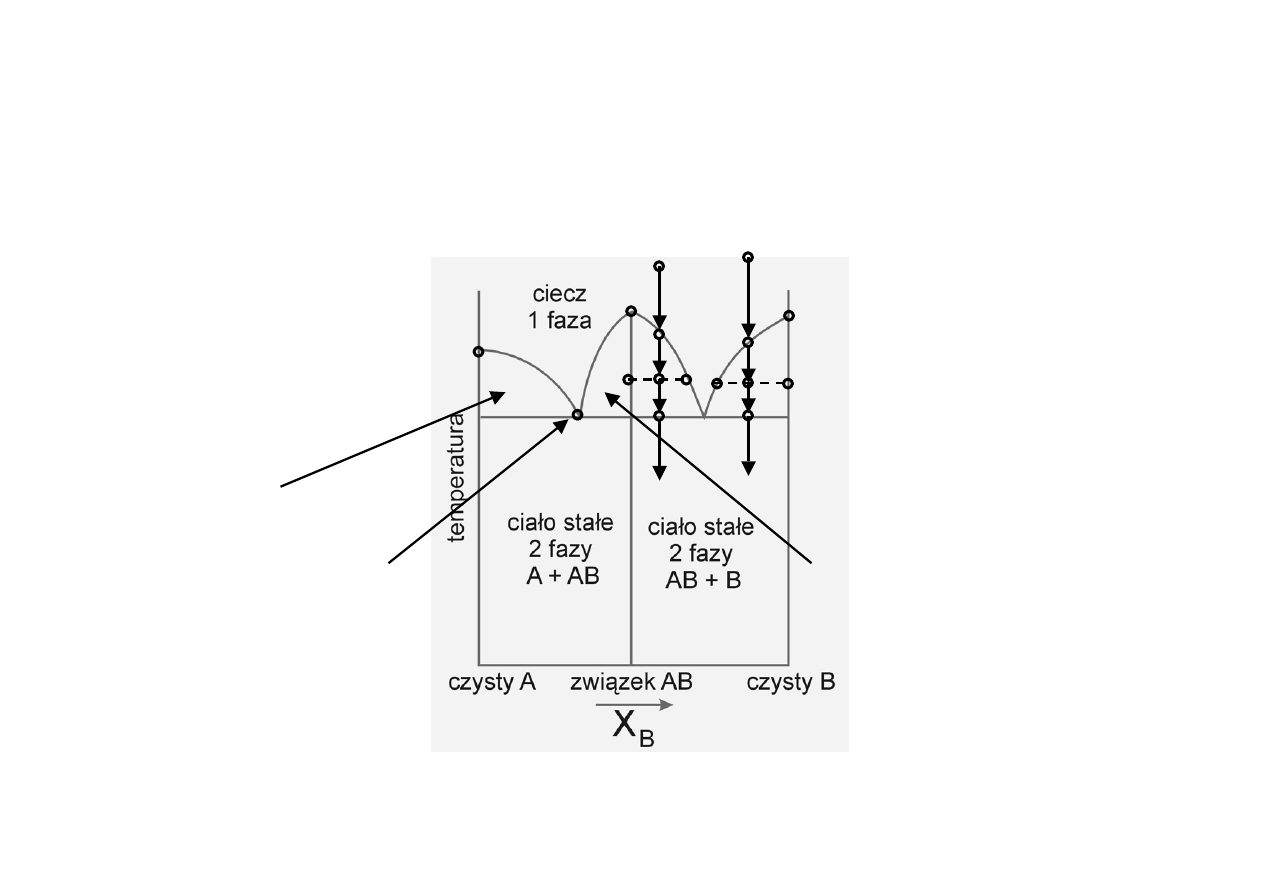
Diagramy fazowe z
tworzeniem związków (1)
T
A
T
B
T
AB
a
b
c
d
e
f
a’
b’
c’ d’
e’
f’
stałyA + ciecz
stałyAB + ciecz
eutektyk A + AB
P = const
Ga + As = GaAs
Chem. Fiz. TCH II/10
3
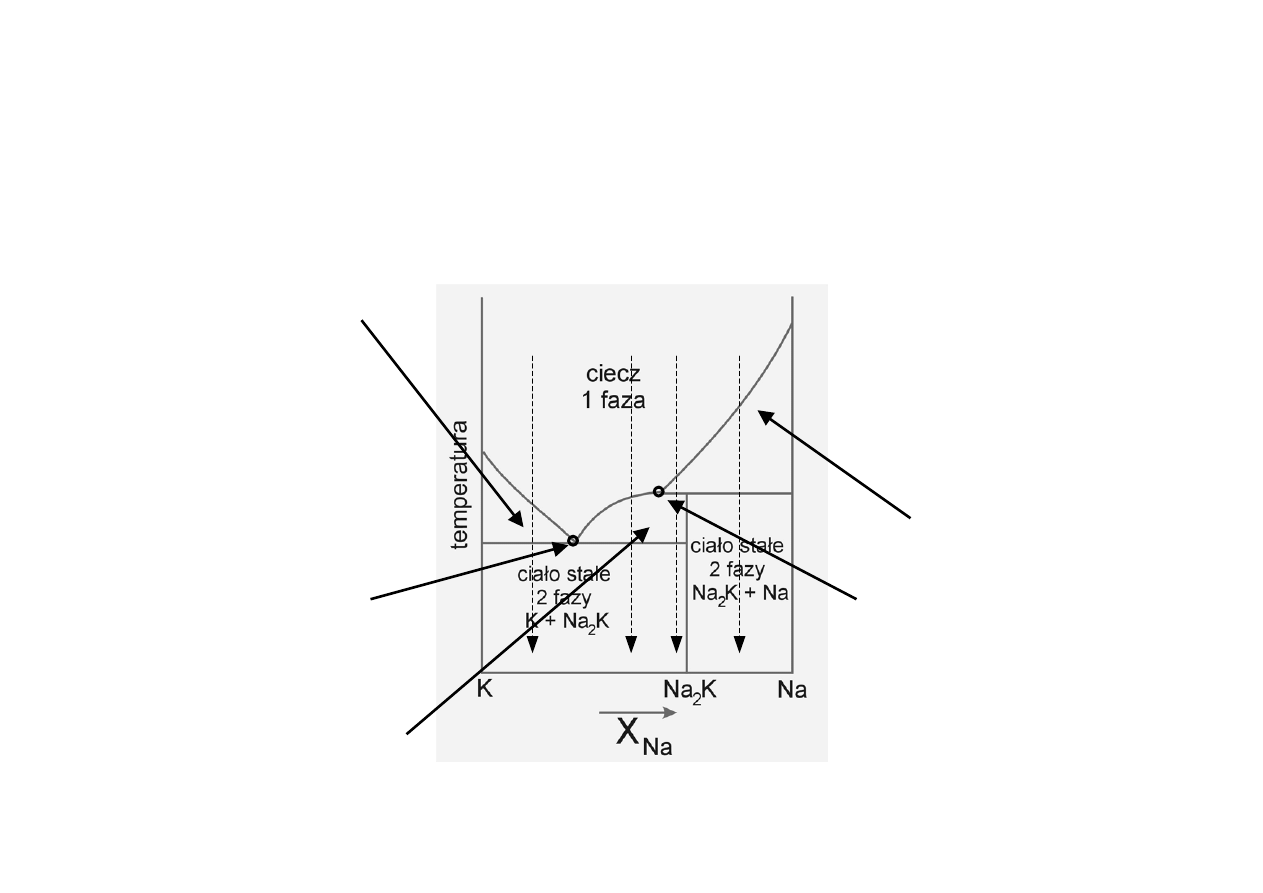
Diagramy fazowe z
tworzeniem związków (2)
Stały K + roztwór nas.
K w Na
eutektyk K + Na
2
K
Stały Na
2
K + roztwór
nas. Na
2
K w K
Stały Na + roztwór
nas. Na w K
Topnienie niekongruentne
a
b
c
d
Chem. Fiz. TCH II/10
4
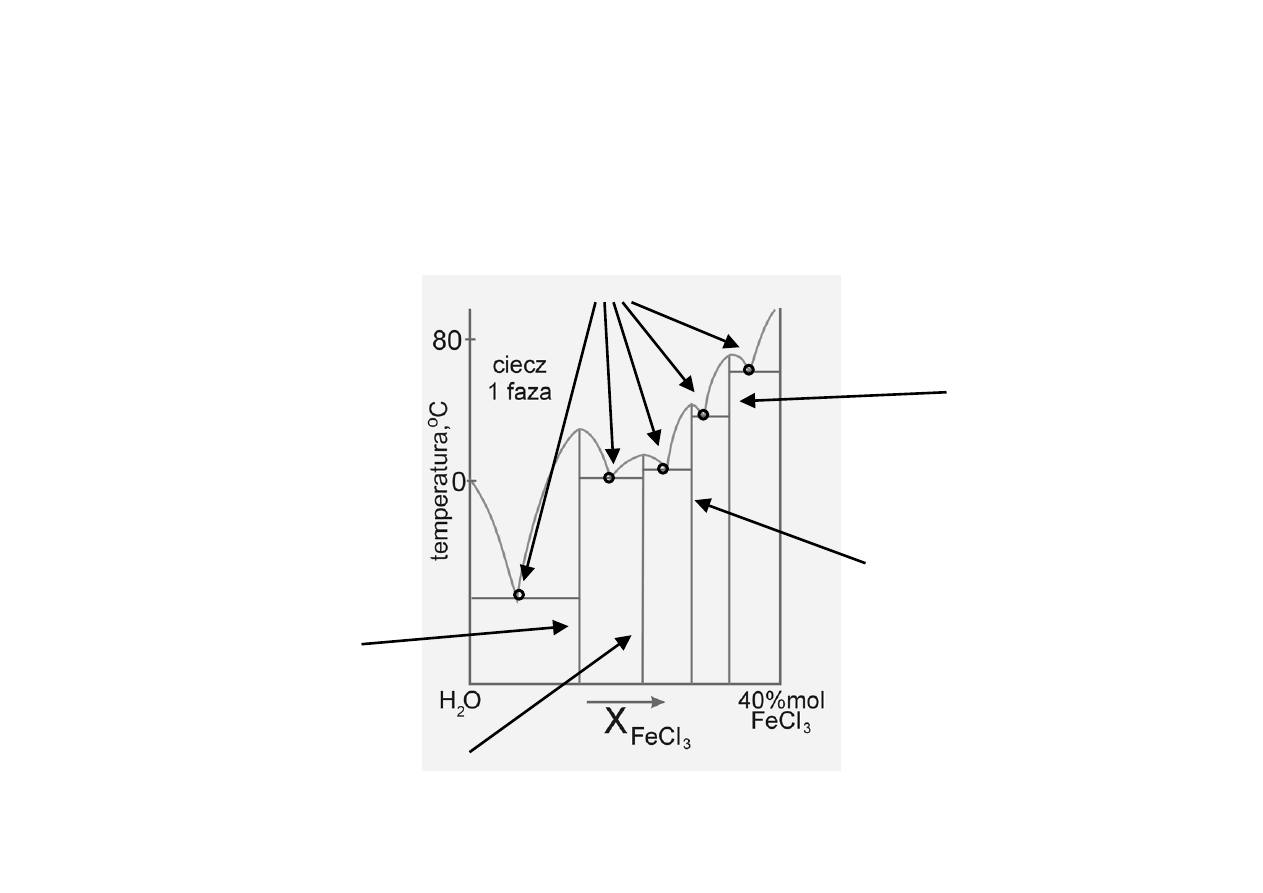
Diagramy fazowe z
tworzeniem związków (3)
eutektyki
FeCl
3
•6H
2
O
FeCl
3
•3½H
2
O
FeCl
3
•2½H
2
O
FeCl
3
•2H
2
O
Chem. Fiz. TCH II/10
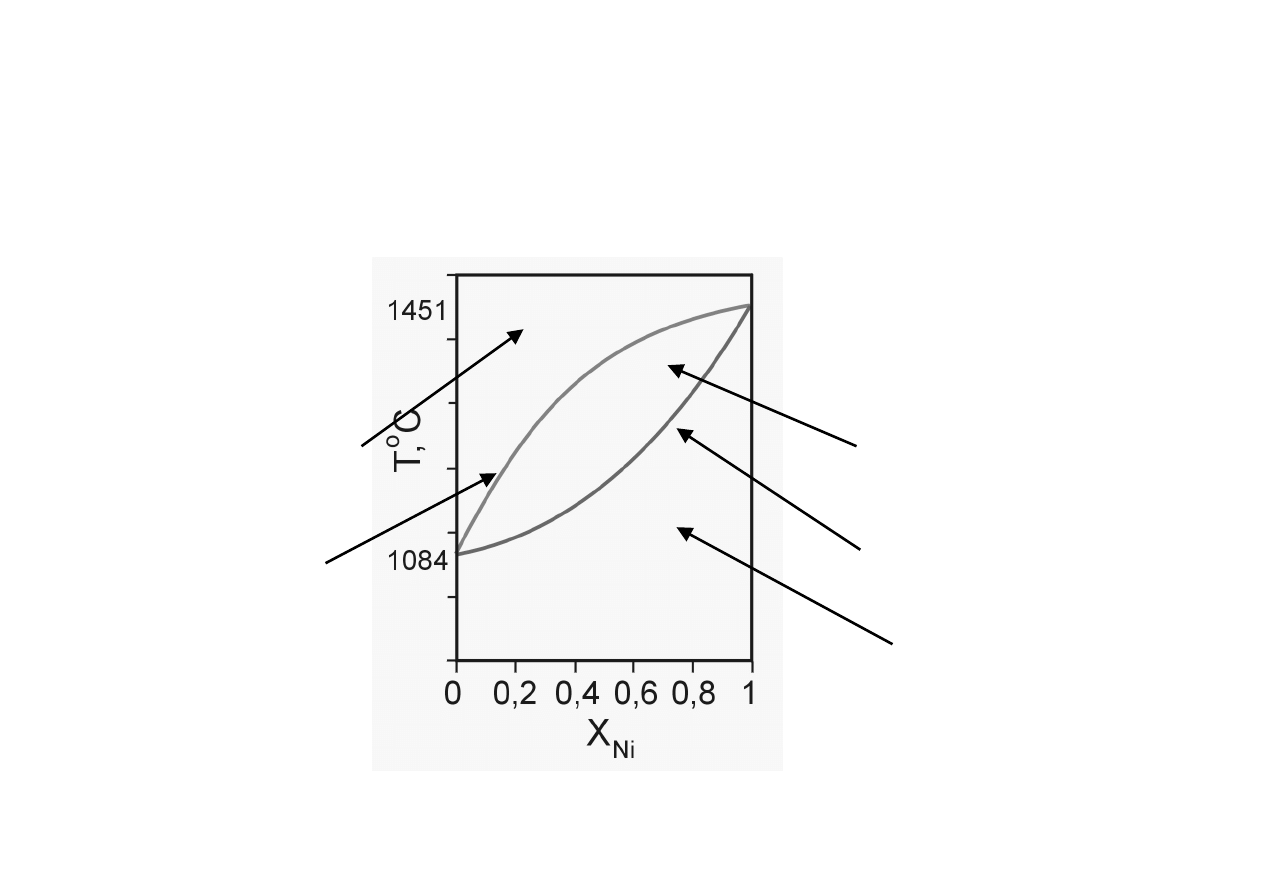
5
Diagramy fazowe
z roztworami stałymi (1)
solidus
Roztwór ciekły
1 faza
solidus
Roztwór stały
1 faza
obszar współ-
istnienia faz
Cu-Ni
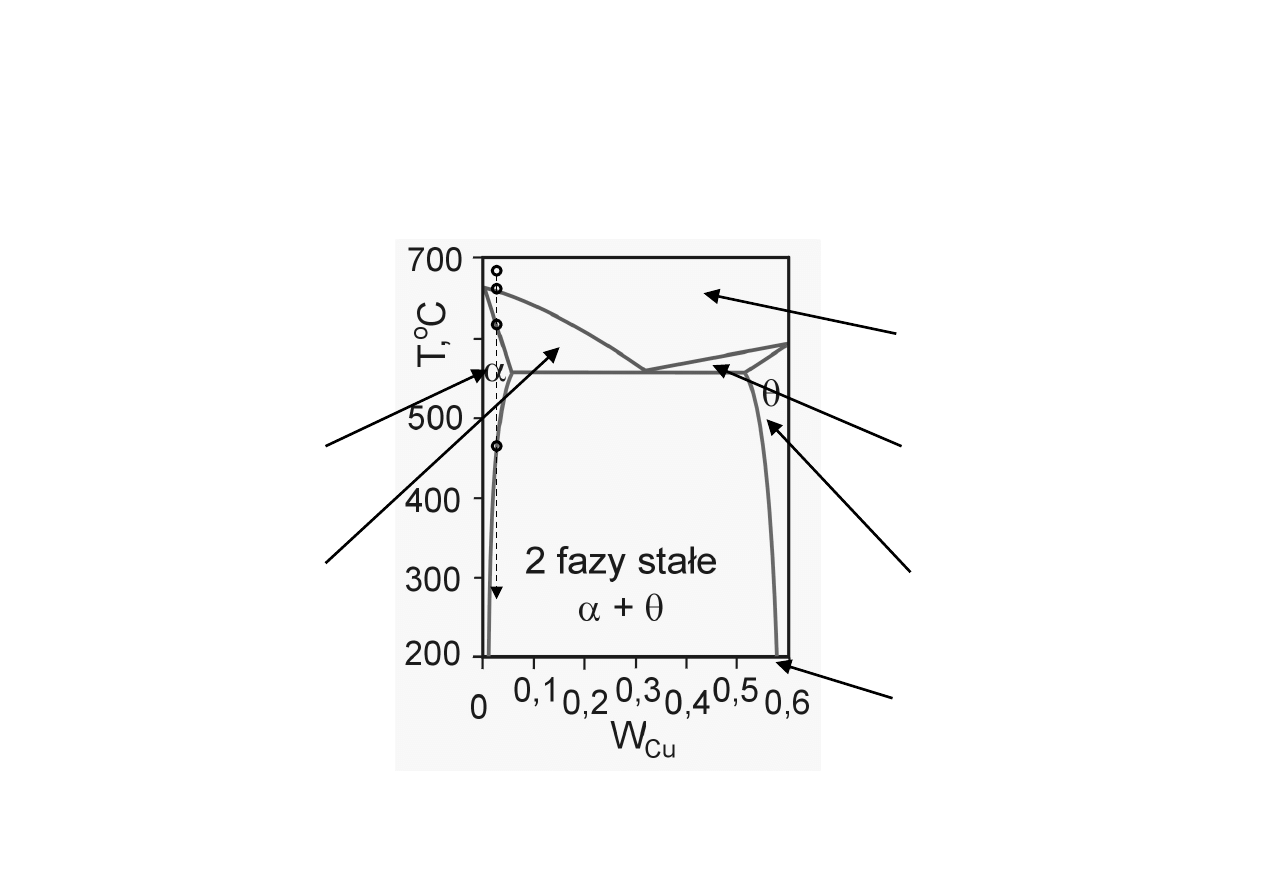
Chem. Fiz. TCH II/10
6
Diagramy fazowe
z roztworami stałymi (2)
obszar współ-
istnienia cieczy
i fazy stałej α
Roztwór stały
(CuAl
2
w Cu)
1 faza
ciecz
CuAl
2
(58%Cu)
obszar współ-
istnienia cieczy
i fazy stałej θ
Cu-Al
Roztwór stały
(Cu w CuAl
2
)
1 faza
a
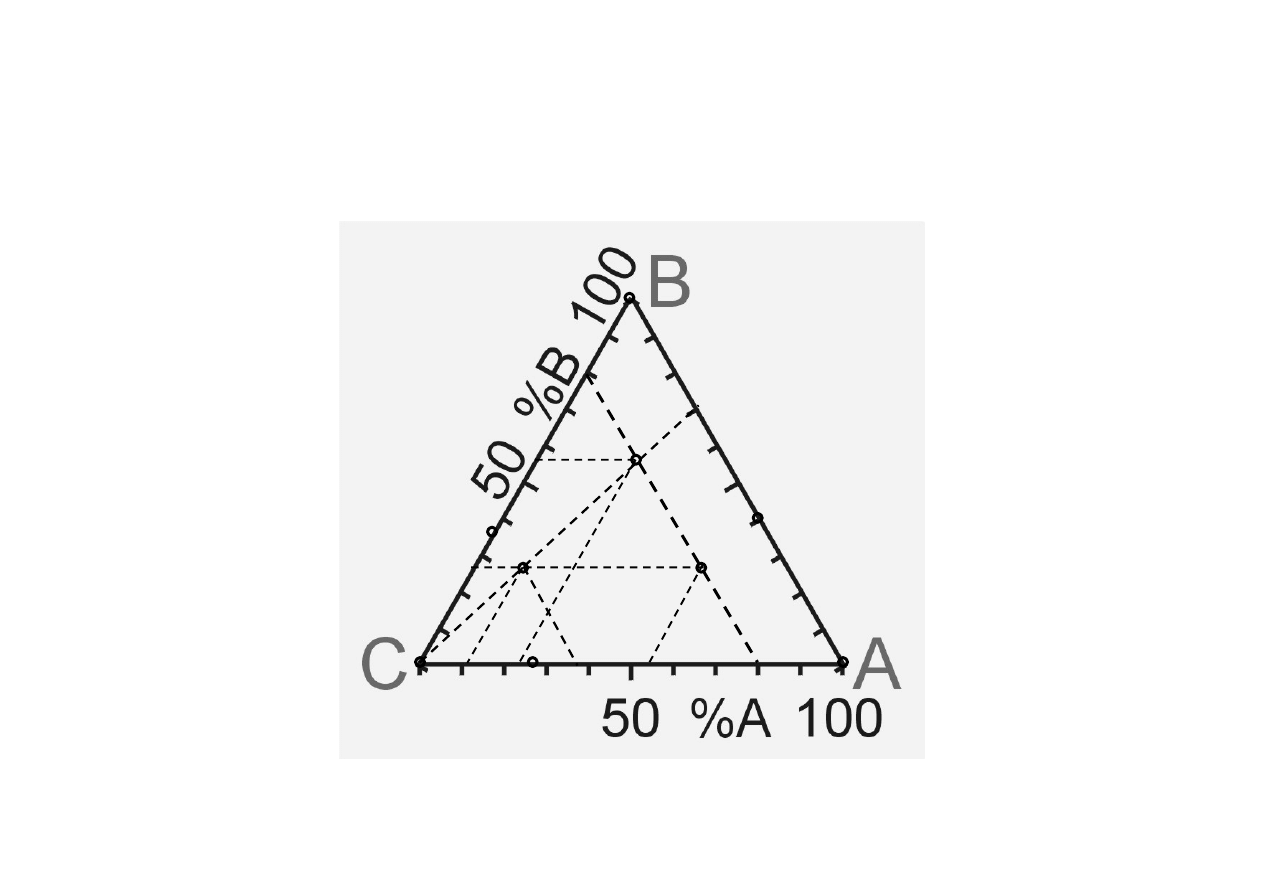
Chem. Fiz. TCH II/10
7
Układy trójskładnikowe (1).
Trójkąt Gibbsa
a
b
c
f + p = 5
d
d’
d”
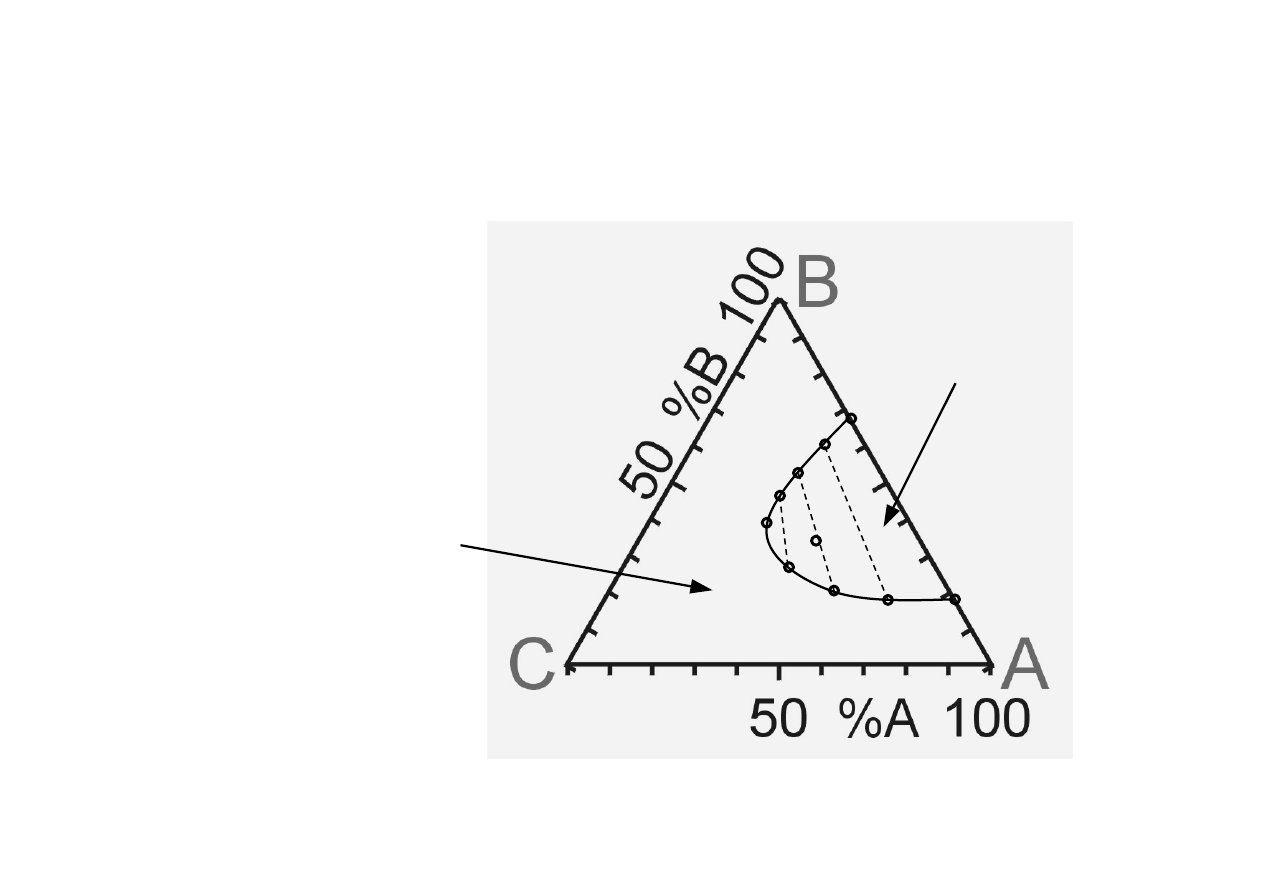
Chem. Fiz. TCH II/10
8
Układy trójskładnikowe (2).
a
b
d
A i B wykazują
ograniczoną wzajemną
rozpuszczalność
P=const, T=const
c
f
e
g
h
S
1 faza ciekła
2 fazy ciekłe
i
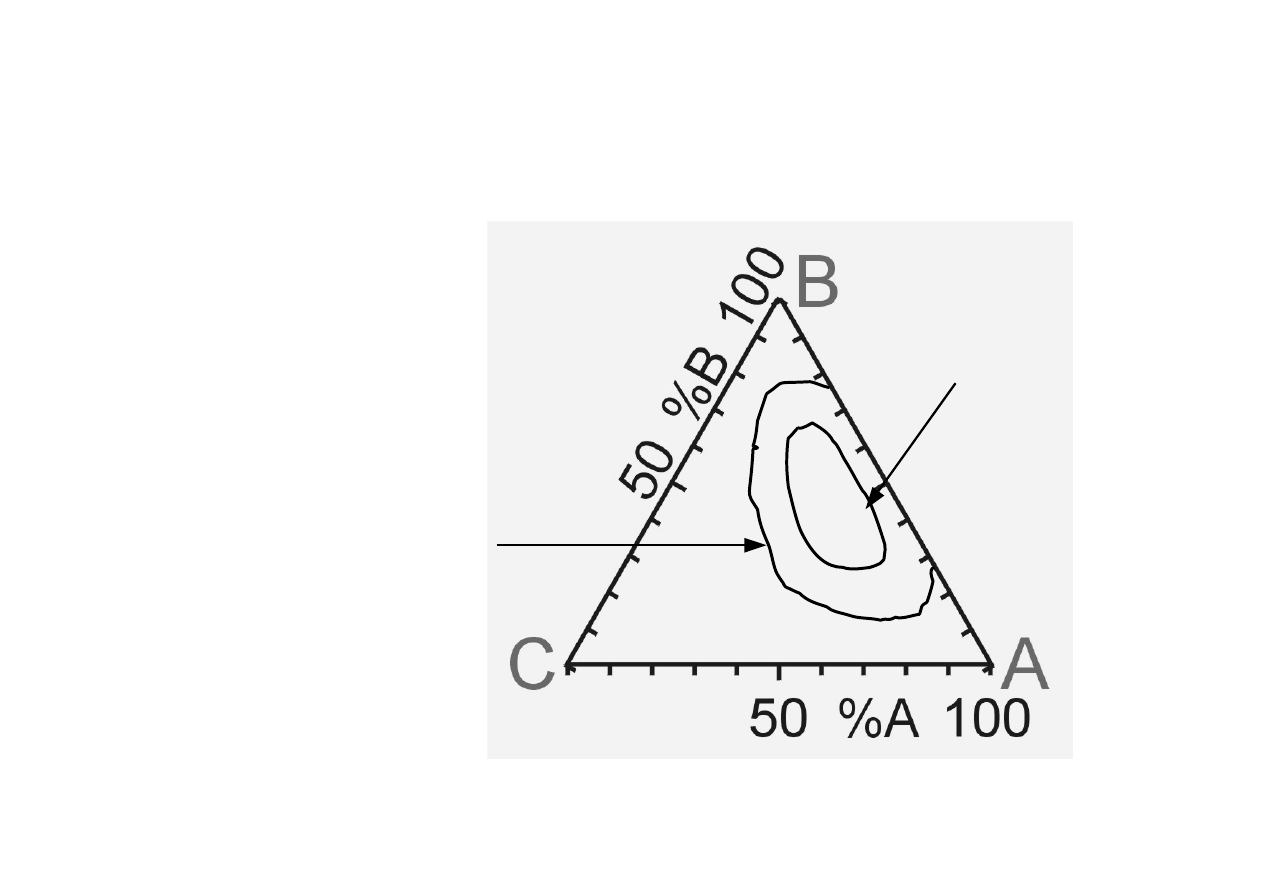
Chem. Fiz. TCH II/10
9
Układy trójskładnikowe (3).
A i B wykazują
ograniczoną wzajemną
rozpuszczalność
P=const, T=const
30
o
C
80
o
C
A = C
6
H
5
OH
B = H
2
O
C = (CH
3
)
2
CO
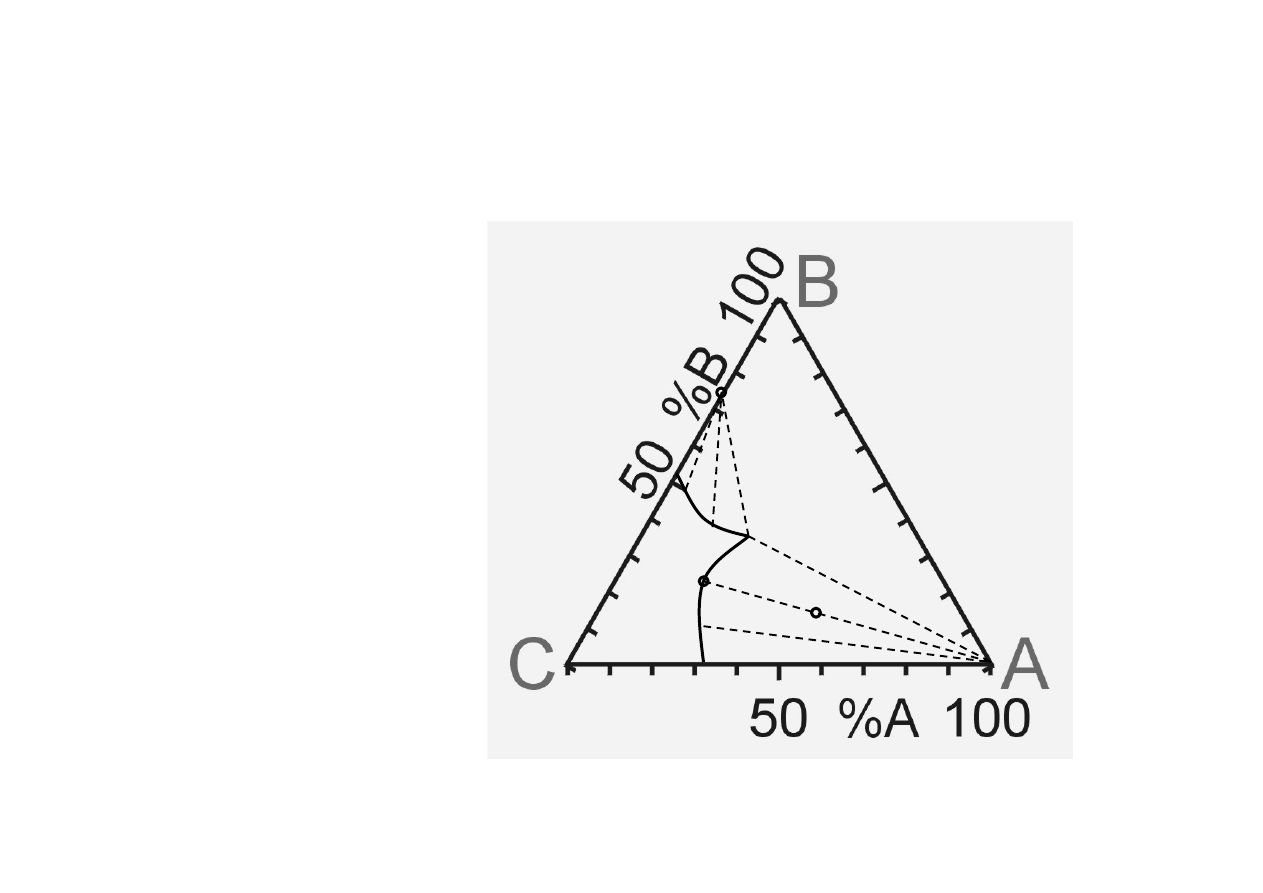
Chem. Fiz. TCH II/10
10
Układy trójskładnikowe (4).
P=const, T=const
A = sól1
B = sól2 (wspólny jon z A)
C = H
2
O
R
S
Z
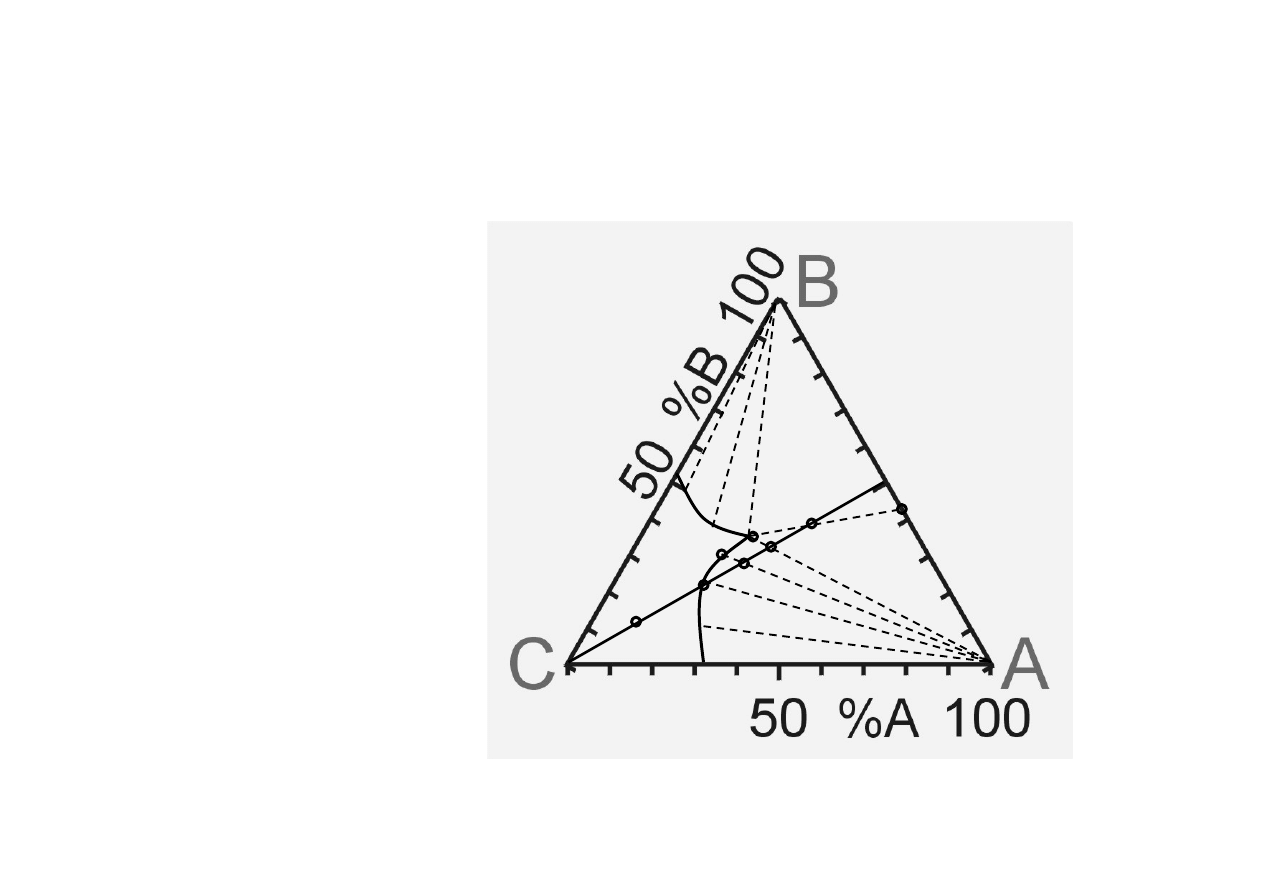
Chem. Fiz. TCH II/10
11
Układy trójskładnikowe (5).
P=const, T=const
A = sól1
B = sól2 (wspólny jon z A)
C = H
2
O
l
m
o
w
n
x y
z
Chem. Fiz. TCH II/10
12
Prawo podziału Nernsta
Dwa składniki (ciecze) o ograniczonej wzajemnej rozpuszczalności
a trzeci składnik (ciecz) obecny w bardzo niewielkich ilościach.
Stwierdzono empirycznie, że:
n
const
c
c
II
I
=
=
,
3
,
3
jeżeli P i T = const
Termodynamicznie:
II
I
,
3
,
3
µ
µ
=
zatem:
II
II
I
I
a
RT
a
RT
,
3
0
,
3
,
3
0
,
3
ln
ln
+
=
+
µ
µ
a także:
RT
a
a
I
II
II
I
0
,
3
0
,
3
,
3
,
3
ln
µ
µ
−
=
= const gdy T=const
Wyszukiwarka
Podobne podstrony:
chf tch I wykl 010Ac
chf tch I wykl 004c
chf tch I wykl 007c
chf tch I wykl 001c
chf tch I wykl 012c
chf tch I wykl 001c
chf tch I wykl 005b
chf tch I wykl 004b
chf tch I wykl 006b
chf tch I wykl 008c
chf tch I wykl 009c
chf tch I wykl 003c
chf tch I wykl 002c
chf tch I wykl 005c
chf tch I wykl 010c
chf tch I wykl 006c
chf tch I wykl 011c
chf tch I wykl 010Ac
więcej podobnych podstron