1
Chem. Fiz. TCH II/08
1
Równowagi fazowe –
układy wieloskładnikowe
Podstawowe definicje (c.d.)
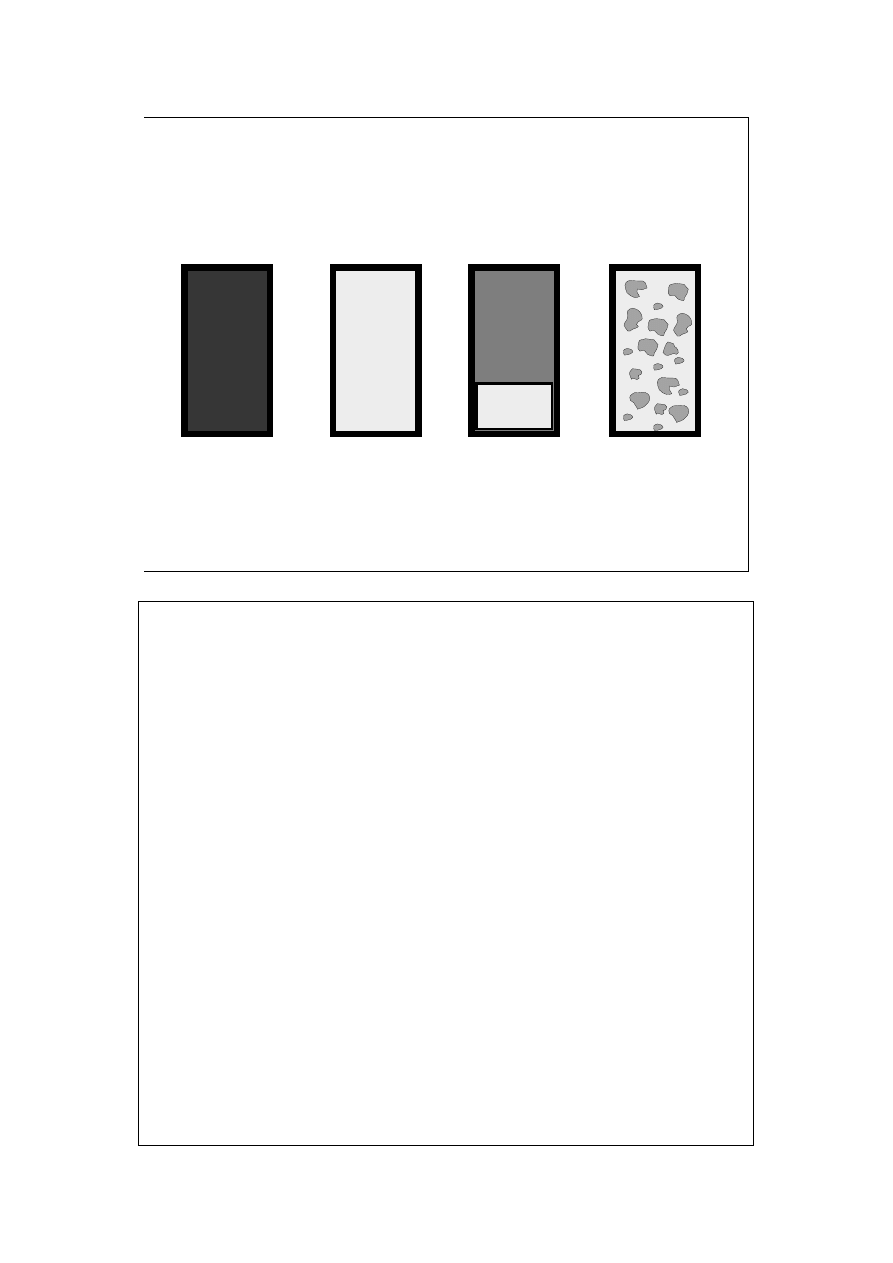
Gazy zawsze
tworzą jedną fazę
(ciągłą)
Ciecze (dwuskładnikowe) mogą
tworzyć roztwory lub nie
(rozpuszczalność częściowa)
Faza.
Ciała stałe są
często fazą
rozproszoną
Patrz też Wykład VII, slajd „Wprowadzenie do równowag fazowych (1)”.
Faza – dla danej substancji – jej postać
charakteryzująca się jednorodnym
składem chemicznym i stanem
fizycznym. W obrębie fazy niektóre
intensywne funkcje stanu (np. gęstość)
mają jednakową wartość.
Fazy w zasadzie dają się mechanicznie oddzielić od siebie. Nie jest wymagana
ciągłość fazy. W tych ostatnich przypadkach możemy mówić o fazie ciągłej –
rozpraszającej i nieciągłej – rozproszonej. W skrajnych przypadkach mamy do
czynienia: w układach ciało stałe – ciecz z dyspersjami (zawiesiny, układy
koloidalne), w układach ciało stałe – gaz i ciecz – gaz z aerozolami (mgły,
dymy). W takich układach z bardzo rozproszoną fazą istotną rolę zaczynają
odgrywać właściwości powierzchni granicznej.
2
Chem. Fiz. TCH II/08
2
Podstawowe definicje (2)
2) Składniki niezależne – są to składniki, których stężenia w układzie
można, przynajmniej w pewnym zakresie, zmieniać dowolnie. Ich
liczbę można wyznaczyć odejmując od liczby składników (bez przy-
miotnika) liczbę możliwych reakcji chemicznych, zachodzących mię-
dzy nimi w danych warunkach.
Składnikiem niezależnym nie są
np. jony w roztworach elektro-
litów, bowiem zawsze trzeba
razem z nimi dodać towarzyszą-
cy im jon o przeciwnym znaku.
W pozostającym w równowadze
(chemicznej) układzie:
CaCO
3
(s) = CaO(s) + CO
2
(g)
są tylko 2 (dwa) składniki
niezależne.
Równaniem wiążącym trzeci składnik jest równanie reakcji i odpowiednia stała
równowagi.
3
Chem. Fiz. TCH II/08
3
Podstawowe definicje (3)
3) Liczba stopni swobody – liczba parametrów, jakie można zmie-
niać w układzie, przynajmniej w pewnym zakresie, bez zmiany
liczby istniejących w nim faz. Inaczej – najmniejsza liczba
parametrów wystarczająca do jednoznacznego zdefiniowania
stanu układu.
W obszarach (płaszczyznach) istnienia jednej fazy mamy dwa stopnie swobody –
można zmieniać P i T. Wzdłuż linii (dwie fazy współistnieją) – tylko jeden
parametr – drugi jest narzucony. Punkt potrójny nie ma w ogóle stopni swobody
– jest to tzw. stan inwariantny.

4
Chem. Fiz. TCH II/08
4
Równowaga w układzie
wieloskładnikowym
Rozpatrujemy analogicznie jak dla układu jednoskładnikowego:
P=const
T=const
Ponieważ rozpatrujemy stan równowagi:
zatem:
a ponieważ:
musi być spełnione:
∑
=
Y
J
J
dn
dg
α
α
µ
∑
−
=
Y
J
J
dn
dg
β
β
µ
0
=
+
=
β
α
dg
dg
dg
(
)
0
=
−
∑
Y
J
J
J
dn
β
α
µ
µ
0
≠
J
dn
0
=
−
J
J
β
α
µ
µ
lub też:
J
J
β
α
µ
µ
=
Warunek równowagi międzyfazowej w układzie jednoskładnikowym znamy z
wykładu VII; slajd „Termodynamika równowagi fazowej (1)”.
Rozpatrujemy tutaj układ wieloskładnikowy, dwufazowy (α i β). Można
oczywiście dowieść analogicznym, choć odpowiednio bardziej rozbudowanym
rozważaniem, że potencjały chemiczne danego składnika są równe w kilku
fazach będących równocześnie w równowadze między sobą. Zastanowimy się
teraz, ile faz może ze sobą współistnieć.
5
Chem. Fiz. TCH II/08
5
Reguła faz Gibbsa (1)
Jeśli policzymy ile parametrów (stopni swobody) F musimy podać,
aby jednoznacznie określić stan układu zawierającego C niezależnych
składników i P faz:
Zmiennych stężeniowych:
C
– 1
dla każdej fazy, oraz
P
(C – 1)
dla wszystkich faz, a uwzględniwszy P i T:
P
(C – 1)+2
Jak wykazaliśmy, dla każdego składnika:
...
...
J
J
J
J
γ
β
β
α
µ
µ
µ
µ
=
=
co daje:
P
– 1 równań dla jednego składnika, oraz
C
(P – 1)
Skróty F, C, P pochodzą z języka angielskiego: degrees of Freedom,
Components, Phases.
C – 1 dla każdej fazy, bowiem ułamków molowych wystarczy podać właśnie
tyle, suma musi wynosić 1.
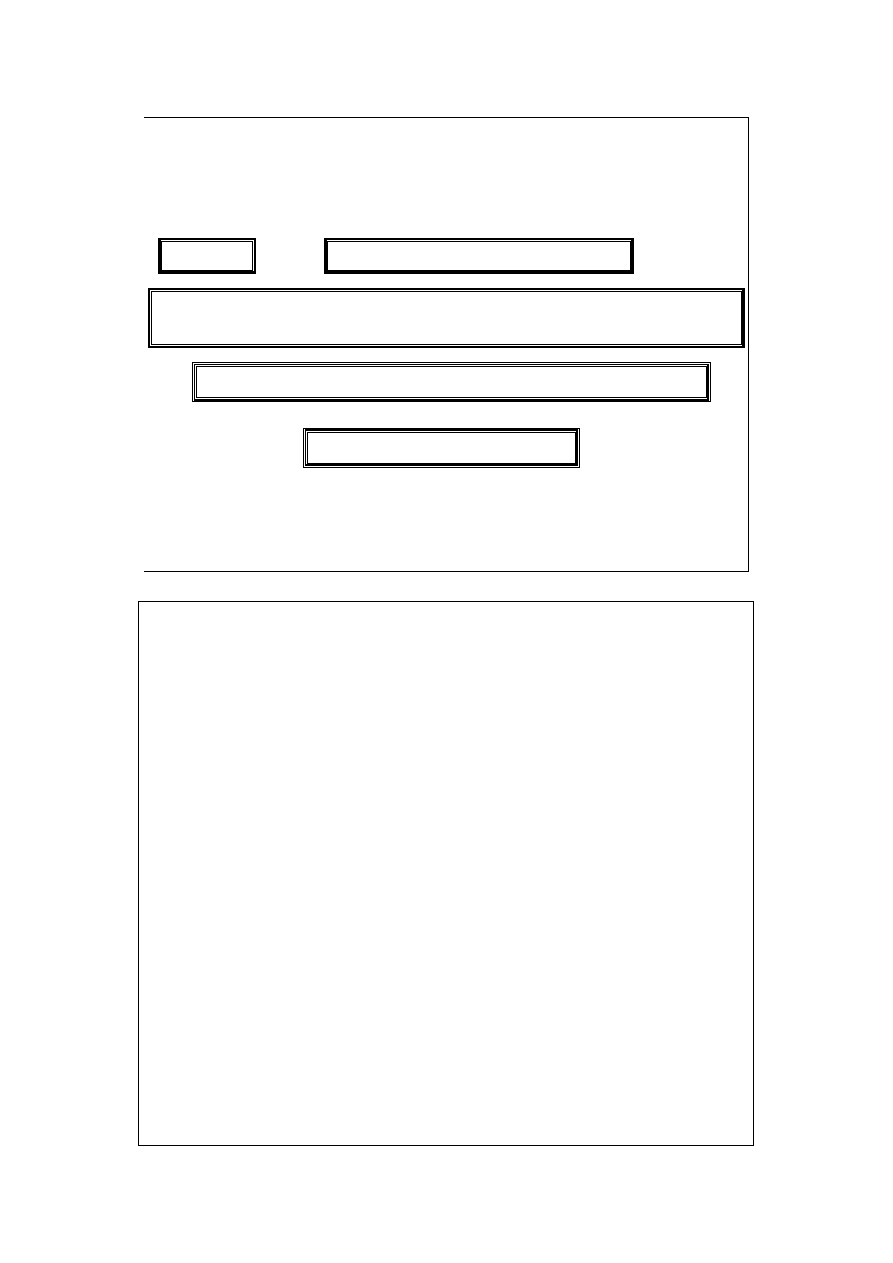
6
Chem. Fiz. TCH II/08
6
Reguła faz Gibbsa (2)
co daje:
P
– 1 równań dla jednego składnika, oraz
C
(P – 1)
dla wszystkich składników. Pomniejsza to liczbę parametrów koniecz-
nych do scharakteryzowania układu (czyli liczbę stopni swobody):
F
= P(C – 1) + 2 – C(P – 1) = C – P + 2
Jest to reguła faz Gibbsa.
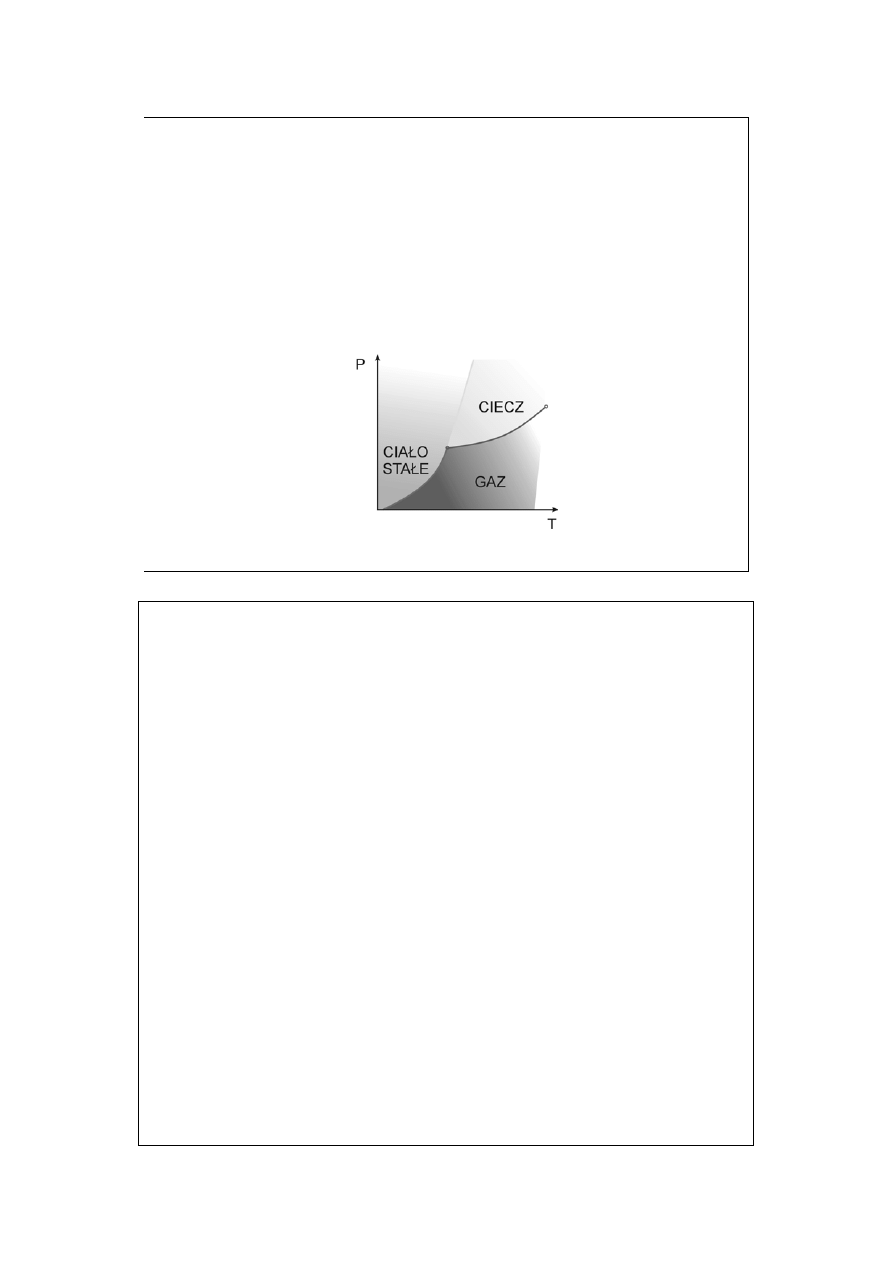
Z reguły faz zastosowanej do układu jednoskładnikowego wynika, że
maksymalna liczba faz współistniejących (dla F= 0) wynosi P=3. Zatem stan
inwariantny w układzie jednoskładnikowym odpowiada punktowi potrójnemu.
Obserwowany przez nas punkt poczwórny na układzie fazowym dla helu był albo
artefaktem (błędem, choć istnieje w źródle, skąd go przerysowywałem) i w
rzeczywistości są tam bardzo blisko położone dwa punkty potrójne, albo hel
znów jest czymś arcywyjątkowym. Mimo przeprowadzonego śledztwa, nie
potrafię rozstrzygnąć. Opowiadam się jednak za słusznością reguły faz (czyli
pierwsza możliwość wytłumaczenia – dwa punkty potrójne).

7
Chem. Fiz. TCH II/08
7
Równowaga ciecz-gaz w
układzie dwuskładnikowym
Warunek równowagi w układzie jednoskładnikowym:
T=const
β
α
µ
µ
=
w szczególności, dla układu ciecz – gaz:
g
c
µ
µ
=
Potencjał chemiczny gazu dany jest równaniem:
0
0
ln
P
P
RT
g
g
+
=
µ
µ
Nad czystym składnikiem A:
*
*
0
0
*
ln
A
cA
o
A
gA
gA
P
p
RT
µ
µ
µ
µ
=
=
+
=
Nad mieszaniną, dla A:
A
cA
A
gA
gA
P
p
RT
µ
µ
µ
µ
=
=
+
=
0
0
ln
Łącznie daje to:
o
A
A
A
A
p
p
RT
ln
*
+
=
µ
µ
Potencjał chemiczny gazu określiliśmy na wykładzie V; slajdy: „Entalpia
swobodna a lotność gazów (1)” i „Potencjał chemiczny mieszanin gazowych
(1)”.
Prężność P
A
nad mieszaniną jest prężnością cząstkową. Na razie zakładamy
zachowanie par jak gazu doskonałego.
8
Chem. Fiz. TCH II/08
8
Prawo Raoulta (1)
Stwierdzone empirycznie (dla „podobnych” cieczy):
o
A
A
A
p
x
p
=
Co ostatecznie pozwala zapisać:
A
A
A
x
RT ln
*
+
=
µ
µ
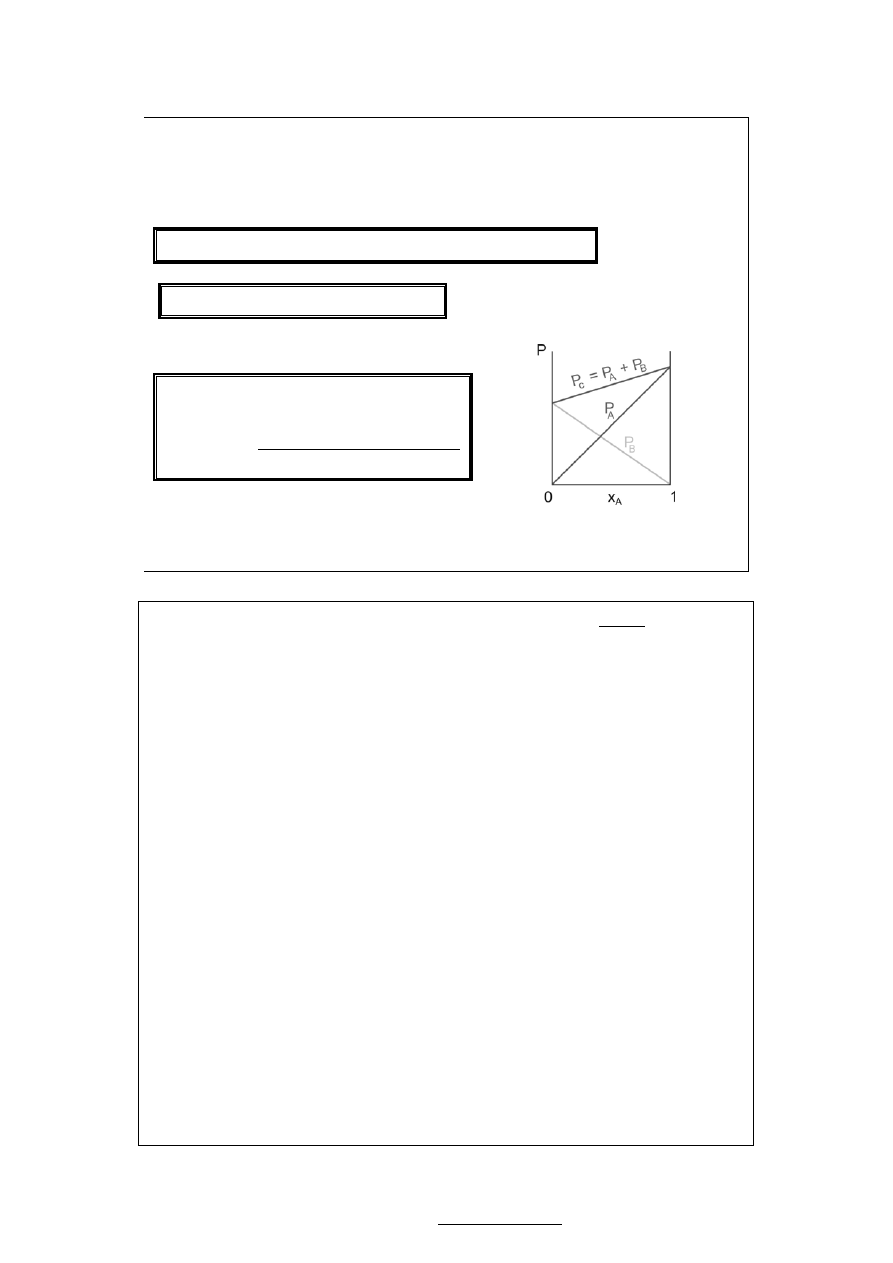
Roztwory spełniające prawo Raoulta
w całym zakresie stężeń (składu)
nazywamy roztworami doskonałymi
(idealnymi).
T=const
W prawie Raoulta x
A
oznacza ułamek molowy składnika A w cieczy.
Ostatnie równanie posłuży nam do
zdefiniowania roztworu doskonałego,
prawo Raoulta jest raczej konsekwencją
istnienia takiego roztworu, aniżeli
odwrotnie.
Zauważmy, że w ostatnim równaniu nie
ma już założenia o idealności gazu
(wszystko dotyczy roztworów).
Na wykresie prawo Raoulta jest
podobne do prawa Daltona, gdzie jednak
na osi X odłożony był ułamek molowy
w gazie, zaś linia ciśnienia
sumarycznego była pozioma.
9
Chem. Fiz. TCH II/08
9
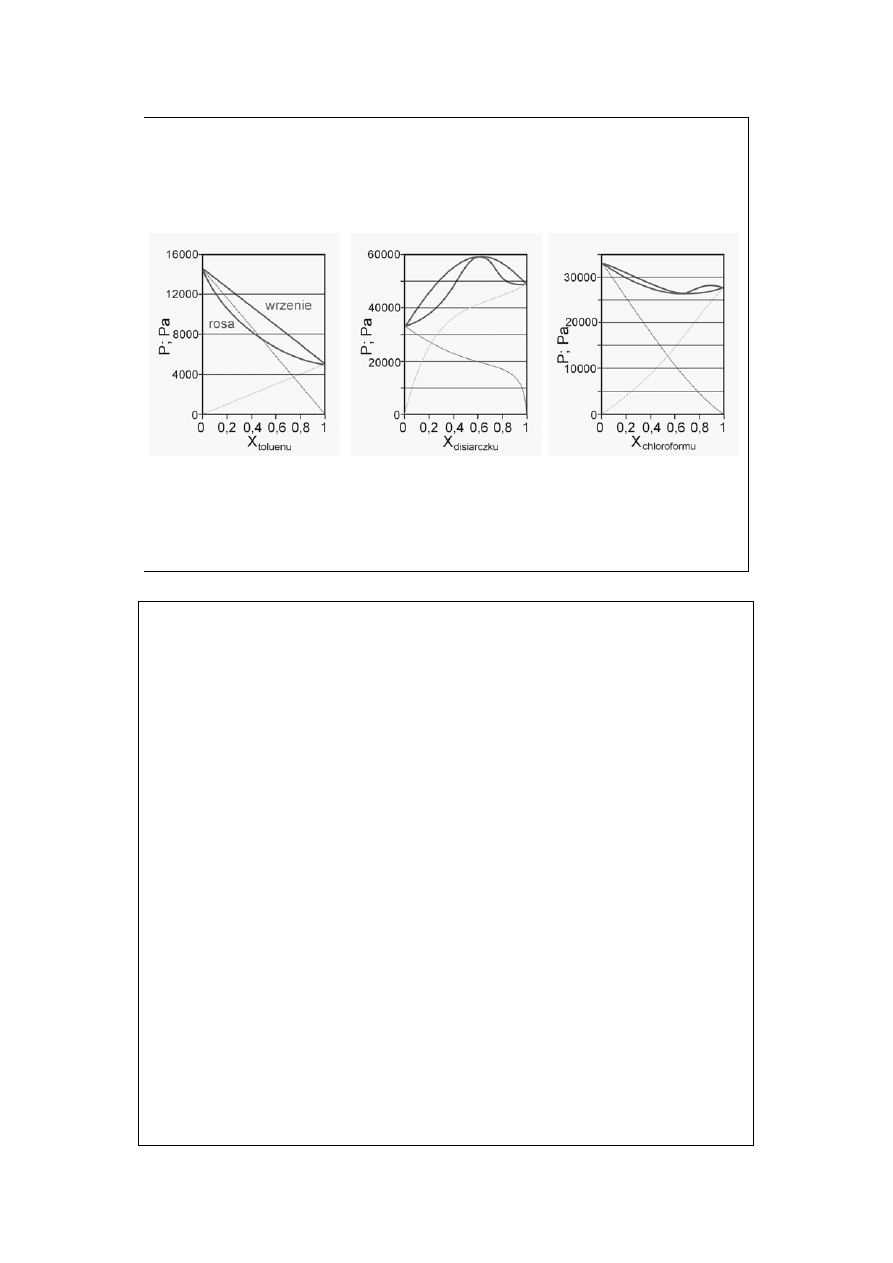
Prawo Raoulta (2)
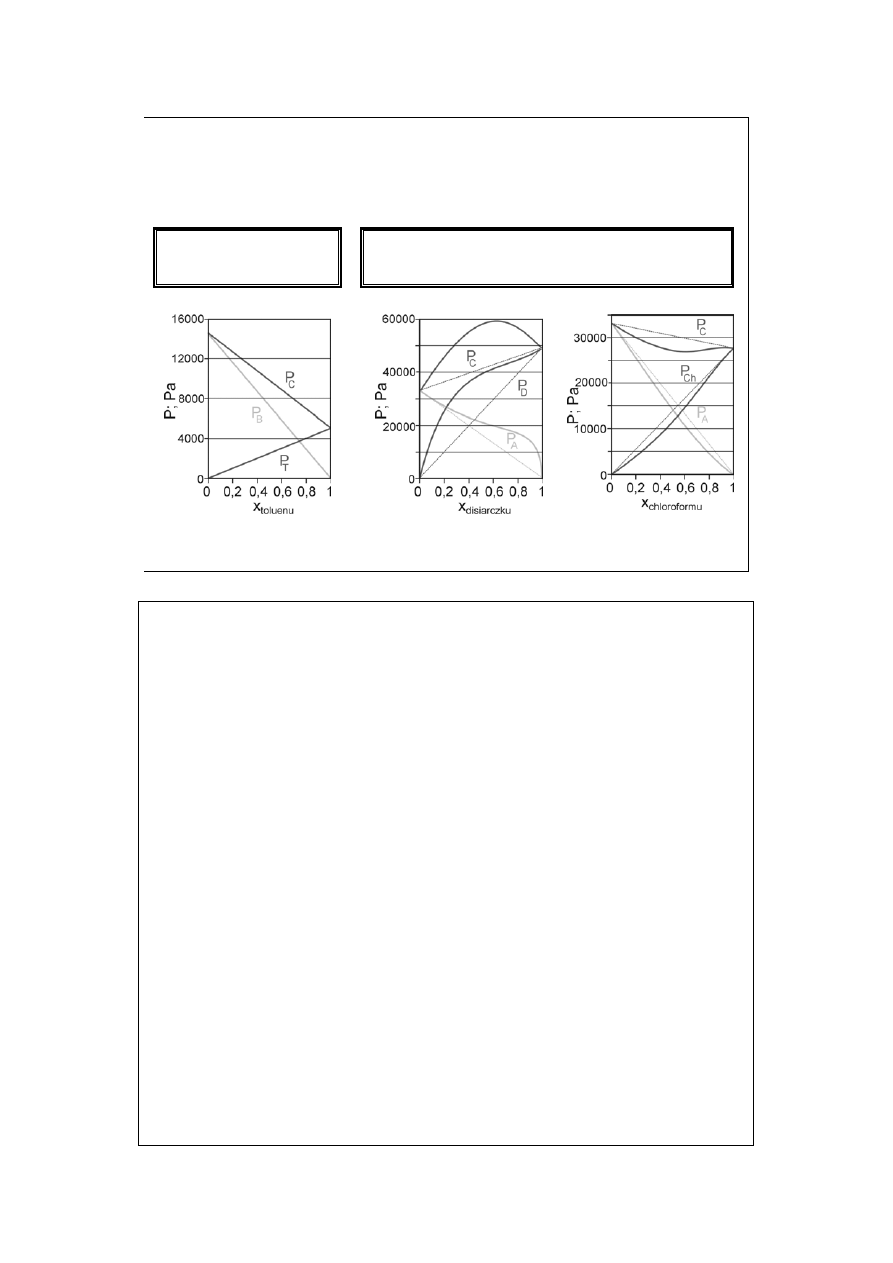
Ciecze podobne
chemicznie
Ciecze różniące się właściwościami
chemicznymi
Wykresy (od lewej) odpowiadają
układom: Benzen – Toluen, Aceton –
Disiarczek węgla, Chloroform – Aceton.
Wszystkie dla 298,15 K.
Układ pierwszy zachowuje się prawie
idealnie zgodnie (spełnia całkowicie)
prawo Raoulta, układ drugi wykazuje
odchylenia dodatnie, zaś trzeci –
ujemne.

10
Chem. Fiz. TCH II/08
10
Układ dwuskładnikowy
a reguła faz
C
= 2, czyli F + P = 4
Wniosek (1):
W układzie dwuskładnikowym możliwy jest punkt poczwórny.
Wniosek (2):
W układzie dwuskładnikowym możliwy są 3 stopnie swobody
(parametry definiujące stan układu). Będą to, ciśnienie, temperatu-
ra oraz ułamek molowy jednego ze składników. Aby móc przedsta-
wiać wykresy fazowe na płaszczyźnie (w dwóch wymiarach),
zwykle ustala się warunki jako izotermiczne lub izobaryczne, kiedy
to F + P = 3 (dla T = const lub P = const).
Wniosek (1) dotyczy stanu inwariantnego, gdy F=0.
Wniosek (2) dotyczy układu, w którym istnieje tylko 1 faza, P=1.
11
Chem. Fiz. TCH II/08
11
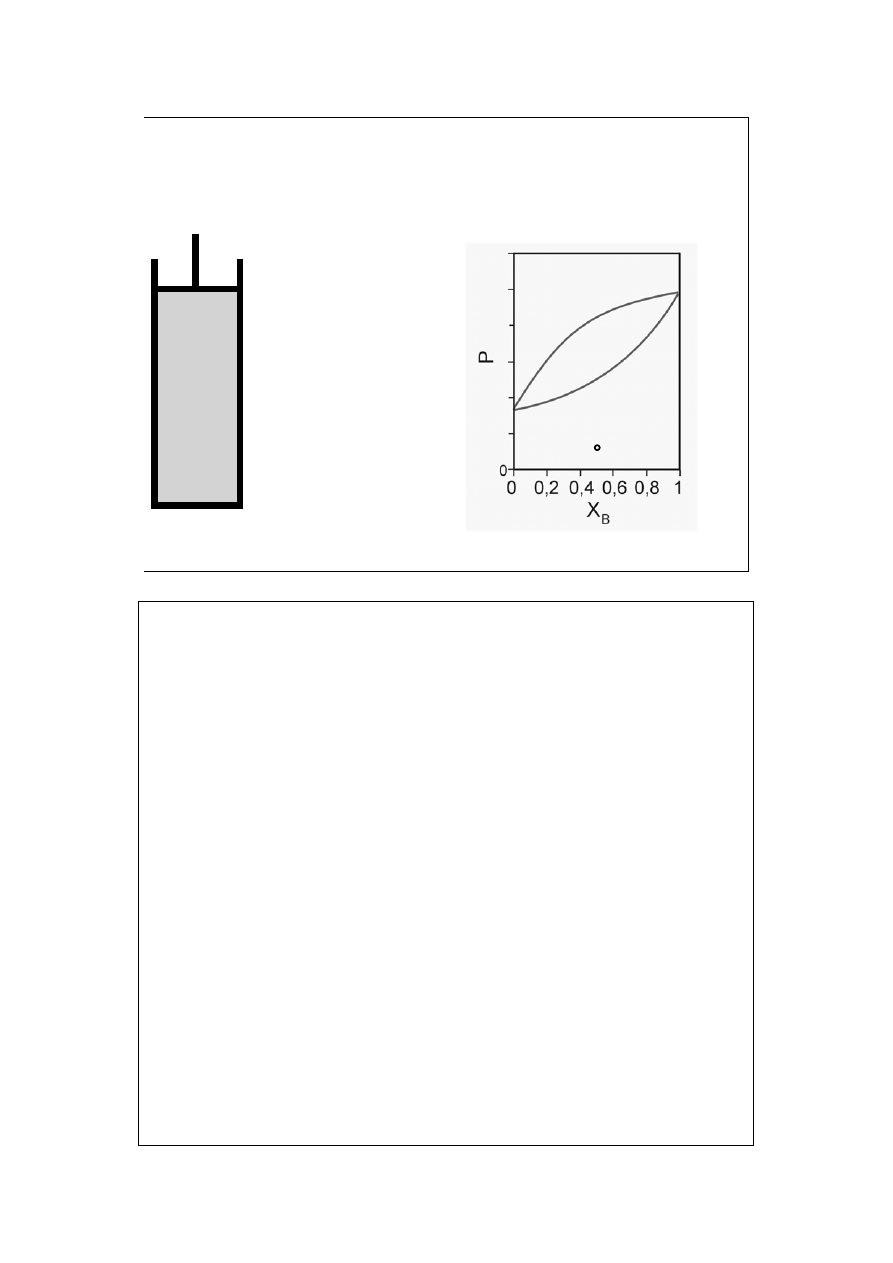
Diagram fazowy
ciecz-para (1a)
T=const
X
B
=const
a
para nie
nasycona
X
B
=y
B
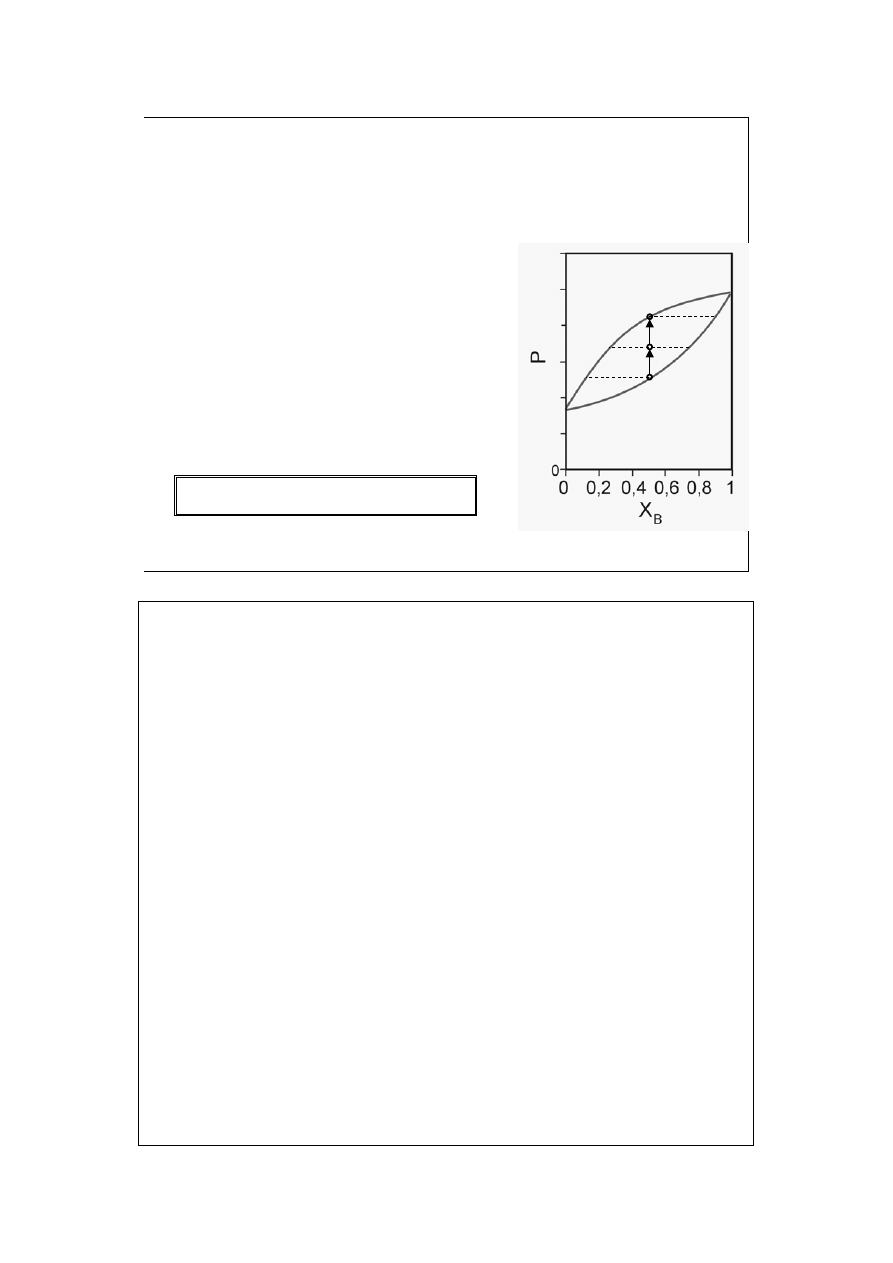
a
Krzywa rosy pokazuje zależność prężności pary nasyconej P (obu składników) od
jej składu X=y.
Krzywa wrzenia pokazuje zależność prężności pary nasyconej P od składu cieczy
z którą para ta jest w równowadze, X=x.
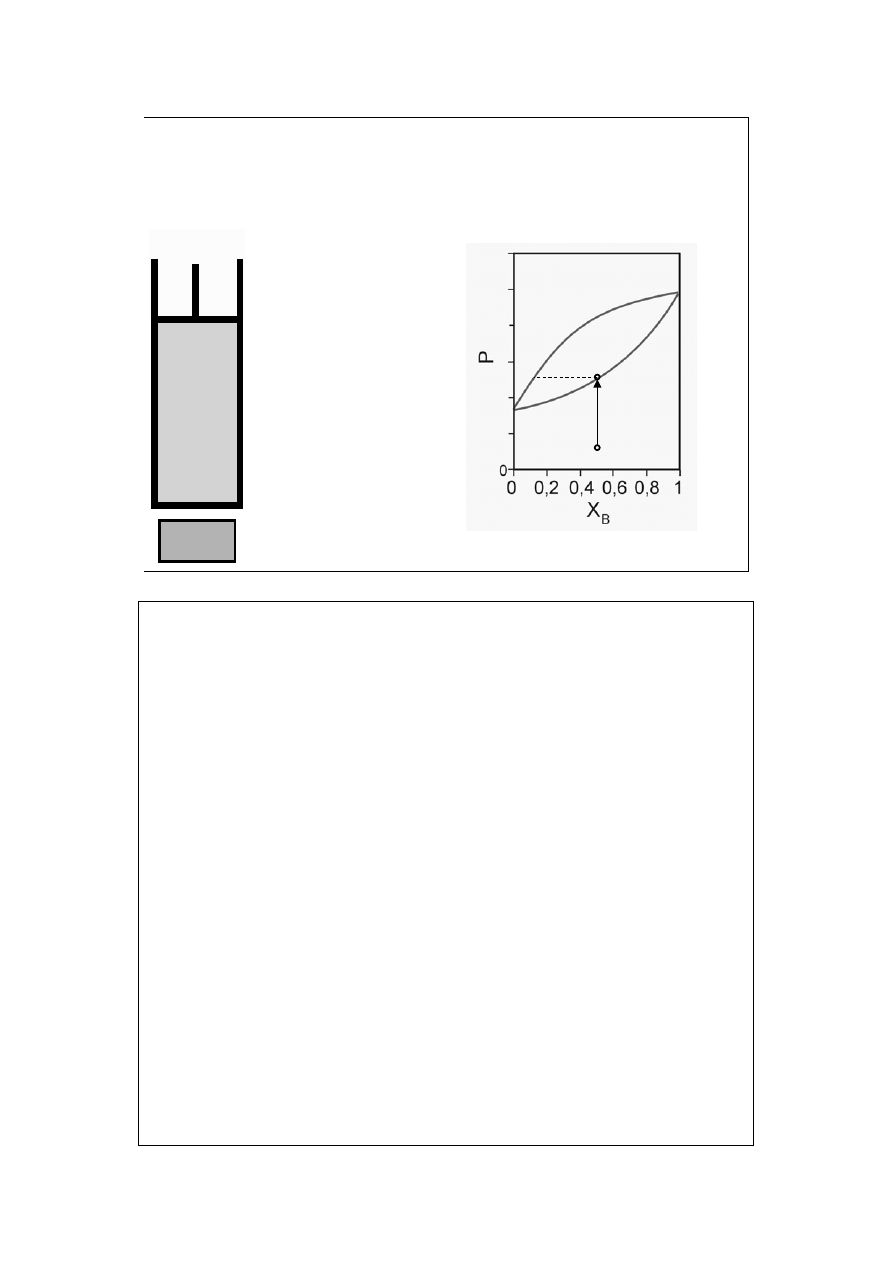
12
Chem. Fiz. TCH II/08
12
Diagram fazowy
ciecz-para (1b)
T=const
X
B
=const
a
para nie
nasycona
X
B
=y
B
rosa na
ściankach
para
nasycona
X
B
=y
B
b
a
b
Krzywa rosy pokazuje zależność prężności pary nasyconej P (obu składników) od
jej składu X=y.
Krzywa wrzenia pokazuje zależność prężności pary nasyconej P od składu cieczy
z którą para ta jest w równowadze, X=x.
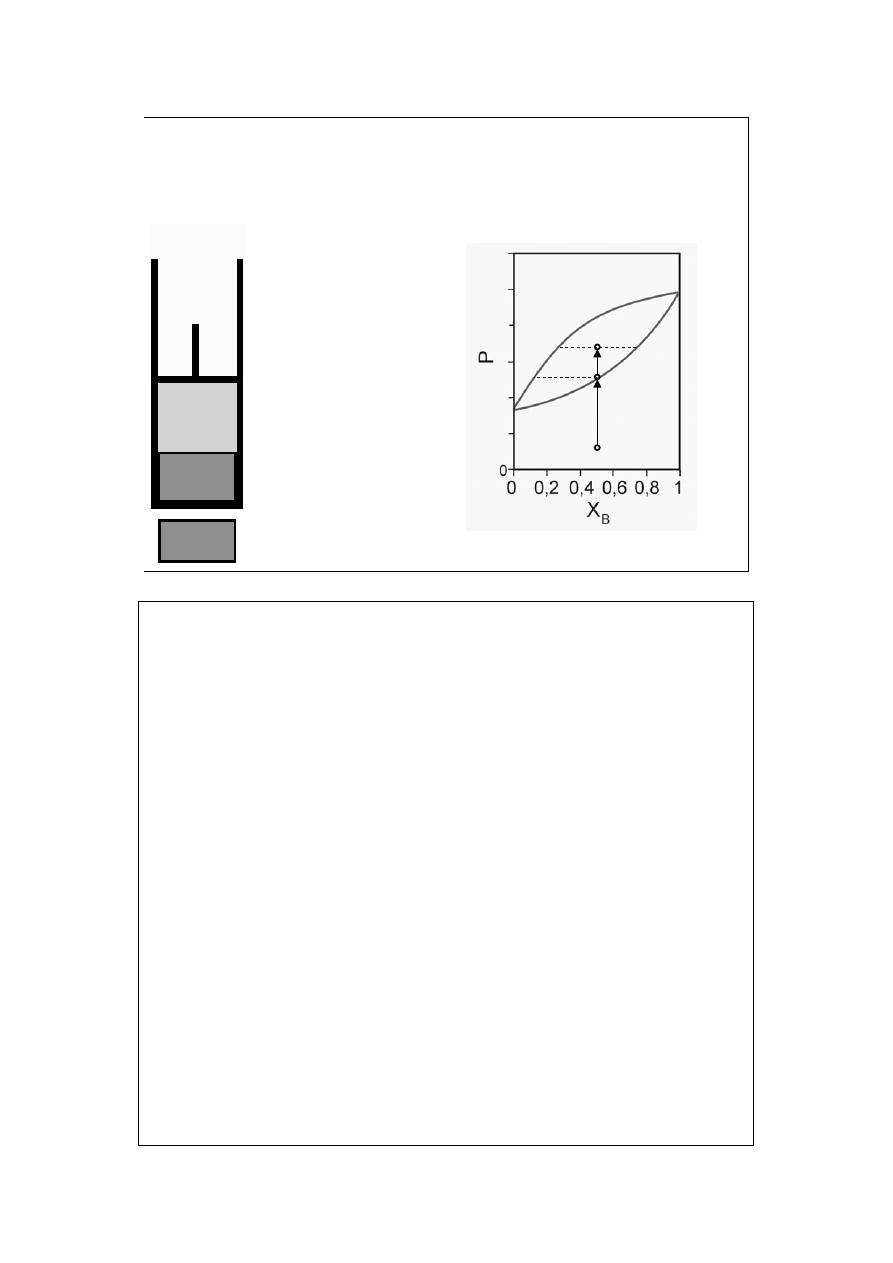
13
Chem. Fiz. TCH II/08
13
Diagram fazowy
ciecz-para (1c)
T=const
X
B
=const
a
para nie
nasycona
X
B
=y
B
rosa na
ściankach
para
nasycona
X
B
=y
B
b
ciecz
para
nasycona
x
B
<X
B
<y
B
c
a
b
c
Krzywa rosy pokazuje zależność prężności pary nasyconej P (obu składników) od
jej składu X=y.
Krzywa wrzenia pokazuje zależność prężności pary nasyconej P od składu cieczy
z którą para ta jest w równowadze, X=x.
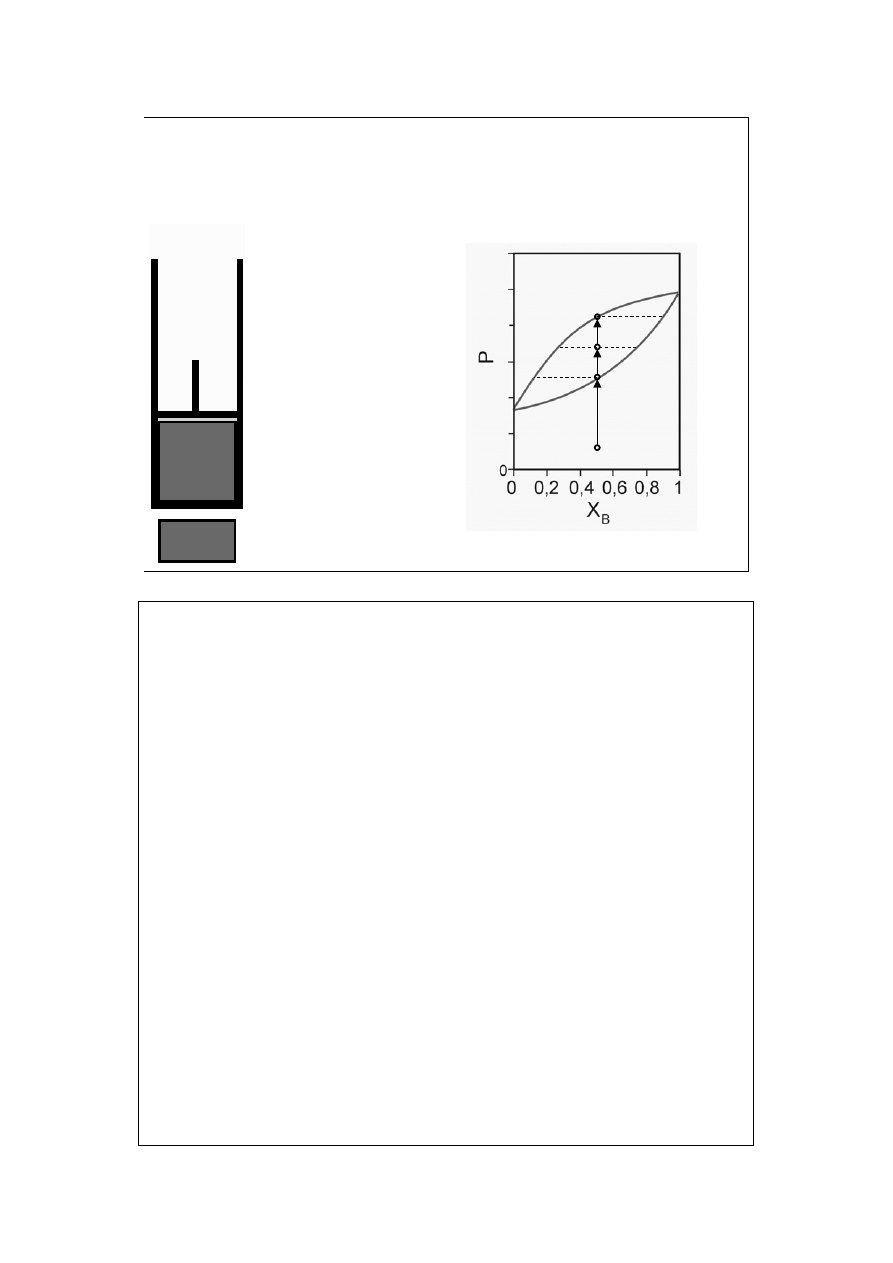
14
Chem. Fiz. TCH II/08
14
Diagram fazowy
ciecz-para (1d)
T=const
X
B
=const
a
para nie
nasycona
X
B
=y
B
rosa na
ściankach
para
nasycona
X
B
=y
B
b
ciecz
para
nasycona
x
B
<X
B
<y
B
c
ciecz
resztka
para
nasyconej
x
B
=X
B
d
a
b
c
d
Krzywa rosy pokazuje zależność prężności pary nasyconej P (obu składników) od
jej składu X=y.
Krzywa wrzenia pokazuje zależność prężności pary nasyconej P od składu cieczy
z którą para ta jest w równowadze, X=x.
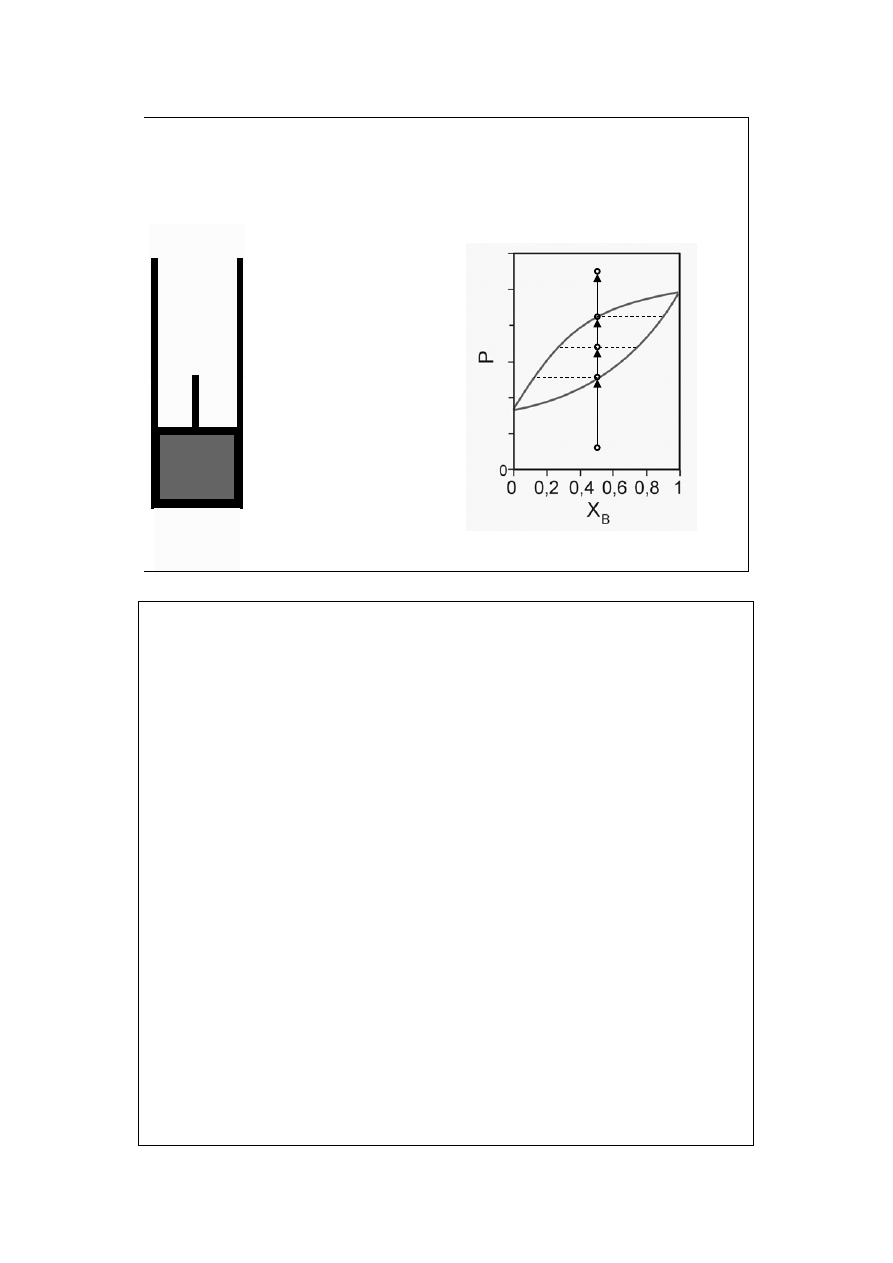
15
Chem. Fiz. TCH II/08
15
Diagram fazowy
ciecz-para (1)
T=const
X
B
=const
a
para nie
nasycona
X
B
=y
B
rosa na
ściankach
para
nasycona
X
B
=y
B
b
ciecz
para
nasycona
x
B
<X
B
<y
B
c
ciecz
resztka
para
nasyconej
x
B
=X
B
d
tylko
ciecz
x
B
=X
B
e
a
b
c
d
e
Krzywa rosy pokazuje zależność prężności pary nasyconej P (obu składników) od
jej składu X=y.
Krzywa wrzenia pokazuje zależność prężności pary nasyconej P od składu cieczy
z którą para ta jest w równowadze, X=x.
16
Chem. Fiz. TCH II/08
16
Diagram fazowy
ciecz-para (2)
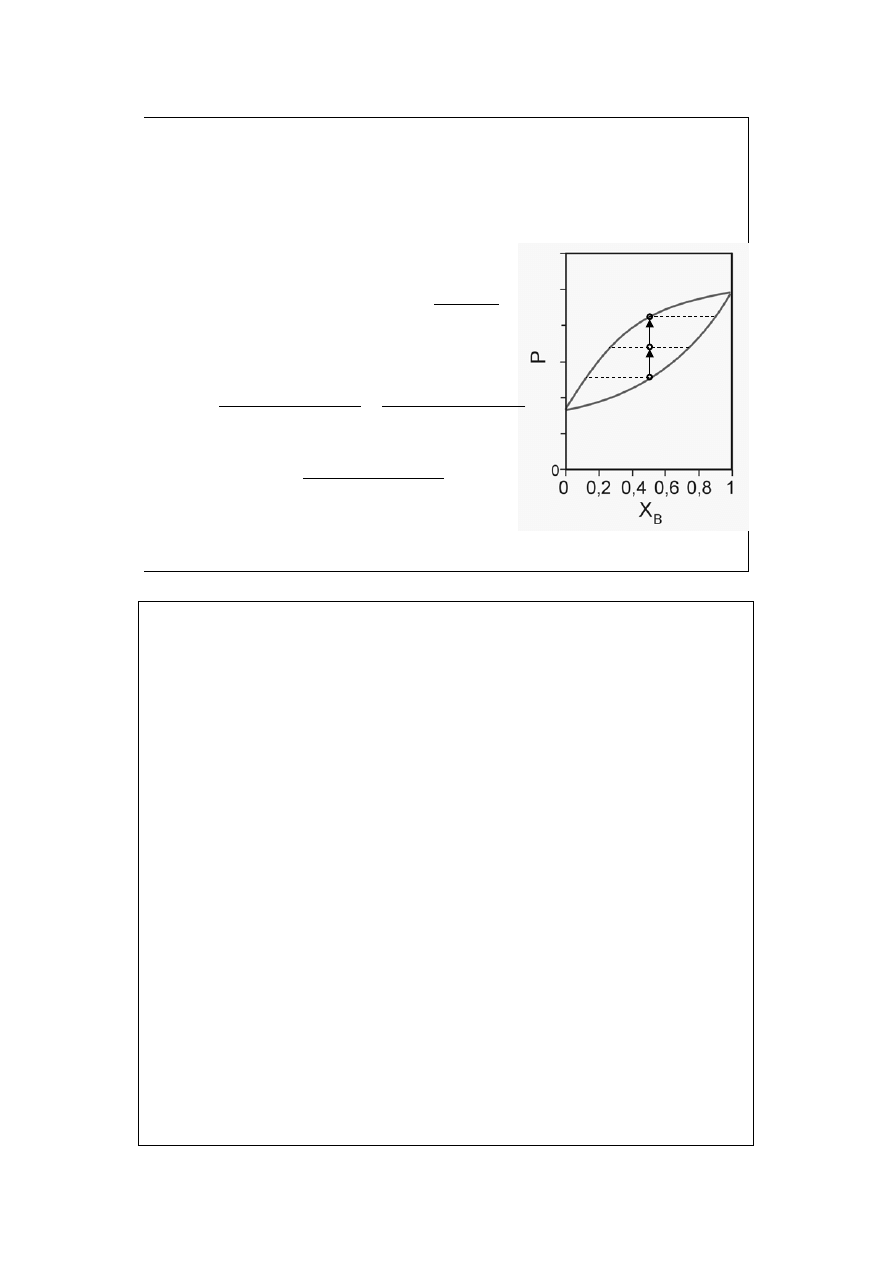
Równanie krzywej wrzenia:
(gdy spełnione jest prawo Raoulta –
powinna być prostą)
)
1
(
B
o
A
A
o
A
A
x
p
x
p
p
−
=
=
B
o
B
B
x
p
p
=
B
o
A
o
B
o
A
A
B
x
p
p
p
p
p
P
)
(
−
+
=
+
=
X
B
– ułamek molowy składnika B
w całym układzie,
x
B
– ułamek molowy składnika B w cieczy,
y
B
– ułamek molowy składnika B w parze.
17
Chem. Fiz. TCH II/08
17
Diagram fazowy
ciecz-para (3)
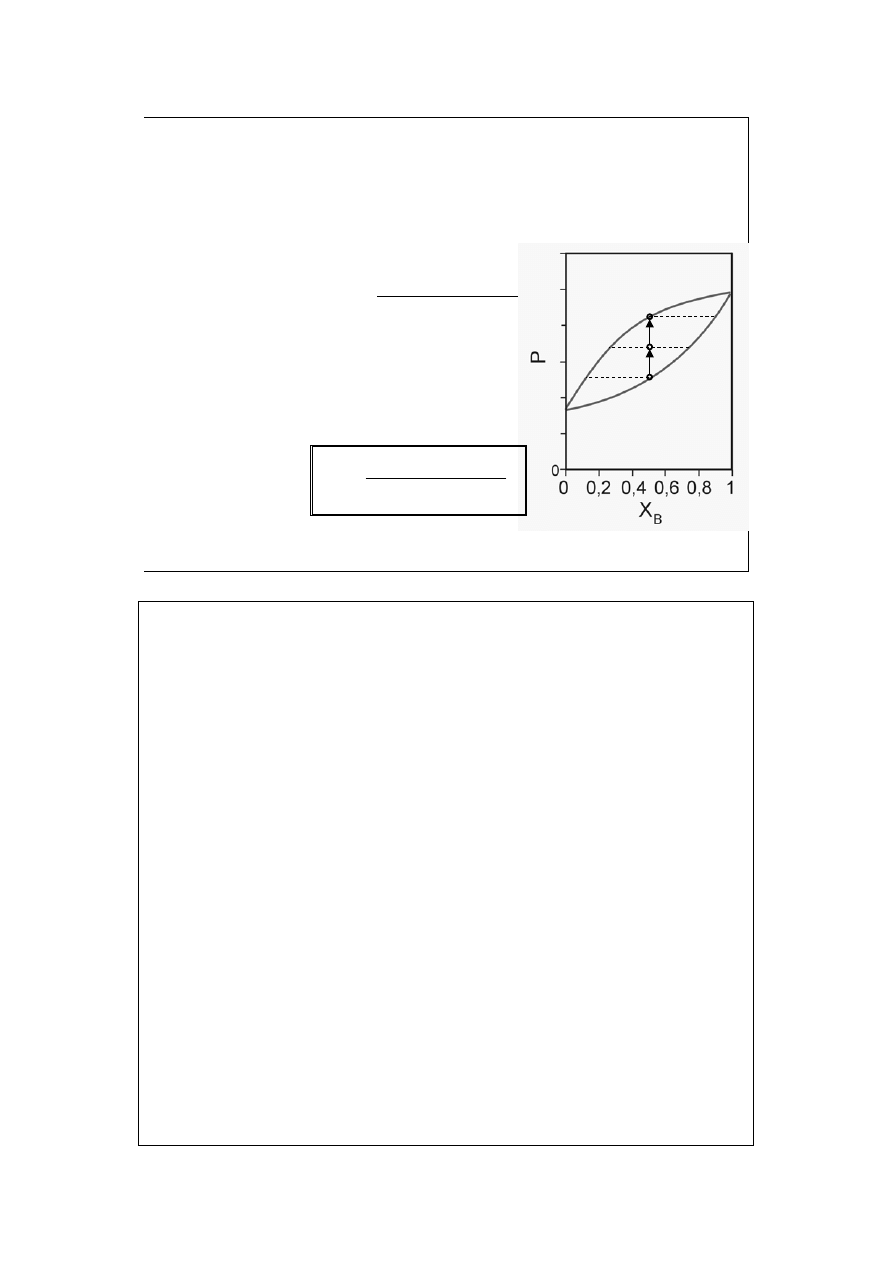
Równanie krzywej rosy:
(gdy spełnione jest prawo Raoulta)
B
A
B
B
p
p
p
y
+
=
Definicja ułamka
molowego w gazie:
Wprowadzamy prawo Raoulta:
B
o
B
B
o
A
o
A
B
o
B
B
o
B
B
o
A
B
o
B
B
x
p
x
p
p
x
p
x
p
x
p
x
p
y
+
−
=
+
−
=
)
1
(
skąd:
B
o
A
o
B
o
B
o
B
o
A
B
y
p
p
p
p
p
x
)
(
−
−
=
18
Chem. Fiz. TCH II/08
18
Diagram fazowy
ciecz-para (4)
Równanie krzywej rosy (c.d.)
(gdy spełnione jest prawo Raoulta)
Wyrażenie na x
B
:
B
o
A
o
B
o
B
B
o
A
B
y
p
p
p
y
p
x
)
(
−
−
=
wprowadzamy do wzoru na krzywą wrzenia,
aby ciśnienie całkowite uzależnić od y
B
:,
B
o
A
o
B
o
A
A
B
x
p
p
p
p
p
P
)
(
−
+
=
+
=
co daje po
przekształceniu:
B
o
A
o
B
o
B
o
B
o
A
y
p
p
p
p
p
P
)
(
−
−
=
19
Chem. Fiz. TCH II/08
19
Diagram fazowy
ciecz-para (5)
Ogladamy te same układy, co na slajdzie „Prawo Raoulta (2)”.
20
Chem. Fiz. TCH II/08
20
Reguła dźwigni
)
(
p
c
B
B
B
p
B
c
n
n
X
nX
y
n
x
n
+
=
=
+
X
B
– ułamek molowy składnika B
w całym układzie, liczba moli tamże n
x
B
– ułamek molowy składnika B w cieczy, n
c
y
B
– ułamek molowy składnika B w parze, n
p
.
x
B
y
B
Bilans:
c
p
B
B
B
B
p
c
l
l
x
X
X
y
n
n
=
−
−
=
l
c
l
p
21
Chem. Fiz. TCH II/08
21
Prawa Konowałłowa
I.
Para jest bogatsza w ten składnik, którego dodanie do
mieszaniny cieczy powoduje podwyższenie całkowitej
prężności par mieszaniny.
II.
W przypadku takiego składu fazy ciekłej, któremu od-
powiada ekstremum na krzywej prężności pary w wa-
runkach izotermicznych i równocześnie ekstremum
temperatury na krzywej w warunkach izobarycznych,
skład pary nasyconej jest równy składowi cieczy.
Uzasadnienie teoretyczne w oparciu o równanie Gibbsa – Duhema, zostanie
zaprezentowane na następnym wykładzie.
Wyszukiwarka
Podobne podstrony:
chf tch I wykl 010Ac
chf tch I wykl 004c
chf tch I wykl 010a
chf tch I wykl 007c
chf tch I wykl 001c
chf tch I wykl 012c
chf tch I wykl 001c
chf tch I wykl 005b
chf tch I wykl 004b
chf tch I wykl 006b
chf tch I wykl 009c
chf tch I wykl 003c
chf tch I wykl 002c
chf tch I wykl 005c
chf tch I wykl 010c
chf tch I wykl 006c
chf tch I wykl 011c
chf tch I wykl 010Ac
więcej podobnych podstron