
1
Chem. Fiz. TCH II/06
1
Entalpia swobodna reakcji
chemicznej (1)
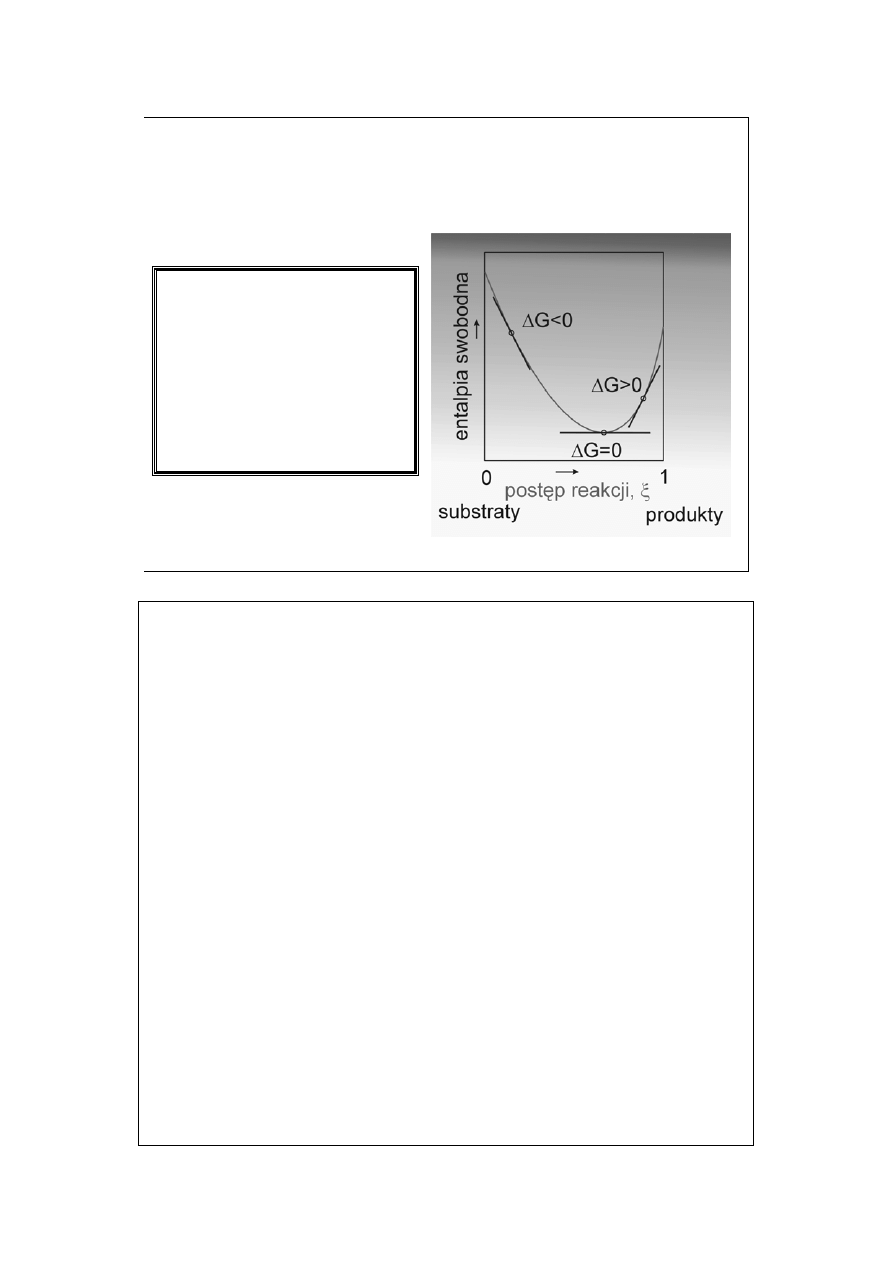
Dla reakcji: A = M (znane są liczne przypadki, choćby izomeryzacja)
Jeżeli dojdzie do infinitezymalnej zmiany składu mieszaniny reakcyj-
nej , czyli postępu reakcji, d
ξ
, tak że dn
A
= –d
ξ
, zaś dn
M
= d
ξ
, to:
dG =
µ
A
dn
A
+
µ
M
dn
M
= –
µ
A
d
ξ
+
µ
M
d
ξ
= (
µ
M
–
µ
A
)d
ξ
To entalpią swobodną reakcji
nazywamy pochodną:
A
M
T
P
r
G
G
µ
µ
ξ
−
=
∂
∂
=
∆
,
Na przykład, jeśli n
A,0
= 3, zaś postęp reakcji wyniósł
ξ=1,8, to n
A
=1,2, zaś
n
B
=1,8.
Postęp reakcji mierzymy po prostu w molach.
Tak zdefiniowana entalpia swobodna reakcji jest różnicą potencjałów
chemicznych produktów i substratów dla danego składu mieszaniny reakcyjnej.
2
Chem. Fiz. TCH II/06
2
Entalpia swobodna reakcji
chemicznej (2)
Zależnie od składu mieszani-
ny reakcyjnej możemy ocze-
kiwać samorzutnego przebie-
gu reakcji w prawo, w lewo
(samorzutnie przebiega reak-
cja przeciwna) lub pozosta-
wania przez nią w równowa-
dze.
3
Chem. Fiz. TCH II/06
3
Entalpia swobodna reakcji
chemicznej (3)
Reakcje egzoergiczne: wytwarzające pracę (mogące napędzać
inne procesy lub dostarczające pracy nie objętościowej), gdy
∆G<0. Np. reakcja w ogniwie galwanicznym.
Reakcje endoergiczne: zużywające pracę (wykorzystujące inne
procesy, potrzebujące pracy nie objętościowej), gdy ∆G>0. Np.
reakcja wymuszona w elektrolizerze.

4
Chem. Fiz. TCH II/06
4
Równowaga chemiczna (1)
Dla reakcji: A = M, gdy A i M są gazami doskonałymi,
gdzie Q jest jedną z możliwych (najprostszą ) postaci
ilorazu reakcji.
(
)
0
0
/
ln
P
P
RT
A
A
A
+
=
µ
µ
oraz
(
)
0
0
/
ln
P
P
RT
M
M
M
+
=
µ
µ
Q
RT
G
P
P
P
P
RT
G
r
A
M
A
M
A
M
r
ln
/
/
ln
0
0
0
0
0
+
∆
=
+
−
=
−
=
∆
µ
µ
µ
µ
0
,
0
,
0
A
tw
M
tw
r
G
G
G
∆
−
∆
=
∆
Pierwsze równanie pokazane i dyskutowane było na slajdach Entalpia swobodna
a lotność gazów (1) i Potencjał chemiczny mieszanin gazowych (1) wykładu nr 5.
Iloraz reakcji – patrz slajd Iloraz reakcji, wykład 4.
Wzór na ∆G
0
r
był już omawiany (w postaci ogólnej) na wykładzie 4, slajd
Entalpia swobodna (4).
5
Chem. Fiz. TCH II/06
5
Równowaga chemiczna (2)
0
ln
0
=
+
∆
r
r
Q
RT
G
W stanie równowagi, ∆G = 0, zatem
Równowagowy iloraz reakcji, Q
r
nazywamy stałą równowagi
reakcji i oznaczamy symbolem K . Jej definicja jest identyczna jak
ilorazu reakcji, lecz podstawione do wzoru ciśnienia (lotności,
stężenia, aktywności, itd.) nie są dowolne, lecz odpowiadają
składowi równowagowemu mieszaniny reakcyjnej.
P
r
K
RT
G
ln
0
−
=
∆
0
,
0
,
/
/
P
P
P
P
K
rów
A
rów
M
P
=
rów
A
rów
M
x
P
x
x
K
K
,
,
=
=
Stała jest tu zdefiniowana za pomocą ciśnień (prężności) równowagowych, stąd
dodajemy jej indeks P.
Gaz doskonały spełnia prawo Daltona, jeżeli więc w mieszaninie nie ma innych
składników poza A i M (np. rozcieńczającego je gazu, nie biorącego udział w
reakcji), to K
P
=K
x
.
6
Chem. Fiz. TCH II/06
6
Równowaga chemiczna (3)
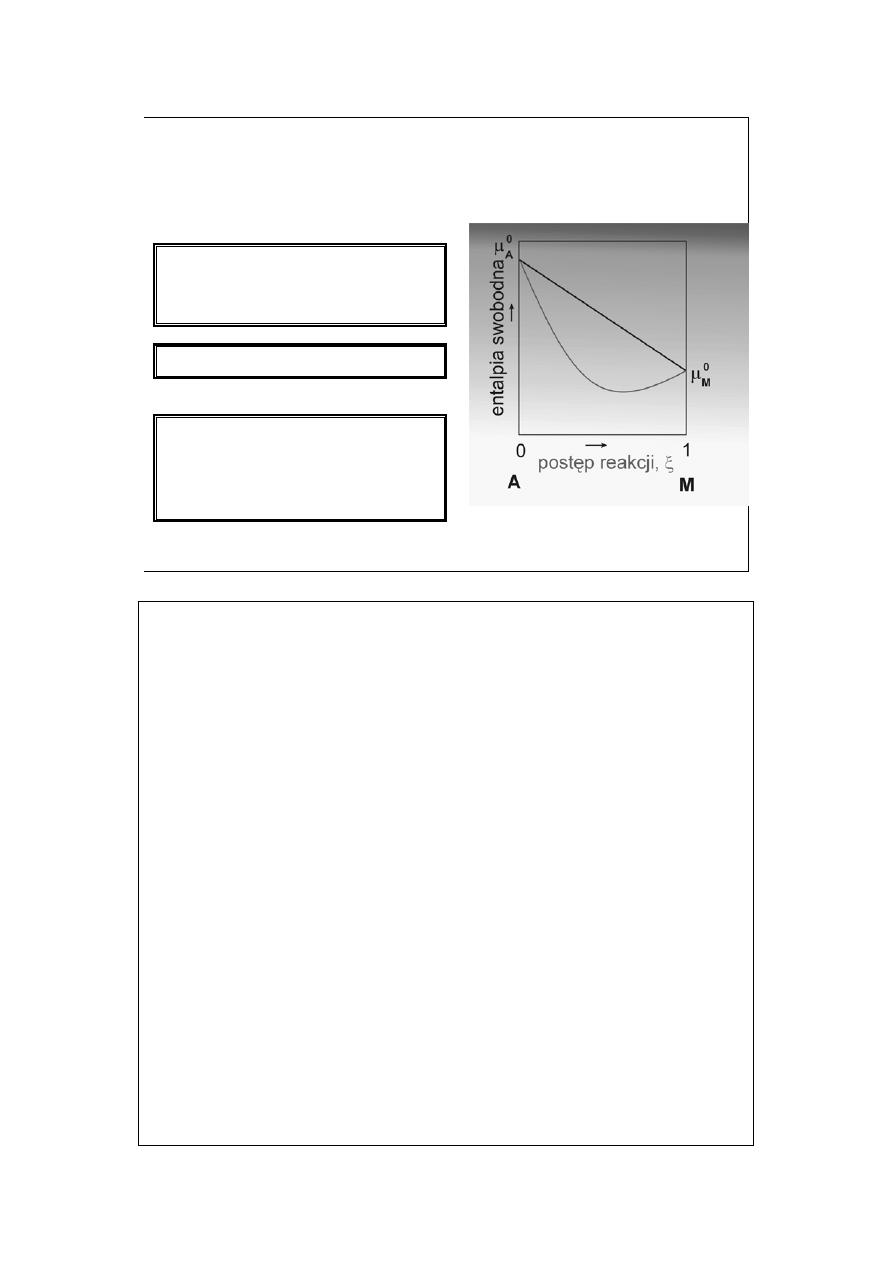
Dla gazu doskonałego zatem,
entalpia swobodna reakcji A = M
powinna zmieniać się liniowo:
jednak zmienia się inaczej:
Rzeczywisty przebieg
spowodowany jest wkładem
entalpii swobodnej mieszania
składników gazowych:
)
ln
ln
(
M
M
A
A
miesz
x
x
x
x
nRT
G
+
=
∆
7
Chem. Fiz. TCH II/06
7
Entalpia swobodna
mieszania (1)
{
}
{
}
)
/
ln(
)
/
ln(
0
0
0
0
P
P
RT
n
P
P
RT
n
n
n
G
M
M
A
A
M
M
A
A
p
+
+
+
=
+
=
µ
µ
µ
µ
stan początkowy: P
A
= P
M
= P
mieszanie
stan końcowy: P
A
+ P
M
= P
P
A
P
M
T = const.
{
}
{
}
)
/
ln(
)
/
ln(
0
0
0
0
P
P
RT
n
P
P
RT
n
G
M
M
M
A
A
A
k
+
+
+
=
µ
µ
)
ln
ln
(
)
/
ln(
)
/
ln(
M
M
A
A
M
M
A
A
p
k
miesz
x
x
x
x
nRT
P
P
RT
n
P
P
RT
n
G
G
G
+
=
+
=
−
=
∆
n = n
A
+ n
B
P
A
= x
A
P; P
M
= x
M
P
Gazy A i M nie reagują tutaj ze sobą.
Ostatnie przekształcenie wynika po prostu z prawa Daltona, patrz slajd Gaz
doskonały(2), wykład 5.
W powyższym przykładzie P
A
i P
B
maleją, mimo, że całkowite ciśnienie nie
ulega zmianie. Sprawdź, jak zmienia się entalpia swobodna, gdy mieszamy 2
jednakowe objętości gazu doskonałego o różnych ciśnieniach i połączymy oba
zbiorniki. Wtedy zmiana G jest sumą udziału pochodzącego od mieszania i od
zmiany ciśnień.
Przypominam, że entalpia swobodna zmienia się w każdym procesie, ale tylko w
izobarycznym możemy ją utożsamić z pracą nie objętościową.
8
Chem. Fiz. TCH II/06
8
Entalpia swobodna
mieszania (2)
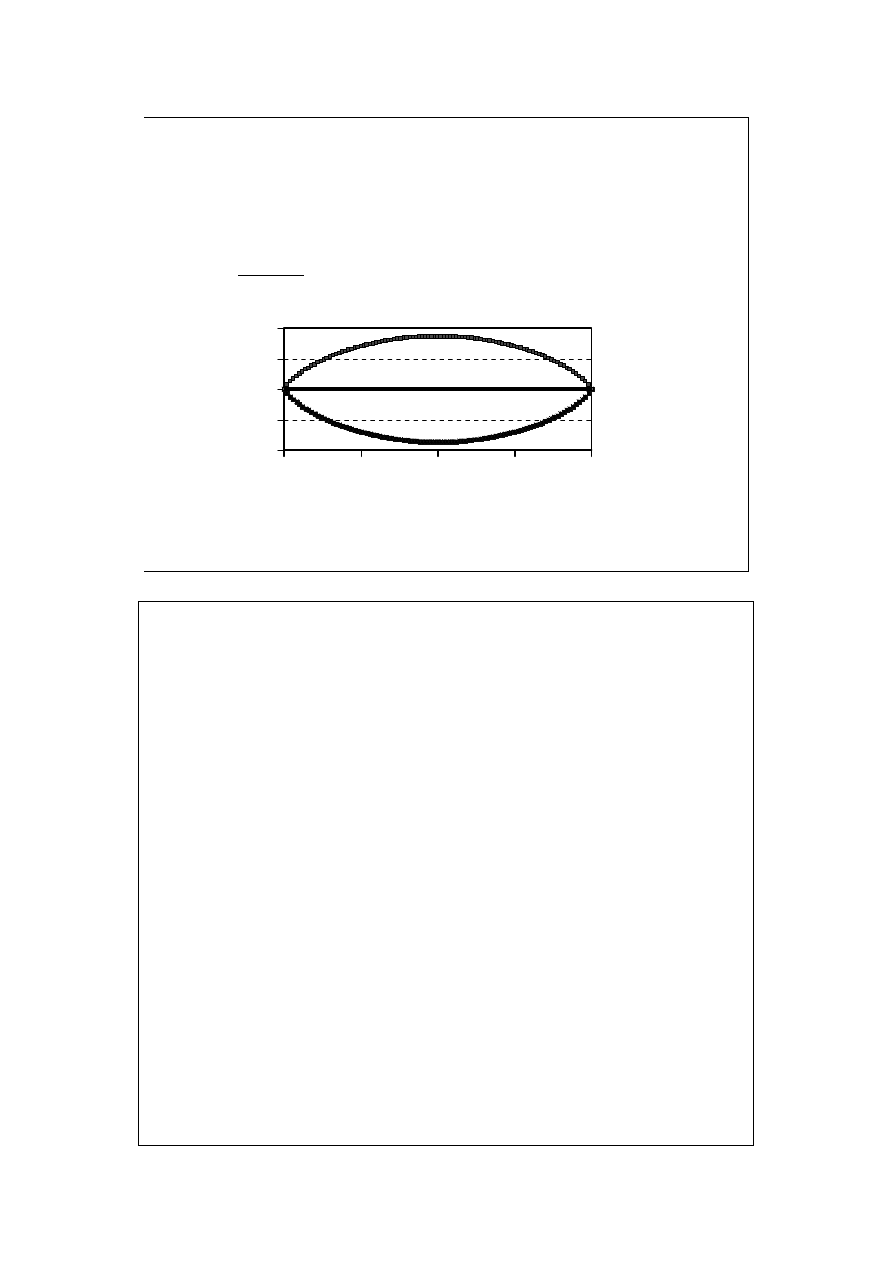
Te rm ody nam ic z ne funkc je m ie s z ania
-0,8
-0,4
0
0,4
0,8
0
0,25
0,5
0,75
1
ułamek molow y A, x
A
∆S
mie sz
/nR
∆G
mie sz
/nRT
∆H
mie sz
=
∆G
mie sz
+ T
∆S
mie s z
0
)
ln
ln
(
,
,
>
+
−
=
∆
=
∂
∆
∂
−
M
M
A
A
miesz
n
n
P
miesz
x
x
x
x
nR
S
T
G
M
A
Jak wynika ze wzoru,
∆
G
miesz
musi być ujemne, jako że ułamki molowe x<1.
Na podobnej zasadzie
∆
S
miesz
musi być dodatnie. Jeśli
∆
H
miesz
jest równe zeru, to
mieszanie jest procesem napędzanym wyłącznie entropowo. Zmiana entropii
układu wystarcza, ponieważ ciepło z otoczeniem wymieniane nie jest.

9
Chem. Fiz. TCH II/06
9
Równowaga chemiczna (4)
;
;
;
;
ξ
ν
ξ
ν
ξ
ν
ξ
ν
d
dn
d
dn
d
dn
d
dn
N
N
M
M
B
B
A
A
=
=
−
=
−
=
Przypadek ogólny. Dla reakcji:
ν
A
A +
ν
B
B + ... =
ν
M
M +
ν
N
N + ...
lub ogólnie:
ξ
ν
d
dn
Y
Y
±
=
wtedy:
ξ
ν
µ
µ
d
dn
dG
Y
Y
Y
Y
Y
Y
=
=
∑
∑
zaś:
∑
=
∂
∂
=
∆
Y
Y
Y
T
P
r
G
G
ν
µ
ξ
,
podstawiając:
Y
Y
Y
a
RT ln
0
+
=
µ
µ
otrzymamy:
Q
RT
G
G
r
r
ln
0
+
∆
=
∆
gdzie:
∑
∆
=
∆
Y
Y
tw
Y
r
G
G
0
,
0
ν
oraz:
∏
=
Y
Y
Y
a
Q
ν
Uwaga: współczynniki
ν
Y
dla substratów są ujemne.

10
Chem. Fiz. TCH II/06
10
Równowaga chemiczna (5)
Przypadek ogólny. Dla reakcji:
ν
A
A +
ν
B
B + ... =
ν
M
M +
ν
N
N + ...
zauważmy, że (uwzględniając znaki
ν
Y
):
0
,
0
,
0
,
0
,
0
,
0
B
tw
B
A
tw
A
N
tw
N
M
tw
M
Y
Y
tw
Y
r
G
G
G
G
G
G
∆
−
∆
−
∆
+
∆
=
∆
=
∆
∑
ν
ν
ν
ν
ν
zaś druga część równania:
∑
+
∆
=
∆
Y
Y
Y
r
r
a
RT
G
G
ln
0
ν
∑
∑
∑
∏
=
=
=
Y
Y
Y
Y
Y
Y
Y
Y
Y
Y
Y
Y
a
RT
a
RT
a
RT
a
RT
ν
ν
ν
ν
ln
ln
ln
ln
ponownie, uwzględniając znaki
ν
Y
:
Q
a
a
a
a
a
a
a
a
a
B
A
N
M
B
A
N
M
Y
B
A
N
M
B
A
N
M
Y
Y
=
=
=
−
−
∏
ν
ν
ν
ν
ν
ν
ν
ν
ν
Rozwinięcie pierwszej części równania jest identyczne z równaniem podawanym
na wykładzie 4, slajd Entalpia swobodna (4).
Uwaga:
Wielokrotność a logarytmu z X jest logarytmem z X
podniesionego do potęgi a (X
a
).
Suma logarytmów jest logarytmem z iloczynu
składników.
11
Chem. Fiz. TCH II/06
11
Równowaga chemiczna (6)
W stanie równowagi:
0
=
∆
r
G
0
ln
0
=
+
∆
K
RT
G
r
K
RT
G
r
ln
0
−
=
∆
(
)
R
S
RT
H
RT
S
T
H
RT
G
r
r
r
r
R
r
e
e
e
e
K
/
/
/
/
0
0
0
0
∆
∆
−
∆
−
∆
−
∆
−
=
=
=
Do ostatniego równania można także dojść
wychodząc z rozkładu Boltzmanna

12
Chem. Fiz. TCH II/06
12
Prawo działania mas
Dla reakcji:
ν
A
A +
ν
B
B + ... =
ν
M
M +
ν
N
N + ...
pozostającej w stanie równowagi, wielkość K, zwana
termodynamiczną stałą równowagi tej reakcji
jest wielkością charakterystyczną dla reakcji i stałą w danej
temperaturze.
B
A
N
M
Y
rówB
rówA
rówN
rówM
Y
rówY
rów
a
a
a
a
a
Q
K
ν
ν
ν
ν
ν
=
=
=
∏
(znane też jako prawo Guldberga – Waagego)
13
Chem. Fiz. TCH II/06
13
Równowaga chemiczna (7)
Co oznacza symbol a we wzorach:
B
A
N
M
Y
B
A
N
M
Y
Y
a
a
a
a
a
Q
ν
ν
ν
ν
ν
=
=
∏
B
A
N
M
Y
rówB
rówA
rówN
rówM
Y
rówY
rów
a
a
a
a
a
Q
K
ν
ν
ν
ν
ν
=
=
=
∏
Nadal bez formalnego jej definiowania, wielkość tę nazwiemy
aktywnością
Właściwie wszędzie powinno być a
Y
/a
0
Y
, aby iloraz reakcji i stała
równowagi były wielkościami bezwymiarowymi!
Raz jeszcze podkreślam różnicę między Q a Q
r
, czyli K.

14
Chem. Fiz. TCH II/06
14
Równowaga chemiczna (8)
Co powinniśmy wiedzieć o aktywnościach:
¾ aktywność jest „skorygowanym stężeniem” podobnie jak lotność
„skorygowanym ciśnieniem” (wyrażana w jednostkach stężenia);
¾ a
0
oznacza aktywność standardową (w stanie standardowym);
¾ aktywność standardowa (niezależnie od sposobu definiowania
stanu standardowego) wynosi 1;
¾ stanem standardowym czystych ciał stałych i cieczy jest ich ter-
modynamicznie trwała postać w danej temperaturze pod ciśnie-
niem standardowym.

15
Chem. Fiz. TCH II/06
15
Równowaga chemiczna (9)
Co powinniśmy wiedzieć o aktywnościach (c.d.):
¾ dla cieczy: a
Y
=
γ
Y
x
Y
, gdzie
γ
Y
jest współczynnikiem aktywności
reagenta Y;
¾ dla gazów za a/a
0
podstawiamy f/P
0
i także mamy do czynienia
z termodynamiczną stałą równowagi;
¾ dla gazu doskonałego za a/a
0
podstawiamy P/P
0
.
Współczynniki aktywności można różnie definiować; x
Y
oznacza ułamek
molowy.
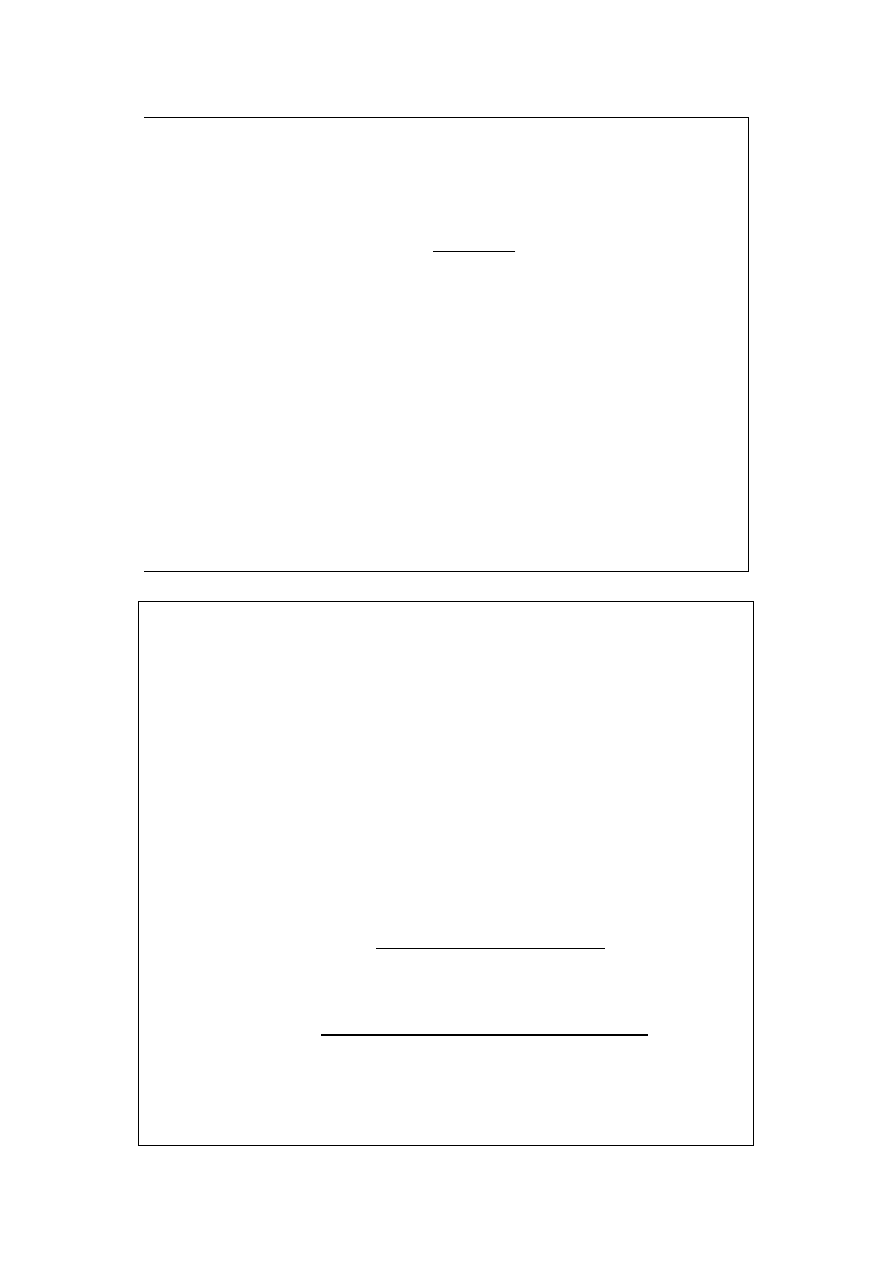
16
Chem. Fiz. TCH II/06
16
Wnioski z prawa
działania mas
.
const
a
a
a
a
a
K
B
A
N
M
Y
rówB
rówA
rówN
rówM
Y
rówY
=
=
=
∏
ν
ν
ν
ν
ν
Jeżeli zwiększymy aktywności (stężenia, lotności, ciśnienia ...)
substratów reakcji znajdującej się w równowadze, ta zacznie prze-
biegać w prawo, aby zmniejszyć licznik, zwiększyć mianownik
i zachować stałość K;
Jeżeli zwiększymy aktywności produktów reakcji znajdującej się
w równowadze, to przechylimy równowagę reakcji w lewo;
Jeżeli zmniejszymy aktywności substratów ...
Jeżeli zmniejszymy aktywności produktów ...
Wymienione wnioski wskazują co się
stanie, jeśli reakcję pozostającą w
równowadze „wybijemy” z tego stanu,
bowiem w danej temperaturze stałość K
musi być zachowana. Zajmiemy się
teraz wpływem parametrów przebiegu
reakcji, tzn. ogólnego ciśnienia i
temperatury na stan równowagi (skład
równowagowy). Przypominam, że stała
równowagi nie zależy od ciśnienia, choć
zależy od temperatury.

17
Chem. Fiz. TCH II/06
17
Reguła przekory
Le Chateliera (1)
Jeżeli układ w którym zachodzi reakcja chemiczna pozostającą
w stanie równowagi zostaje poddany działaniu czynnika
zaburzającego (P, T), to zachodzą w nim takie zmiany, jakie mogą
zminimalizować działanie tego czynnika.
Temperatura:
podwyższenie temperatury cofa (przesuwa w lewo)
równowagę reakcji egzotermicznych, zaś w prawo – reakcji
endotermicznych.
Ciśnienie:
wywiera wpływ jedynie na stan równowagi reakcji,
w których zmienia się liczba moli reagentów gazowych.
Do wniosków wypływających z reguły przekory można też dojść na drodze
ścisłej analizy prawa działania mas. Jednak jest ona cenną (i bezbłędną)
wskazówką jakościową dla przewidywania wpływu ciśnienia i temperatury, a
także doskonałym narzędziem jakościowej weryfikacji poprawności wyników
obliczonych na drodze ścisłej, które nie mogą prowadzić do wniosków
sprzecznych z tą regułą.
Katalizatory nie wywierają wpływu na stałą równowagi, a jedynie na szybkość
dochodzenia do stanu równowagi !!!
18
Chem. Fiz. TCH II/06
18
Reguła przekory
Le Chateliera (2)
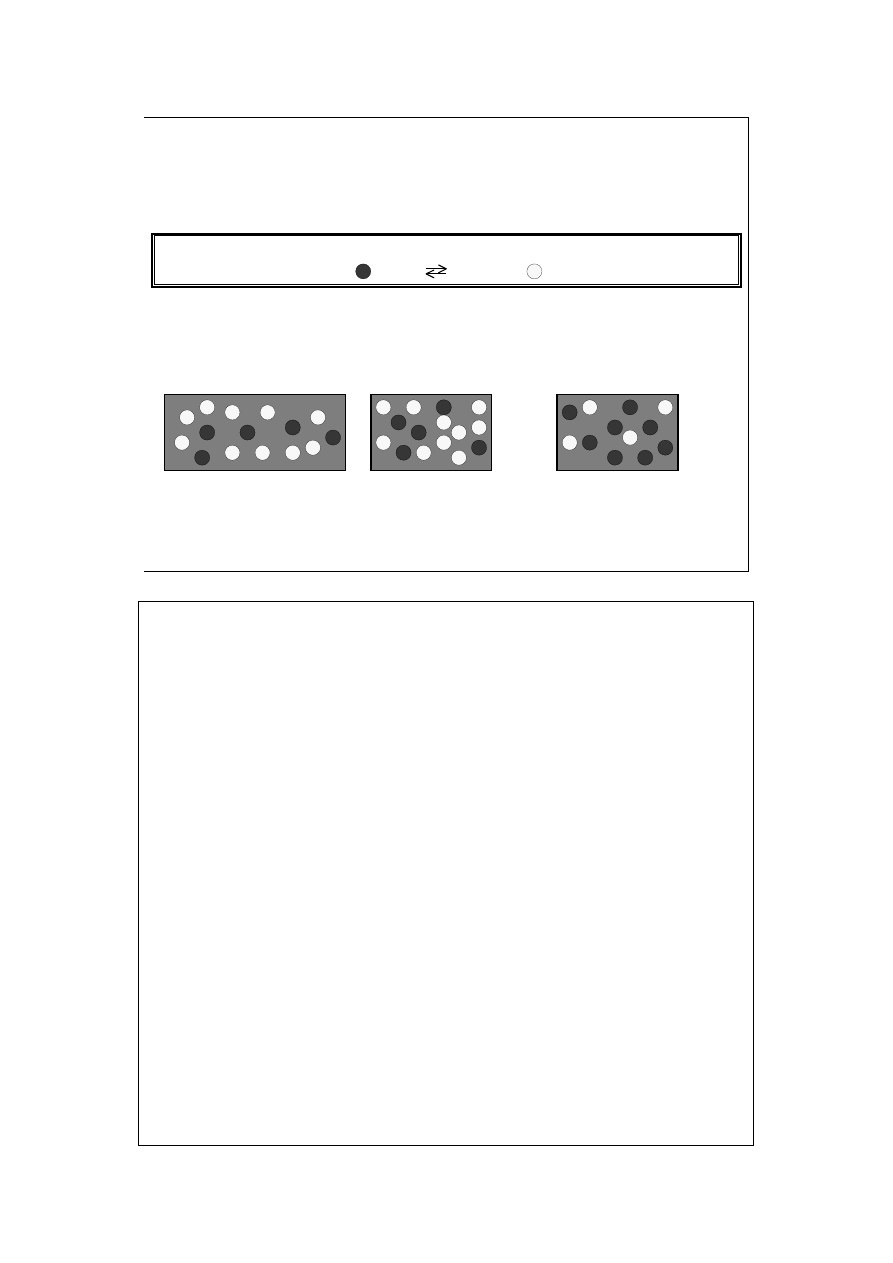
Reguła powiada: w reakcjach przebiegających ze zwiększeniem liczby
moli reagentów gazowych, wzrost ciśnienia prowadzi do przesunięcia
stanu równowagi w lewo, jego obniżenie zaś – w prawo.
Wpływ ciśnienia na reakcję dysocjacji:
A 2B
stan początkowy, P
p
zaburzenie, P
2
>P
p
odpowiedź układu,
P
2
>P
k
>P
p
Cząsteczek A powstało 2 razy mniej niż znikło cząsteczek B. W sumie liczba
cząsteczek zmalała, zatem ciśnienie także zmalało. Stan równowagi został
jednak przesunięty w lewo. Nowa równowaga faworyzuje substraty w stosunku
do poprzedniej.
19
Chem. Fiz. TCH II/06
19
Wpływ ciśnienia na
dysocjację w fazie gaz. (1)
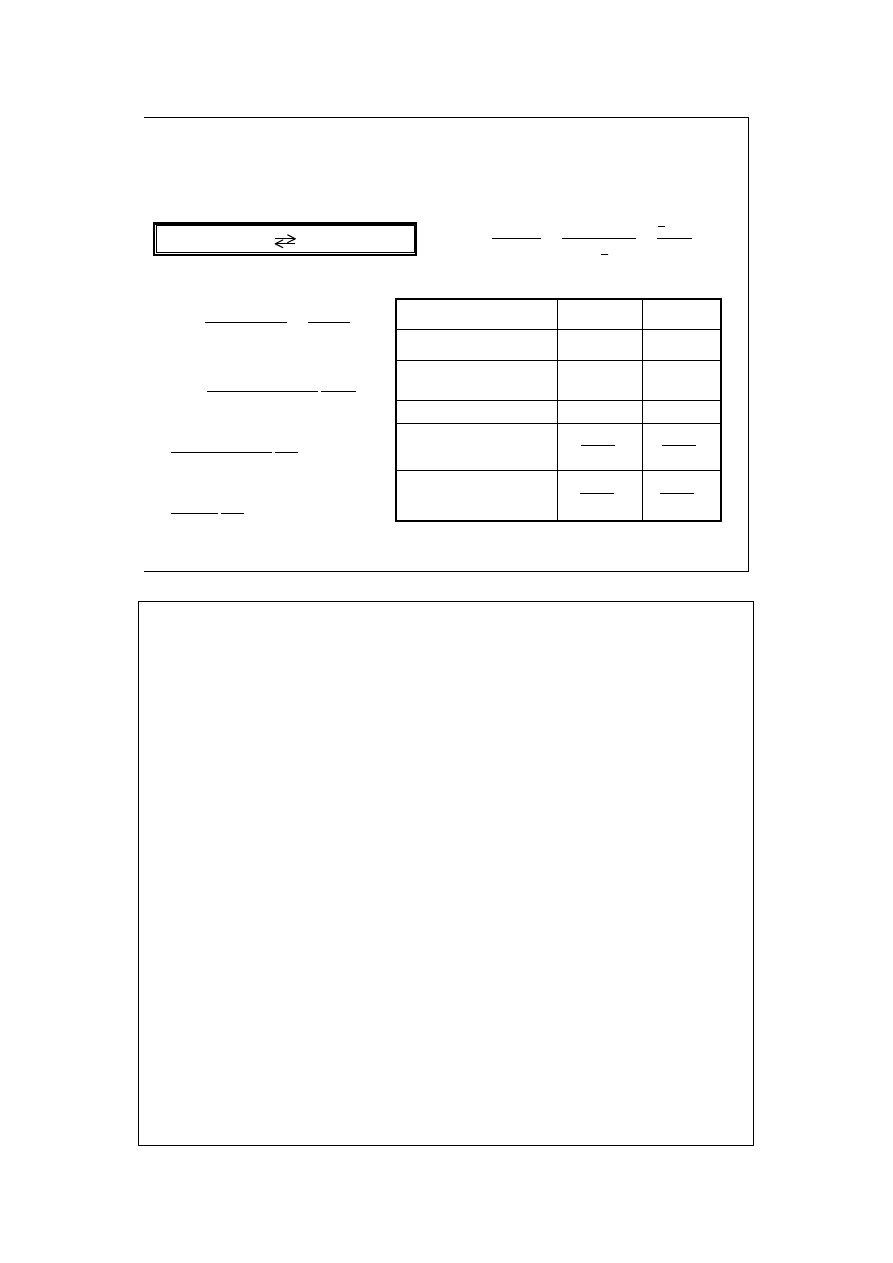
Załóżmy, że A i M są gazami doskonałymi. Wtedy:
A 2M
n
n
n
n
n
n
n
n
n
M
M
A
A
A
2
1
2
1
=
+
−
=
−
=
α
ciśnienie cząstkowe
ułamek molowy, x
w stanie równowagi
zmiana do stanu
równowagi
początkowo
2nα
n(1–α)
+2αn
–αn
0
n
M
A
0
2
0
2
0
/
)
/
(
P
P
P
P
P
P
P
K
A
M
A
M
=
=
α
α
+
−
1
1
α
α
+
1
2
P
α
α
+
−
1
1
P
α
α
+
1
2
(
)
(
) (
)
(
)(
)
0
2
2
0
2
0
2
2
2
1
4
1
1
4
1
1
1
4
P
P
P
P
PP
P
K
α
α
α
α
α
α
α
α
α
−
=
−
+
=
−
+
+
=
20
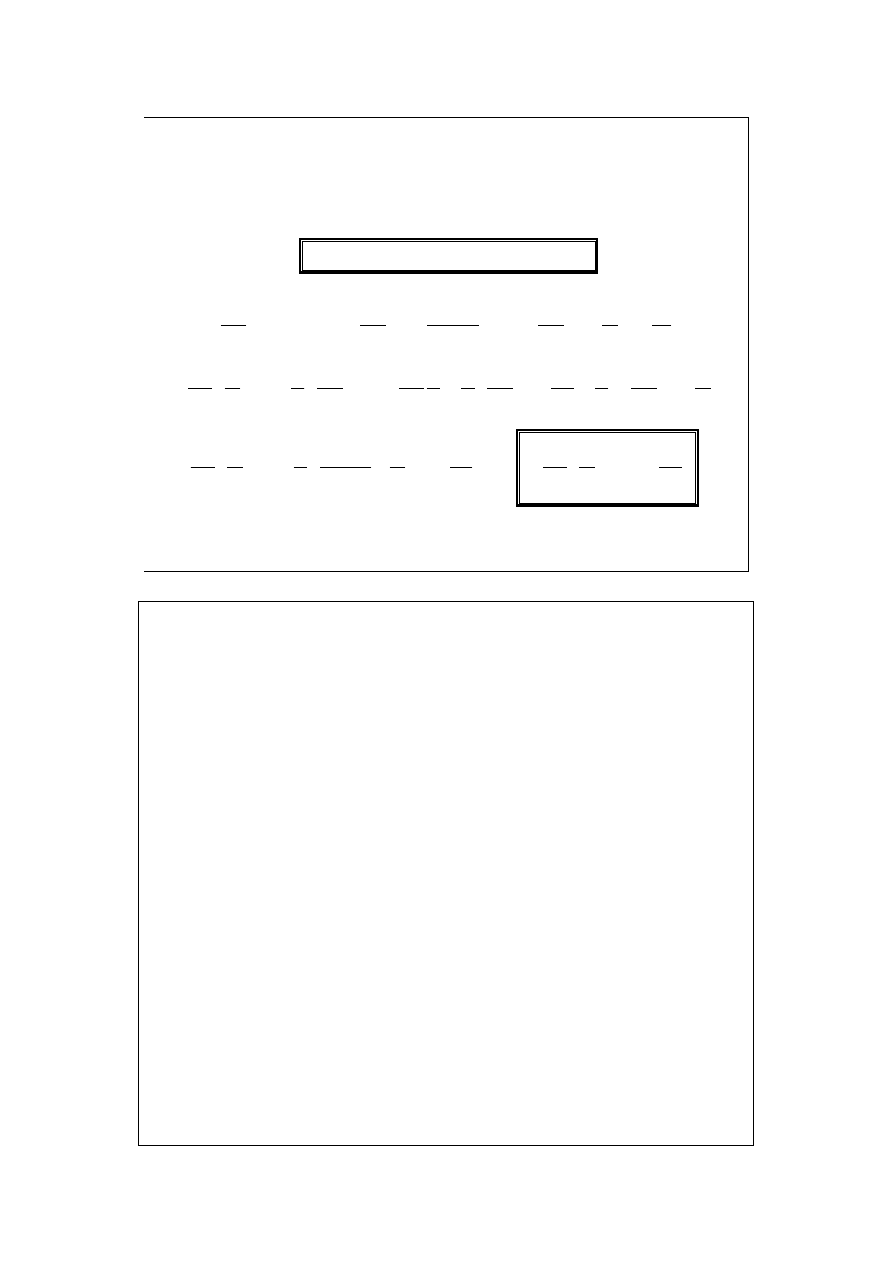
Chem. Fiz. TCH II/06
20
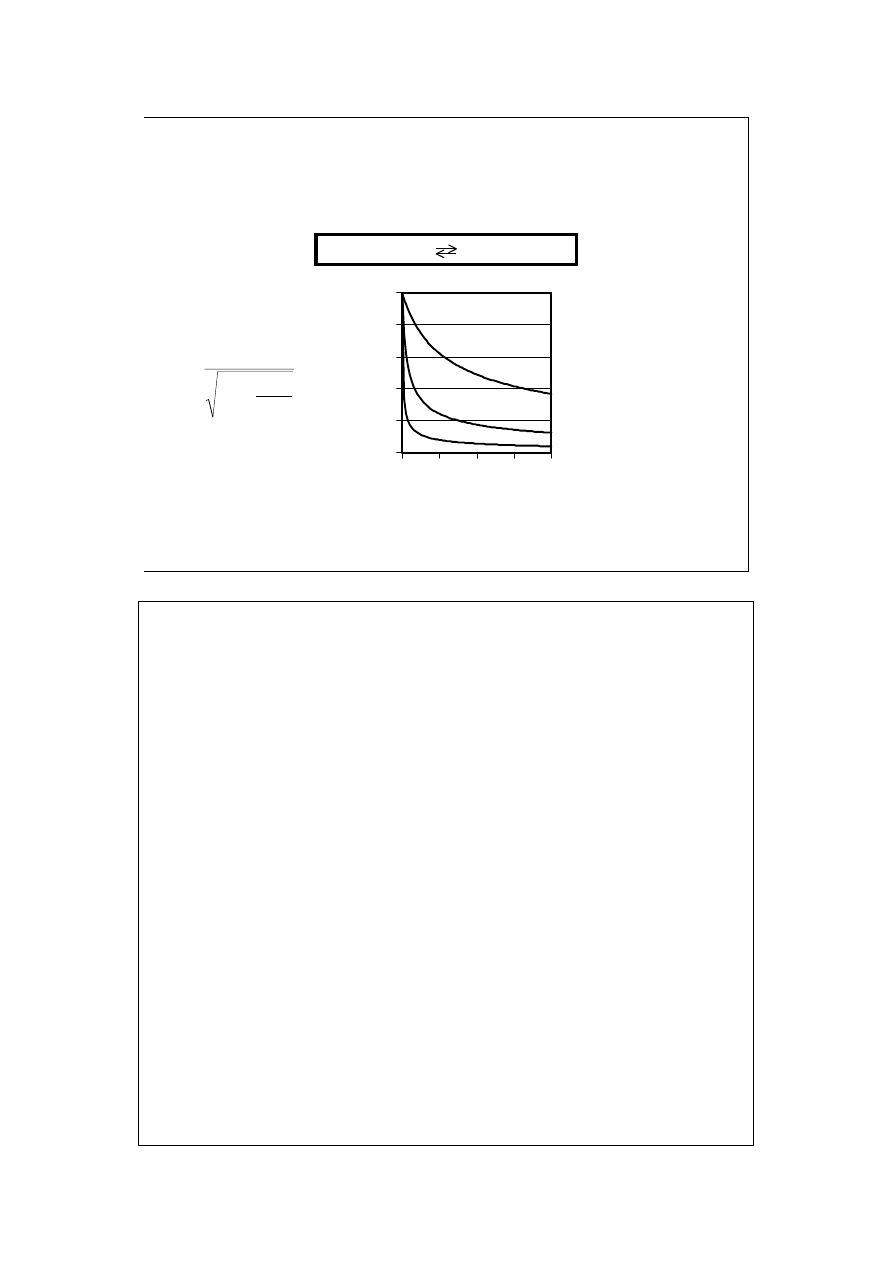
Wpływ ciśnienia na
dysocjację w fazie gaz. (2)
A 2M
0
4
1
1
KP
P
+
=
α
0
0,2
0,4
0,6
0,8
1
0
4
8
12
16
P/P
0
st
o
p
ie
ń
d
y
s
o
c
ja
c
ji
,
α
K=10
K=1
K=0,1
czyste M
czyste A
Im większe K, tym większy stopień dysocjacji. Im większe P, tym mniejszy
stopień dysocjacji.
21
Chem. Fiz. TCH II/06
21
Zależność entalpii
swobodnej od temperatury
Równanie Gibbsa – Helmholtza:
S
T
G
P
−
=
∂
∂
T
H
G
T
G
P
−
=
∂
∂
T
H
T
G
T
G
P
−
=
−
∂
∂
−
∂
∂
=
−
∂
∂
=
+
∂
∂
=
∂
∂
T
G
T
G
T
T
G
T
G
T
T
dT
d
G
T
G
T
T
G
T
P
P
P
P
1
1
1
1
2
2
1
T
H
T
G
T
H
G
T
T
G
T
P
−
=
−
−
=
∂
∂
2
T
H
T
G
T
P
−
=
∂
∂
Równanie G – H (ułatwia zapamiętanie).
22
Chem. Fiz. TCH II/06
22
Wpływ temperatury na
stałą równowagi (1)
Równanie van’t Hoffa:
Jacobus
Henricus
van’t Hoff
RT
G
K
r
0
ln
∆
−
=
(
)
dT
T
G
d
R
dT
K
d
r
/
1
ln
0
∆
−
=
różniczkując
względem T
otrzymujemy:
a używając równania G – H:
(
)
2
0
0
/
T
H
dT
T
G
d
r
r
∆
−
=
∆
otrzymujemy:
2
0
ln
RT
H
dT
K
d
r
∆
=
a ponieważ:
otrzymujemy
równoważnie:
2
1
)
/
1
(
T
dT
T
d
−
=
R
H
T
d
K
d
r
0
)
/
1
(
ln
∆
−
=
Van’t Hoff otrzymał jako pierwszy nagrodę Nobla z chemii w 1901.
Różniczkując pierwsze równanie względem T używamy zwykłych pochodnych,
tak
∆
G
0
r
jak i K zależą tylko od temperatury, a nie zależą od ciśnienia.

23
Chem. Fiz. TCH II/06
23
Wpływ temperatury na
stałą równowagi (2)
Równanie van’t Hoffa
(scałkowane):
2
0
ln
RT
H
dT
K
d
r
∆
=
dT
RT
H
K
d
r
2
0
ln
∆
=
∫
∫
∆
=
2
1
2
1
2
0
ln
T
T
r
T
T
dT
RT
H
K
d
−
∆
−
=
∆
=
=
−
∫
2
1
2
2
0
2
0
1
2
1
2
1
1
1
ln
ln
ln
2
1
T
T
R
H
dT
T
R
H
K
K
K
K
r
T
T
r
Identyczne wyrażenie otrzymamy wychodząc z drugiej
postaci równania van’t Hoffa
24
Chem. Fiz. TCH II/06
24
Zależności pomiędzy
stałymi równowagi (1)
Stałymi równowagi w pełnym znaczeniu są jedynie termodynamiczne
stałe równowagi, zdefiniowane jako:
oznacza
gdzie
;
0
a
a
a
a
K
Y
rówY
Y
∏
=
ν
oznacza
gdzie
;
0
P
f
f
f
K
Y
rówY
Y
∏
=
ν
Stosowane także i często nazywane stałymi równowagi wyrażenia:
oznacza
gdzie
;
0
c
c
c
c
K
Y
rówY
c
Y
∏
=
ν
oznacza
gdzie
;
0
P
P
P
P
K
Y
rówY
P
Y
∏
=
ν
Są jedynie przybliżeniami (poza K
P
dla gazu doskonałego samemu
jednak będącego tylko przybliżonym modelem) i raczej powinny być
nazywane równowagowymi ilorazami stężeń, ciśnień, itp.)
25
Chem. Fiz. TCH II/06
25
Zależności pomiędzy
stałymi równowagi (2)
Uwzględniając a
Y
=
γ
Y
x
Y
(stężenia wyraźmy jako ułamki molowe):
(
)
(
) (
)
∏
∏
∏
=
=
=
Y
x
rówY
Y
rówY
Y
rówY
rówY
K
K
x
x
K
Y
Y
Y
Y
γ
ν
ν
ν
ν
γ
γ
gdzie K
x
i K
γ
są odpowiednimi ilorazami równowagowymi.
Dla substancji gazowych zapisać można:
(
)
(
) ( )
∏
∏
∏
=
=
=
Y
P
rówY
Y
rówY
Y
rówY
rówY
K
K
P
P
K
Y
Y
Y
Y
φ
ν
ν
ν
ν
φ
φ
a także:
0
lim
→
=
P
P
K
K
co oznacza:
1
lim
0
=
→
P
K
φ
Symbolem
φ
oznaczamy współczynnik lotności, patrz slajd Entalpia swobodna a
lotność gazów (2) w wykładzie 5.
Zakładanie że K
φ
, a zwłaszcza K
γ
=1 jest uproszczeniem i nie odzwierciedla
dokładnie termodynamiki danej reakcji.

26
Chem. Fiz. TCH II/06
26
Zależności pomiędzy
stałymi równowagi (3)
Dla reakcji w fazie gazowej istnieją dalsze możliwości wyrażania K
P
:
ν
∆
⋅
=
0
P
RT
K
K
c
P
bowiem:
cRT
V
nRT
P
=
=
gdzie c jest w
mol/m
3
3
0
0
mol/m
0224
,
0
1
1 ≅
=
m
V
c
B
A
N
M
Y
Y
ν
ν
ν
ν
ν
ν
−
−
+
=
=
∆
∑
∆
ν
dotyczy wyłącznie reagentów gazowych
Podobnie, jeśli uwzględnimy prawo Daltona:
ν
∆
⋅
=
0
P
P
K
K
x
P
ν
∆
⋅
=
∑
Y
Y
n
P
n
P
P
K
K
0
gdzie: P oznacza całkowite
ciśnienie równowagowe
∏
=
Y
Y
n
Y
n
K
ν
n
Y
to liczby moli gazów
w stanie równowagi

27
Chem. Fiz. TCH II/06
27
Szczególne przypadki
stałych równowagi (1)
Iloczyn jonowy wody:
K
298
temp.
w
10
14
3
−
=
=
−
+
OH
O
H
w
a
a
K
Stałe kwasowości K
a
i zasadowości K
b
:
(aq)
A
(aq)
O
H
O(c)
H
HA(aq)
3
2
−
+
+
=
+
(aq)
OH
HA(aq)
O(c)
H
(aq)
A
2
−
−
+
=
+
(dla sprzężonej pary kwas-zasada)
HA
O
H
A
a
a
a
a
K
+
−
=
3
−
−
=
A
OH
HA
b
a
a
a
K
w
b
a
K
K
K
=
⋅
Pojęcie pK: pK = –log K
K
298
temp.
w
14
=
=
+
w
b
a
pK
pK
pK
(aq)
OH
(aq)
O
H
O(c)
2H
3
2
−
+
+
=
Iloczyn jonowy wody zwany jest także stałą autodysocjacji lub autoprotolizy
wody.
Oczywiście dotyczy to układów kwasowo zasadowych w roztworach wodnych
(definicja kwasów i zasad wg Brønsteda).
28
Chem. Fiz. TCH II/06
28
Szczególne przypadki
stałych równowagi (2)
Iloczyn rozpuszczalności:
(aq)
yA
(aq)
xM
(s)
A
M
x
y
y
x
−
+
+
=
y
A
x
M
sp
a
a
K
⋅
=
Związek z rozpuszczalnością s wyrażoną w mol/dm
3
:
y
x
y
x
sp
s
y
x
K
+
⋅
⋅
=

29
Chem. Fiz. TCH II/06
29
Szczególne przypadki
stałych równowagi (3)
Stałe tworzenia oraz trwałości (nietrwałości) kompleksów:
O
H
L
O)
M(H
L
M
2
1
n
2
+
=
+
−
O
H
L
O)
M(H
L
L
O)
M(H
2
2
2
n
2
1
n
2
+
=
+
−
−
O
H
ML
L
O)L
M(H
2
n
1
n
2
+
=
+
−
Stałe tworzenia (dla kolejnych reakcji):
[
]
[
] [ ]
L
O)
M(H
L
O)
M(H
n
2
1
n
2
1
⋅
=
−
K
[
]
[
] [ ]
L
O)
M(H
L
O)
M(H
1
n
2
2
2
n
2
2
⋅
=
−
−
K
[
]
[
] [ ]
L
O)L
M(H
ML
1
n
2
n
⋅
=
−
n
K
Zazwyczaj: K
1
< K
2
< ... < K
n

30
Chem. Fiz. TCH II/06
30
Szczególne przypadki
stałych równowagi (4)
Stałe tworzenia oraz trwałości (nietrwałości) kompleksów:
O
H
L
O)
M(H
L
M
2
1
n
2
+
=
+
−
O
H
L
O)
M(H
L
L
O)
M(H
2
2
2
n
2
1
n
2
+
=
+
−
−
O
H
ML
L
O)L
M(H
2
n
1
n
2
+
=
+
−
Stałe trwałości (łączne dla wszystkich reakcji do danego stopnia):
1
1
K
=
β
[
]
[
] [ ]
2
1
2
n
2
2
2
n
2
2
L
O)
M(H
L
O)
M(H
K
K
=
⋅
=
−
β
[
]
[
] [ ]
n
n
K
K
K
...
L
O)
M(H
ML
2
1
n
n
2
n
=
⋅
=
β
Można się także spotkać z pojęciem stałych nietrwałości, które są
odwrotnościami stałych
β
. Ogólnie panuje dość duże zamieszanie
terminologiczne
31
Chem. Fiz. TCH II/06
31
Prężność rozkładowa (1)
Prężnością rozkładową (lub ciśnieniem rozkładowym) nazywamy
prężność cząstkową gazowego produktu rozkładu danej substancji
znajdującego się w równowadze z tą substancją.
Jeżeli w danej temperaturze ciśnienie parcjalne produktu
rozkładu jest wyższe od ciśnienia rozkładowego, reakcja
rozkładu nie zachodzi (lub się cofa), jeśli niższe – zachodzi.
Przykład:
Jakie ciśnienie powstanie i jaki ułamek substancji stałej
się rozłoży, jeśli do sztywnego zbiornika o pojemności 2 dm
3
włoży-
my 20 g czystej kredy (CaCO
3
), ewakuujemy go i ogrzejemy do tem-
peratury 800
o
C?
32
Chem. Fiz. TCH II/06
32
Prężność rozkładowa (2)
Rozwiązanie:
1. Z danych termodynamicznych dla produktów i substratu reakcji
znajduję
∆
G
0
298
=130051 J, co daje K
298
=1,6452·10
-23
. Jak widać,
w temperaturze otoczenia CaCO
3
jest trwały termodynamicznie.
2. Obliczam (przy zmiennym
∆
C
P
) wartość
∆
H
0
1073
(169000 J), co
w porównaniu z
∆
H
0
298
(177886 J) nie jest zbyt dużą różnicą.
Zakładam stałe
∆
H
0
=173500 J.
3. Z równania van’t Hoffa obliczam K
1073
= K
298
·e
50,54706
=0,1474
4. Dla reakcji CaCO
3
(s) = CaO(s) + CO
2
(g), K
P
=P
CO2
/P
0
. Daje to
P
CO2
=14933Pa, oraz 3,35·10
-3
mola CO
2
.
5. Rozłożyła się taka sama liczba moli CaCO
3
, co stanowi 1,67%
jego początkowej ilości (0,2 mola).
6. Uwaga! Dokładne obliczenie
∆
G
0
1073
daje K
1073
=0,3282,
ciśnienie P
CO2
=33245 Pa i 3,73% rozkładu CaCO
3
.
33
Chem. Fiz. TCH II/06
33
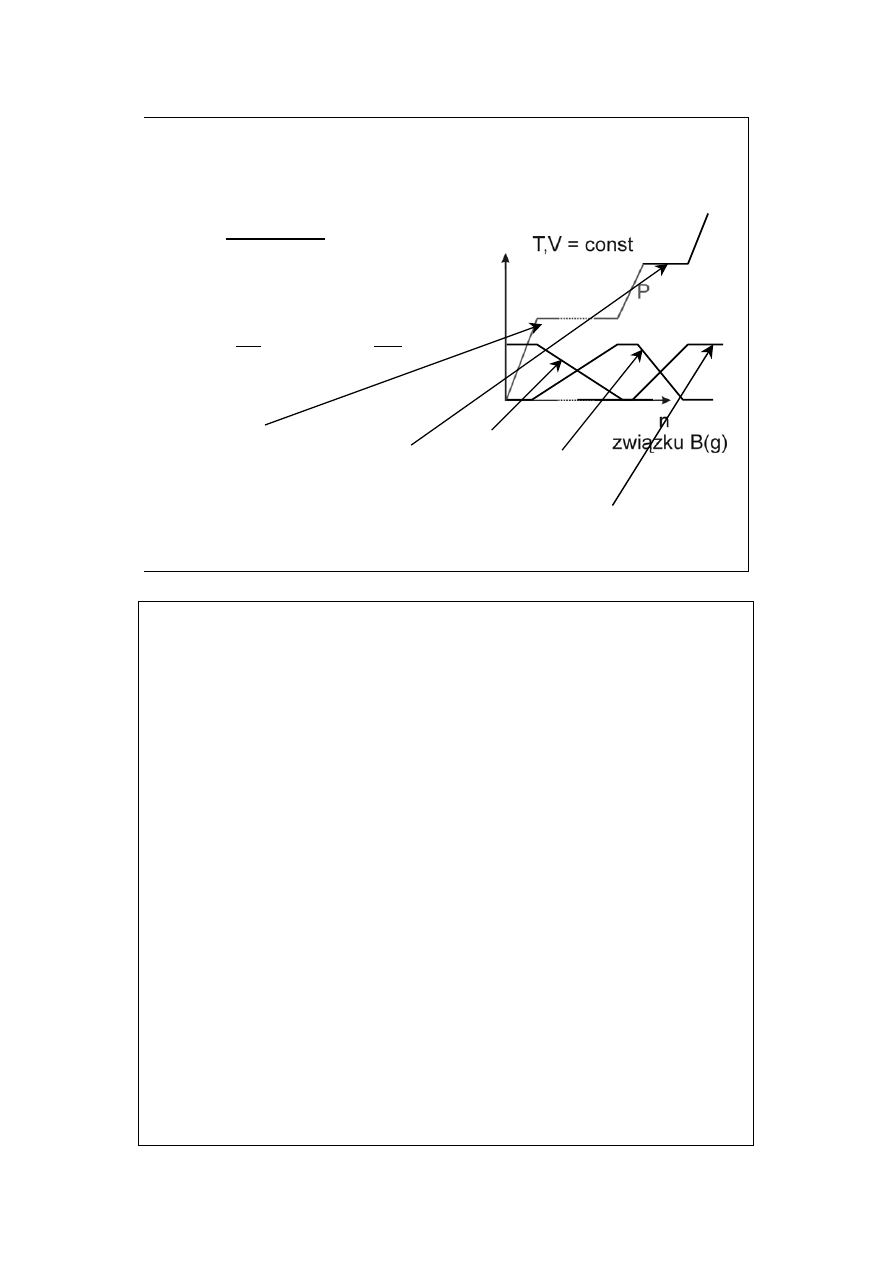
Prężność rozkładowa (3)
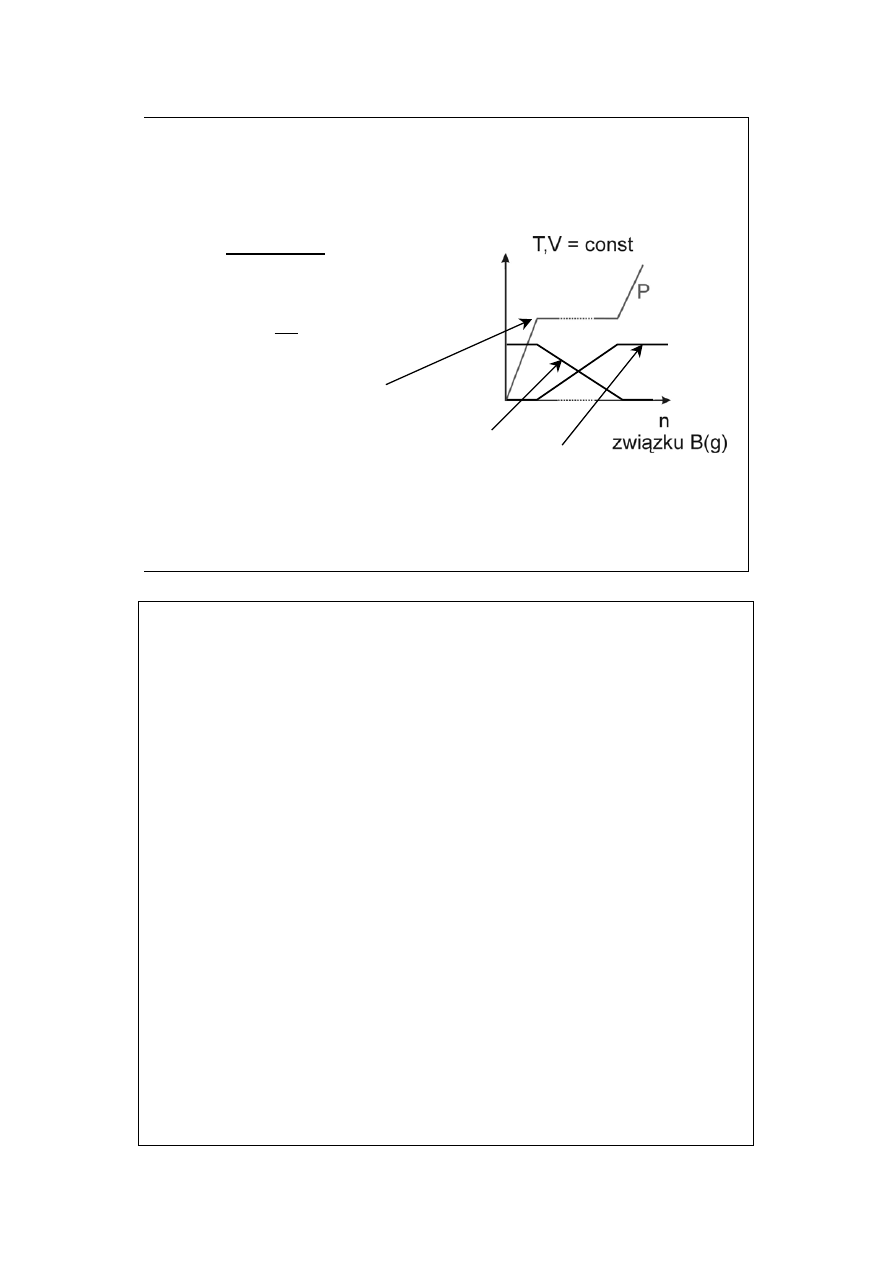
Dla reakcji:
A(s) + B(g) = AB(s), dla której
1
0
−
=
P
P
K
B
P
gdzie: P
B
jest prężnością
rozkładową związku AB
n
A
n
AB
34
Chem. Fiz. TCH II/06
34
Prężność rozkładowa (4)
Dla reakcji:
A(s) + B(g) = AB(s)
AB(s) + B(g) = AB
2
(s)
1
0
1
1
−
=
P
P
K
B
P
gdzie: P
B1
jest prężnością
rozkładową związku AB, zaś P
B2
–
związku AB
2
n
A
n
AB
1
0
2
2
−
=
P
P
K
B
P
n
AB
2
Wyszukiwarka
Podobne podstrony:
chf tch I wykl 010Ac
chf tch I wykl 004c
chf tch I wykl 010a
chf tch I wykl 007c
chf tch I wykl 001c
chf tch I wykl 012c
chf tch I wykl 001c
chf tch I wykl 005b
chf tch I wykl 004b
chf tch I wykl 006b
chf tch I wykl 008c
chf tch I wykl 009c
chf tch I wykl 003c
chf tch I wykl 002c
chf tch I wykl 005c
chf tch I wykl 010c
chf tch I wykl 011c
chf tch I wykl 010Ac
więcej podobnych podstron