CHEMIA KLINICZNA 14 PAŹDZIERNIKA 2010
Gospodarka mineralna ustroju cz. II
Metody oznaczania i znaczenie diagnostyczne:
Wapnia
Fosforu nieorganicznego
Magnezu
WAPŃ
Zawartość wapnia w ustroju:
Zawartość wapnia w ustroju człowieka wynosi ok. 25-50 g/kg beztłuszczowej m.c.
Prawie cały wapń znajduje się w przestrzeni pozakomórkowej:
99,85% w kościach
0,05% w płynie pozakomórkowym
Płyn śródkomórkowy zawiera zaledwie 0,01% ogólnoustrojowego wapnia
Tylko 1% wapnia odkładanego w kościach jest szybko wymienialny, ta frakcja wapnia kośćca
tworzy z wapniem płynu pozakomórkowego tzw. szybko wymienialną pulę wapniową.![]()
Regulacja kalcemii :
W stanach fizjologicznych kalcemia jest wypadkową interakcji 3 procesów:
Wchłaniania wapnia z przewodu pokarmowego
Wydalania wapnia z moczem
Odkładania lub uruchomienia wapnia w kośćcu
Czynnik |
Kości |
Nerki |
Jelito |
PTH |
|
|
|
Witamina D3 |
|
|
|
Kalcytonina |
|
|
Nie wpływa na wchłanianie |
Wapń występuje w surowicy w 3 postaciach:
wapń zjonizowany (stanowiący 40-50%, średnio 45% ogólnego stężenia wapnia)
związany z substancjami drobnocząsteczkowymi (skompleksowany),
np. z cytrynianami, fosforanami, siarczanami itp., przesączalny przez błony dializacyjne (stanowi średnio 14%)
wapń związany z białkami (stanowi 35-45%, średnio 41% ogólnego stężenia wapnia w surowicy)
Wapń występuje w surowicy w 2 frakcjach:
I. Frakcja przesączalna
Wapń zjonizowany (45%)
Wapń skompleksowany (14%)
II. Frakcja nieprzesączalna
Wapń związany z białkami (41%)
Stężenie wapnia całkowitego w surowicy krwi:
2,25-2,75 mmol/l (9-11 mg/dl)
Stężęnie wapnia zjonizowanego w surowicy krwi:
0,95-1,3 mmol/l (3,8-5,2 mg/dl)
Stężenie wapnia zależy od:
Wieku
Płci
Pory roku
Czynniki wpływające na stężenie wapnia w surowicy krwi:
1.Stężenie białek w surowicy
Wielkość kalcemii należy skorygować o wartość wynikającą z nieprawidłowej proteinemii (im wyższe stężenie białka, gł. albuminy, tym wyższe stężenie wapnia całkowitego)
Obecnie preferuje się oznaczanie stężęnia wapnia zjonizowanego ( łatwe i tanie)
![]()
stężenia albuminy ![]()
![]()
stężenia Ca2+
Ca2+ skorygowane =Ca2+ oznaczone + 0,02 x (40-albumina oznaczona)
mmol/l mmol/l g/l
Stężenie sodu w surowicy
Im stężenie sodu niższe, tym stężenie wapnia wyższe
Hiponatremia poniżej 120 mmol/l wywołuje wzrost wapnia związanego z białkami (mierna hiperkalcemia)
![]()
Stężenia Na+ ![]()
![]()
stężenia Ca2+
3. pH krwi
im wyższe pH tym niższe stężenie wapnia zjonizowanego
![]()
pH ![]()
![]()
stężenia Ca2+
Ca2+=0.45 x Ca całkowity
Ca2+ skorygowany= Ca2+ + 0,5x (7,40-pH aktualne)
mmol/l mmol/l
Hiperkalcemia
Stężenie wapnia całkowitego >2,75 mmol/l ( > 11 mg/ dl)
wapnia zjonizowanego > 1,3 mmol/l ( 5,2 mg/dl)
Przyczyny hiperkalcemiii:
nadmierne uruchomienie wapnia z kości:
nowotwory
pierwotna nadczynność gruczołów przytarczycznych
unieruchomienie chorego
upośledzone wydalanie wapnia z moczem
diuretyki tiazydowe
wzmożone wchłanianie wpania z przewodu pokarmowego:
przedawkowanie witaminy D lub A
ziarniniaki wytwarzające 1,25(OH)2D3
niedobór glikokortykosteroidów
współdziałanie wymienionych czynników etiologicznych
Wzrost stężenia wapnia u chorych z nowotworami może być uwarunkowany:
wydzielaniem przez tkankę nowotworową:
PTH lub substancji PTH-podobnych
Prostaglandyn PGE2
Cytokin, określanych jako czynnik aktywujących osteoklasty (Il-1, Il -6, TNF-alfa, TNF-beta)
Transformującego czynnika wzrostu ( TGF-
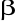
)niszczeniem struktury kostnej przez pierwotne nowotwory kości
niszczeniem struktury kostnej przez przerzuty nowotworów o innej lokalizacji narządowej do kości
Przełom hiperkalcemiczny Ca>4,0-4,25 mmol/l (>16-17 mg/dl)
Zespół objawów chorobowych charakteryzujący się:
znacznym odwodnieniem ustroju uwarunkowanym wymiotami i wielomoczem
zapaścią
obrzękiem płuc
zaburzeniami orientacji, sennością i śpiączką
Hipokalcemia
Stężenie wapnia całkowitego w surowicy krwi < 2,25 mmol/l ( < 9mg/dl)
Wapnia zjonizowanego < 0,95 mmol/l (3,8 mg/dl)
Przyczyny:
upośledzenie biosyntezy PTH (niedoczynność przytarczyc) lub upośledzenie receptora dla PTH
zaburzenia gospodarki witaminą D
niedobór witaminy D
upośledzenie 25-hydroksulacji i/lub 1-hydroksylacji witaminy D w wątrobie lub nerkach
defekt receptora dla 1,25(OH)2D3
pierwotne zaburzenia gospodarki wapniowej
Hiperfosfatemia
zaburzenia gospodarki magnezowej
leki
FOSFOR
Przemiana fosforu
Zawartość fosforu w ustroju wynosi 11-14 g/kg m.c.
Rozmieszczenie fosforu
86% fosforu ogólnoustrojowego znajduje się w przestrzeni pozakomórkowej:
-85% w kościach
-1% w płynie pozakomórkowym
14% - w płynie śródkomórkowym
W surowicy krwi występują fosforany nieorganiczne oraz ich estry (fosfolipidy)
Stężenie fosforanów nieorganicznych w surowicy wynosi 0,9-1,6 mmol/l, u dzieci nieco większe (do 1,9 mmol/l) oraz nieco większe u kobiet niż mężczyzn.
Czynnik |
Kości |
Nerki |
Jelito |
PTH |
|
|
|
Witamina D3 |
|
|
|
Kalcytonina |
|
|
Nie wpływa na wchłanianie |
Przyczyny hipofosfatemii
Przyczyny niedoboru fosforanów
1.Niedostateczna podaż
2.Niedostateczne wchłanianie z przewodu pokarmowego
3.Nadmierna utrata przez nerki
4. Nadmierne przemieszczenie do komórek albo do układu kostnego
5.Współdziałanie w/w czynników
Przyczyny hiperfosfatemii
1.Wzmożone wchłanianie z przewodu pokarmowego
2.Zmniejszone wydalanie z moczem
3.Nadmierne uwalnianie się fosforanów z rozpadających się tkanek ( np podczas chemioterapii, w wyniku urazów czy oparzeniach)
4.Inne przyczyny
MAGNEZ
Zawartość w ustroju:
Organizm dorosłego człowieka zawiera ok. 24 g magnezu :
Połowa tej ilości znajduje się w kościach
1% w płynie pozakomórkowym
50% w tkankach miękkich, głównie śródkomórkowo
Tylko około 16% ustrojowego magnezu jest wymienialne
Magnez w osoczu występuje w postaci:
Nieprzesączalnej - związanej z albuminami (20-30%)
Przesączalnej :
Głównie zjonizowanej (70%)
Oraz związanej z kompleksami (5%)
Prawidłowe stężenie magnezu w surowicy wynosi 0,8-1,2 mmol/l (średnio 1,0)
Magnezu zjonizowanego 0,6-0,8 mmol/l (70%)
Nerki odgrywają najważniejszą rolę w utrzymanie względnie stałego stężenia magnezu we krwi.
W warunkach ograniczonej podaży magnezu w pokarmach nerki wykazują dużą zdolność zachowywania (oszczędzania) tego pierwiastka.
Magnezemia
Stężenie magnezu nie zawsze jest zmniejszone w stanach niedoboru magnezu (dlatego magnezemia nie może być ścisłym miernikiem bilansu magnezowego)
Uważa się, że lepszym wskaźnikiem niedoboru magnezu w ustroju niż jego stężenie we krwi jest:
Wydalanie tego pierwiastka z moczem po podaniu dożylnym lub
Zawartość magnezu w krwinkach czerwonych lub leukocytach
Czynnik |
Kości |
Nerki |
Jelito |
PTH |
|
|
|
Witamina D3 |
|
|
|
Kalcytonina |
|
|
Nie wpływa na wchłanianie |
Przyczyny hipomagnezemii:
1.Niedostateczna podaż Mg w pokarmach
przewlekły alkoholizm
Długotrwałe żywienie pozajelitowe
Dług energetyczny i białkowy
2.Niedostateczne wchłanianie Mg z przewodu pokarmowego
Zespół wadliwego wchłaniania
Rozległa resekcja jelita cienkiego
3.Nadmierna utrata Mg z wydzielinami i wydalinami
Długotrwałe odsysanie treści żołądkowej
Przewlekle stosowane środki przeczyszczające
4.Nadmierna utrata Mg przez nerki
Stosowanie leków moczopędnych
Pierwotny hiperaldosteronizm
5.Przemieszczenie magnezu do kości (po usunięciu gruczolaka gruczołów przytarczycznych ) lub do komórek ( np. u chorych na cukrzycę)
Hipermagnezemia:
1. Niedostateczne wydalanie Mg przez nerki (niewydolność nerek w fazie skąpomoczu lub bezmoczu)
2. Nadmierna podaż soli magnezu
3. Nadmierne wchłanianie Mg z przewodu pokarmowego
4. Znaczne odwodnienie organizmu
Proces przebudowy tkanki kostnej- obrót kostny (bone turnover, remodelling)
Kościotworzenie resorpcja kości
Czynniki mające wpływ na obrót kostny:
PTH
Witamina D
Kalcytonina
Hormon wzrostu
Hormony płciowe
Czynniki wzrostowe
Cytokiny
Składniki macierzy kostnej
Tkanka kostna struktura dwufazowa:
Organiczna macierz kostna
Kryształy hydroksyapatytu (składnik nieorganiczny)
W kości występują 3 rodzaje komórek:
Osteocyty
Osteoklasty
Osteoblasty
Za metabolizm kostny odpowiadają osteoklasty i osteoblasty.
Osteocyty - powstają z osteoblastów , jednojądrzaste z wypustkami
Osteoblasty- komórki kościotwórcze, jednojądrzaste, występujące na powierzchni
Osteoklasty- komórki wielojądrzaste, odpowiedzialne za proces resorpcji
Osteoklasty ( kom. kościogubne) - rola:
Resorpcja tkanki kostnej z wytworzeniem zatok erozyjnych- miejsca ubytku w strukturze tkanki kotnej
Produkcja i wydzielanie m.in. winianoopornej kwaśnej fosfatazy, kolagenaz, proteinaz cysteinowych
Osteoblasty ( kom. Kościotwórcze) - rola:
Synteza białek macierzy kostnej
Wyściełanie osteoidem nowopowstałych zagłębień macierzy kostnej (zatok)
Produkcja fosfatazy alkalicznej, osteokalcyny, kolagenu typu I i in.
Proces przebudowy wewnętrznej odbywa się w ściśle określonych miejscach szkieletu, zwanych jednostkami przebudowy kości (BRU- bone remodelling unit).
Histologicznie jednostkę przebudowy w kości zbitej stanowi osteon, zaś w kości gąbczastej zatoka erozyjna (zatoka Howshipa).
Cykl przebudowy tkanki kostnej
Składa się z następujących po sobie dwóch przeciwstawnych procesów
Resorpcji
Tworzenia
Po których następuje okres przejściowego spoczynku
W stanie równowagi ilość resorbowanej i tworzonej kości są równe.
RESORPCJA - trwa krótko (kilka-kilkanaście dni) i markery resorpcji są intensywnie uwalniane w stosunkowo dużych ilościach.
TWORZENIE - trwa długo (kilkanaście tygodni) i markery tworzenia uwalniane są w małych ilościach
Składniki organicznej macierzy kostnej:
Kolagen typu I stanowi 90% organicznej macierzy kostnej,
pozostałe 10% stanowią:
Proteoglikany
Cząsteczki adhezyjne (integryny)
białka
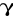
karboksylowaneczynniki wzrostowe
osteonektyna
SYNTEZA KOLAGENU TYPY I
Kolagen typu I syntetyzowany jest przez aktywne osteoblasty w następujących etapach:
preprokolagen
prokolagen
tropokolagen
reaktywne aldehydy wiążące poprzecznie (sieciujące)
pochodne 3-hydroksy-pirydyniowe pirydynoliny i deoksypirydynoliny
dojrzały kolagen
Preprokolagen ma strukturę potrójnej helisy, w której 3 łańcuchy polipeptydowe (2 alfa1 i 1 alfa2) tworzą prawoskrętny superheliks. W łańcuchach alfa znamiennie częściej niż w innych białkach występują glicyna, lizyna, prolina i ich hydroksylowane pochodne: hydroksyprolina i hydroksylizyna.
Preprokolagen- budowa:
krótka sekwencja sygnałowa
N-końcowy propeptyd prokolagenu typu I (PINP)
C-końcowy propeptyd prokolagenu typu I (PICP)
Preprokolagen po odcięciu fragmentu sygnałowego jest w postaci prokolagenu uwalniany z komórki. W przestrzeni pozakomórkowej peptydy wydłużające są usuwane z N- i C-końców przez zewnątrzkomórkowe enzymy (amino- i karboksyproteinazy prokolagenu) i w ten sposób powstaje cząsteczka tropokolagenu).
Następnie :
cząsteczki tropokolagenu układane są we włókna kolagenowe
następnie oksydacyjna deaminacja (z udziałem oksydazy lizolowej) grup aminowych reszt lizenowych i hydroksylizynowych do aldehydów.
Powstanie reaktywnych aldehydów, które mogą ulegać kondensacji z podobnie powstałymi aldehydami.
Następnie tworzone są wiązania sieciujące (kowalencyjne mostki poprzeczne),
ostatecznie następuje dojrzewanie cząsteczki kolagenu z wytworzeniem pochodnych 3-hydroksy-pirydyniowych:
Pirydynoliny (PYD)
Deoksypirydynoliny (DPD)
PYD i DPD to markery resorpcji kości.
Zaburzenia metabolizmu kostnego.
W warunkach fizjologicznych tworzenie kości resorpcja kości.
Osłabienie tworzenia (przy prawidłowej resorpcji) lub
Nasilenie resorpcji (przy prawidłowym tworzeniu)
Prowadzi do zmniejszenia się masy kostnej (osteoporoza i inne choroby metabolizmu kości).
Zmiany ilościowe kości ocenia się przy użyciu densytometrii rentgenowskiej.
Testy biochemiczne pozwalają na badanie dynamiki i kierunku zmian metabolizmu kostnego- badania o charakterze jakościowym.
Biochemiczne markery metabolizmu kości- nowoczesne i wysokospecyficzne wskaźniki procesów resorpcji i kościotworzenia
Oznaczane substancje są składnikami macierzy kostnej:
Występują wewnątrz komórek macierzy (enzymy pochodzące z osteoklastów lub osteoblastów)
Stanowią fragmenty białkowych elementów strukturalnych kości lub produkty ich degradacji
Mogą być składnikami nieorganicznej struktury kostnej (głównie jony wapnia)
Na podstawie faz cyklu kostnego markery metabolizmu kostnego dzieli się na wskaźniki kościotworzenia i resorpcji kości.
Markery kościotworzenia |
Markery resorpcji kości |
1. frakcja kostna alkalicznej fosfatazy (b-ALP) |
1. hydroksyprolina (OHP) |
2. osteokalcyna (OC, BGP) |
2. winianooporna kwaśna fosfataza (TRAP) |
3. C-końcowy propeptyd prokolagenu typu I (PICP) |
3. glikozydy hydroksylizynowe (GGHL, GHL) |
4. N-końcowy propeptyd prokolagenu typu I (PINP) |
4. karboksyterminalny telopeptyd kolagenu typu I (ICTP) |
|
5. pirydynolina i deoksypirydynolina (PYD, DPD) |
|
6. N-końcowy usieciowany telopeptyd łańcucha alfa kolagenu typu I (NTX) |
|
7. C-końcowy usieciowany telopeptyd łańcucha alfa kolagenu typu I (CTX) |
|
8. sjaloproteina kostna (BSP) |
Tylko pozycje 2 i 8 z tabeli nie są pochodnymi kolagenu.
Markery kościotworzenia:
Frakcja kostna alkalicznej fosfatazy (b-ALP)
Osteokalcyna (OC, BGP)
C-końcowy propeptyd prokolagenu typu I (PICP)
N-końcowy propeptyd prokolagenu typu I (PINP)
Markery resorpcji kości:
Winianooporna kwaśna fosfataza (TRAP)
Hydroksyprolina (OHP)
Glikozydy hydroksylizynoe (GGHL, GHL)
Pirydynolina i deoksypirydynolina (PYD, DPD)
Karboksyterminalny telopeptyd kolagenu typu I (ICTP)
N-końcowy usieciowany telopeptyd łańcucha alfa kolagenu typu I (NTX)
C0końcowy usieciowany telopeptyd łańcucha alfa kolagenu typu I (CTX)
Sjaloproteina kostna (BSP)
Nowoczesne markery obrotu kostnego są:
Cząsteczkami wysoce swoistymi dla metabolizmu tkanki kostnej
Metody ich oznaczania wysoce specyficzne dla tych cząsteczek
Wg ustaleń na Światowym Kongresie Osteoporoza 2000 do nowoczesnych markerów obrotu kostnego zalicza się:
B-ALP
Osteokalcyne
PINP
PYD i DPD
NTX
CTX
A)Charakterystyka markerów kościotworzenia :
Rutynowo oznacza się je we krwi
I .Frakcja kostna fosfatazy alkalicznej to czuły marker kościotworzenia. Jest stosowany jako wskaźnik skuteczności terapii antyresorpcyjnej. Użyteczność kliniczna TRAP wynika z gwałtownego wzrostu …
Wykazuje znamienny wzrost w:
Chorobie Pageta
Nadczynności przytarczyc i tarczycy
Osteomalacji i osteodystrofii nerkowej
Akromegalii
Przerzutach nowotworowych do kości
Metody oznaczania : b-ALP- ELISA (Alphase-B)
II PICP I PINP
Zarówno PICP jak I PINP są uwalniane z nowosyntetyzowanego prokolagenu w ilościach stechiometrycznych i dlatego ich stężenie może być miernikiem nasilenia syntezy kolagenu I (miarą aktywności osteoblastów i procesów syntezy tkanki kostnej
Wykazano dobrą korelację między stężeniem PICP a tempem kościotworzenia i całkowitą aktywnością ALP
PINP jest dobrym wskaźnikiem skuteczności leczenia antyresorpcyjnego a także bywa używany w diagnozowaniu przerzutów raka piersi do kości
Metody oznaczania PICP i PINP:
PICP- metoda ELISA z zestawem Prolagen-C
PINP- metoda RIA przy użyciu zestawu PINP
III Osteokalcyna (białko kostne GLA , białko wiążące wapń)
syntetyzowana przez:
osteoblasty
odontoblasty
hipertroficzne chondrocyty
jest specyficznym markerem funkcji osteoblastów, ale bezpośrednio po uwolnieniu komórek 60-90% wbudowywana jest do zewnątrzkomórkowej macierzy kostnej.
Fragment N-końcowo-środkowy (główny produkt proteolizy)
N-Mid Osteocalcin ELISA i IRMA
N-mid Osteocalcin One Step ELISA
System ELECSYS (metoda immunochemiluminescencyjna)
Nienaruszoną cząsteczkę osteokalcyny oznacza
Zestaw NovoCalcin w systemie ELISa lub
Metoda automatyczna z wykorzystaniem systemy ELECSYS
Większość markerów resorpcji to produkty degradacji kolagenu.
Markery resorpcji oznacza się w moczu.
Sjaloproteina swoista dla kości
Powstaje w komórkach macierzy kostnej
Może tworzyć mostki między komórkami a substancją mineralną kości
Marker resorpcji kości
Jest obecnie najczulszym i najbardziej swoistym markerem resorpcji kości
Jest to czuły marker w monitorowaniu
Leczenia antyresorpcyjnego osteoporozy oraz choroby Pageta
Terapii estrogenowej
Jest najlepszym czynnikiem predykcyjnym wskazującym na tworzenie się przerzutów nowotworowych do kości
W moczu metodą ELISA- zestaw Osteomark
W przygotowaniu jest metoda do oznaczania NTX w surowicy
W moczu- CrossLaps ELISA i alfa CrossLaps RIA
W surowicy
Metodą manualną zestawem Serum CrossLaps One Step ELISA
W systemie automatycznym ELECSYS
Frakcja wolna PYD i DPD w moczu za pomocą ELISA
Całkowita pula PYD i DPD po hydrolizie moczu przez HPLC
W surowicy PYD i DPD za pomocą ELISA
identyfikacja pacjentek z podwyższonym obrotem kostnym, niezależnym od obniżonej gęstości minerału kostnego
badanie konieczne u kobiet
ze złamaniem w wywiadzie
…
Monitorowanie leczenia preparatami antyresorpcyjnymi (HTZ, bisfosfoniany)- obserwowane zmiany poziomu markerów obrotu kostnego MSC (minimal significatn concentration)
profilaktyka
piersi 35%
prostaty 30%
płuca 10%
nerki 5%
tarczycy 2%
inne 18%
badanie scyntygraficzne (czułe, ale mało swoiste)
klasyczna radiologia (znaczna swoistość, mała czułość)
oznaczanie markerów (np. CA 15-3 dla raka piersi)
umożliwia rozpoznanie rozsiewu choroby nowotworowej
pośrednio może pomóc w rozpoznaniu przerzutów do kości
monitorowanie wyników leczenia ( głównie CTX)
osteoprotegryna (OPG)
receptor aktywujący jądrowy czynnik NF-kappaB (RANK)
ligand RANK (RANKL)
choroby metaboliczne kości (nasilona ekspresja RANKL, nasilona resorpcja kości)
osteoporoza pomenopauzalna
osteoporoza posterydowa
nadczynność przytarczyc
choroba Pageta
choroby kości związane z procesem zapalnym (nasilona ekspresja RANKL, nasilona resorpcja kości)
RZS
Stany zapalne przyzębia
Choroby nowotworowe (nasilona ekspresja RANKL w stosunku do OPG, nasilona resorpcja kości)
Szpiczak kości
Osteolityczne przerzuty nowotworowe do kości
Hiperkalcemia w nowotworzeniu
Dziedziczne choroby kości
Dziedziczna ekspansywna osteoliza kośc/dziedziczna choroba Pageta
Postępująca hiperfosfatazja
Młodzieńcza choroba Pageta
Metody oznaczania OC:
Stężenie OC wzrasta: U kobiet z osteoporozą promenopauzalną …
B)Charakterystyka markerów resorpcji :
(Wydalanie wapnia z moczem -Najprostszy i najtańszy sposób mierzenia resorpcji, ale też najmniej czuły)
I Osteopontyna
Sjaloproteina kostna występuje w mineralizowanych tkankach takich, jak:
- kość,
-dentyna,
-uwapniona chrząstka.
Oznaczanie - metodą ELISA.
Stężenie wzrasta w:
-Osteoporozie,
-Nadczynności przytarczyc
II. Osteonektyna - swoiste białko błonowe, wiąże kolagen, wapń
III. Osteoprotegryna - jest receptorem dla czynnika różnicowania osteoblastów
IV. NTX
(Telopeptydy- cząsteczki kolagenu zawierające wiązanie sieciujące między N- lub C- końcem cząsteczki a heliakalną częścią sąsiedniej cząsteczki kolagenu. )
NTX i DPD oznaczane metodą HPLC stanowią markery o najwyższej użyteczności klinicznej ze względu na swoją wysoką swoistość.
Metody oznaczania NTX i CTX
NTX
CTX
V. Hydroksyprolina
Około 10% OHP wydalane jest z moczem, gdzie może być wykrywana metodą HPLC, jako aminokwas wolny. Metoda droga, OHP niespecyficzne dla kości
VI. Glikozydy hydroksylizynowe
GGHL - glikozylo- galaktozylo hydroksylizyna
GHL - galaktozylo hydroksylizyna
GHL uwalniana jest do krążenia w procesie degradacji kolagenu, może być oznaczana w moczu przez HPLC, brak metody immunologicznej
VII. PYD , DPD
PYD występuje w kości, chrząstce, ścięgnach, naczyniach
DPD ograniczona prawie wyłącznie do kości
Metody oznaczania:
Wskazania do oznaczania nowoczesnych markerów obrotu kostnego (w surowicy krwi)
CTX i N-MID
Przydatność markerów w diagnostyce nowotworowej
przerzuty do kości występują w 20% wszystkich nowotworów złośliwych, najczęściej przy nowotworze:
Rodzaje przerzutów nowotworowych
1. osteolityczne (resorpcja kości przez aktywne osteoblasty, nasilona osteoliza)
2.osteosklerotyczne (nadbudowa kości)
Ad. 1 przerzuty osteolityczne
kom. Nowotworowe wydzielają czynniki wzrostu, np. TNF alfa, które pobudzają osteoklasty do szybkiego niszczenia struktury kostnej.
Ad. 2 przerzuty osteosklerotyczne
czynniki wzrostu (np. TGF beta) pochodzenia kostnego komórki nowotworowe czynniki wzrostu (np. endotelina) pobudzenie osteoblastów
Podstawowe badania w diagnostyce przerzutów nowotworowych to:
żadne z powszechnie stosowanych badań laboratoryjnych nie jest specyficzne
Kliniczne zastosowanie markerów obrotu kostnego w onkologii:
1.diagnostyka przerzutów do kości ( PYD, DPD, CTX, NTX)
przerzuty do kości nasilona resorpcja kości wzrost produktów rozpadu kolagenu w moczu
Czynniki mające wpływ na obrót kostny:
Potencjał diagnostyczno-terpeutyczny systemu RANKL/RANK/OPG
- w młodej zdrowej kości zachowana jest równowaga między kościotworzeniem a resorpcją, co gwarantuje względnie stałą masę kości
- na straży właściwego dojrzewania i funkcjonowania osteoklastów stoją:
choroby, w których patomechanizmie bierze udział szlak RANKL/ RANK/OPG
Wyszukiwarka
Podobne podstrony:
Gospodarka wodno elektrolitowa i mineralna cz I
Materiały z wykładu przedmiotu Podstawy działalnosci gospodarczej statystyka cz I
WITAMINY I MINERAŁY CZ.2, Witaminy i składniki mineralne
wyklad 3 Gospodarka mineralna ustroju
BI 3 gospodarka mineralna
działalnośc gospodarcza sem I cz II
Kolokwium Gospodarka mineralna Opracowanie
Monitorowanie gospodarki mineralnej
Materiały z wykładu przedmiotu Podstawy działalnosci gospodarczej statystyka cz II
Minerały A cz 1
Minerały A cz 2
Minerały K cz 2
Minerały S cz 2
Minerały C cz 1
Minerały S cz 1
Minerały C cz 2
Minerały K cz 1
Minerały A cz 4
więcej podobnych podstron