
powrót do listy numerów archiwalnych
powrót do strony głównej
Wirus ludzkich brodawczaków a rak szyjki macicy
P. I. Blomfield, MRCOG. Senior Registrar, Dudley Road Hospital, Dudley Road, Birmingham B18
7QH. Tłumaczył Piotr Świrski.
Biolodzy molekularni, w odróżnieniu od generalnie bardziej sceptycznie nastawionych epidemiologów, odnoszą się z dużo większym
przekonaniem do tego, że zakażenie wirusem HPV (Human Papilloma Virus), wirus ludzkich brodawczaków, jest czynnikiem
etiologicznym raka szyjki macicy. Przy ustalaniu związku przyczynowego pomiędzy zakażeniem HPV a nowotworem szyjki natrafiono
na liczne trudności. Po pierwsze niezbyt precyzyjne metody badawcze, po wtóre stosowanie w poszczególnych przypadkach
uproszczonych kryteriów oceny przyczyn wywołujących zakażenie, rzadkie występowanie pełnych objawów zakażenia, oraz to, że w
mechanizmie onkogenezy bierze udział wiele czynników.
Celem tego artykułu jest przegląd bieżących doniesień dotyczących związku HPV z rakiem szyjki macicy. W taksonomii wirusów
Papillomawirusy należą do rodziny Papova viridae. Powszechnie znanym faktem jest to, że wywołują one - u zwierząt, jak i u ludzi -
zmiany o charakterze łagodnym w obrębie nabłonka skóry i błon śluzowych. Materiał wirusologiczny po raz pierwszy wyizolowano w
postaci mikrokrystalicznej w roku 1949. W ciągu następnego 20-lecia badań wysunięto przypuszczenie, że za wszystkie zmiany
brodawkowate skóry, spotykane u ludzi, odpowiedzialny jest jeden wirus. W chwili obecnej HPV identyfikowany jest jako dwuniciowy
DNA-wirus, zaś przy jego klasyfikacji uwzględnia się homologię występującą w zakresie wirusowego DNA oraz to, kto jest naturalnym
gospodarzem. Do tej pory wyróżniono przeszło 60 typów HPV.
(1)
Nie ulega wątpliwości, że wirusy Papillorna powodują transformację nowotworową komórek obecnych w zmianach brodawkowatych
skóry lub błon śluzowych, tak jak to ma miejsce w przypadku epidermodysplasia veruciformis. Zwierzęce wirusy Papilloma wykazują
aktywność indukowania transformacji nowotworowej in vitro, natomiast wirus HPV tylko w obecności dodatkowych czynników -
aktywowanych onkogenów Ha-ras oraz Ej-ras. Kiedy w materiale biopsyjnym raka szyjki macicy odkryto wirusa HPV, w sposób
naturalny powstała hipoteza o jego roli w rozwoju tego nowotworu.
Przeszkodą w poznaniu biologii wirusów Papillorna -głównie za sprawą trudności w uzyskaniu warunków imitujących obecność
ostatecznie zróżnicowanych keratynocytów - były nieudane próby stworzenia hodowli tkankowej, w której byłby możliwy całkowity
rozwój wirusa. Wraz z rozwojem technik rekombinacji DNA i analizy genetycznej stało się możliwe poznanie struktury genomu HPV oraz
jego rozmieszczenia w komórkach gospodarza.
METODY WYKRYWANIA
Chociaż do identyfikacji zakażenia wirusem HPV można skorzystać z mikroskopu świetlnego, elektronowego czy technik
immunohistochemicznych, to nie są one jednak wystarczająco czułe, aby za ich pomocą wykryć zakażenia latentne (utajone) czy też
znaleźć różnice pomiędzy poszczególnymi typami wirusa. Dlatego też w procesie identyfikacji wirusa najbardziej praktyczne i
niezawodne okazały się techniki hybrydyzacji. Istnieje szeroka gama technik używanych do określenia sekwencji genomu wirusa, w tym
metody polegające na komplementarnym łączeniu nici w różnych wariantach: DNA z DNA, DNA z RNA, RNA z RNA. Obecnie
najczęściej stosowane techniki wykorzystują albo testowane DNA, albo sondy DNA unieruchomione bądź na starym podłożu, takim jak
nitroceluloza czy nylon, bądź w utrwalonych tkankach albo komórkach. Trzy podstawowe techniki hybrydyzacji DNA są najczęściej
używane do identyfikacji zakażenia HPV: metoda Southern blot, filter in situ (FISH), tissue in situ (patrz tabela 1).
(2)
Niejednoznacznie określono czułość i swoistość poszczególnych metod. Caussy i wsp. (1988)
(3)
porównywali częstość występowania
typów 6, 11, 16 i 18 wirusa HPV w wycinkach pobranych z szyjki macicy u 26 pacjentek z kłykcinami, 25 pacjentek z inwazyjnym rakiem
szyjki oraz 33 kobiet zdrowych. Współczynnik wykrywalności wirusowego DNA był porównywalny we wszystkich metodach i wynosił od
62% do 82%. Podobnie w odniesieniu do wszystkich kategorii chorób było z czułością i swoistością poszczególnych metod, z wyjątkiem
hybrydyzacji in situ, za pomocą której można było wykryć sekwencje HPV jedynie w 30% próbek raka szyjki macicy, podczas gdy
wskaźnik ten dla metody Southern błot wynosił 70%, a dla metody FISH 89%.
Tabela 1 - Zestawienie różnych metod hybrydyzacji stosowanych do
wykrywania HPV
Metoda
Dostępność
DNA
Próg czułości
Wykonalność
Cechy
charakterystyczne
Southern
blot
Konieczność
izolacji
0, 1-1
genomu
wirusowego
w komórce
czaso-i
pracochłonna
czuła, swoista,
umożliwia
określenie, czy
wirusowy genom
występuje w
postaci
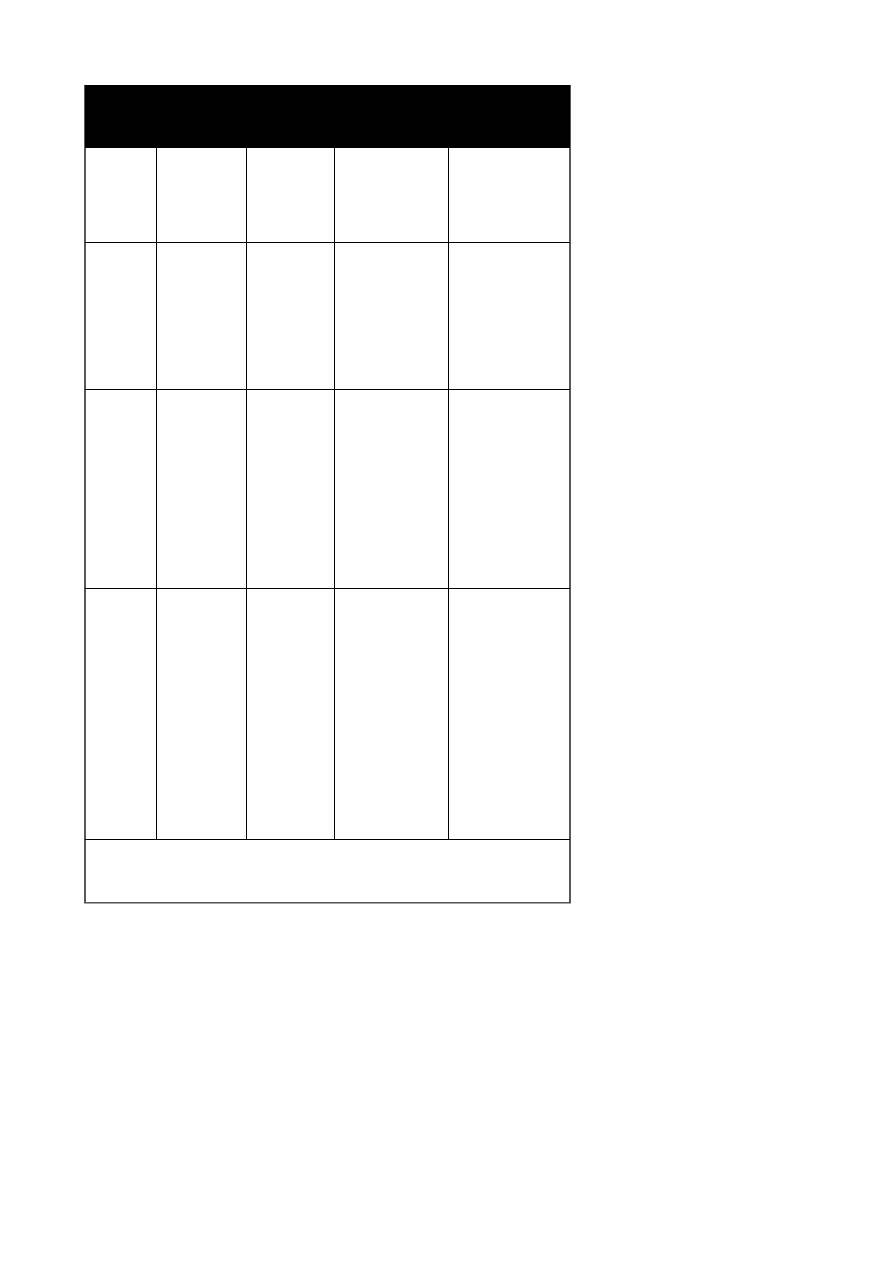
Tabela 1 - Zestawienie różnych metod hybrydyzacji stosowanych do
wykrywania HPV
zintegrowanej z
DNA komórki, czy
też w postaci
episomalnej
Dot blot
Konieczność
izolacji
0, 1-1
genomu
wirusowego
w komórce
o wiele
łatwiejsza, jeśli
stosowana jest w
większej liczbie
próbek
skłonność do
wyników fałszywie
dodatnich z
powodu łączenia
nośnika i
niespecyficznego
wiązania
Filter in
situ
Brak
konieczności
izolacji
W niektórych
komórkach
potrzeba 10
4
genomów
wirusowych
szybsza w
porównaniu z
innymi metodami
skłonność do
wyników fałszywie
dodatnich
spowodowana
mieszaniem się
DNA z elementami
komórkowymi i
śluzem i często
dwuznaczne
wyniki
Tissue in
situ
Brak
konieczności
izolacji
niektóre
komórki
muszą
zawierać 20-
50 genomów
wirusowych
pracochłonna
może być
stosowana w
świeżym lub
utrwalonym
materiale. W
porównaniu z
innymi metodami
niezbyt czuła,
szczególnie w
odniesieniu do
zmian daleko
posuniętych w
rozwoju
Według Human Papillomavirus and Cervical Cancer. Munoz N, Bosch FX,
Jensen OM, (1989). IARC Scientifidc Publications, No 94.
37
Ostatnio wykazano, że międzylaboratoryjne różnice w wynikach są odzwierciedleniem stosowanych technik badawczych, l tak
Brandsma i wsp. (1989)
(4)
poprosili 4 doświadczone laboratoria o przetestowanie za pomocą metody Southern blot 40 identycznych
znakowanych próbek DNA wyizolowanych z przypuszczalnie zainfekowanych i nie zainfekowanych tkanek. Procentowa zgodność w
otrzymanych wynikach pomiędzy laboratoriami wahała się od 66 do 97%, gdy chodziło o ustalenie, czy dana próbka jest HPV dodatnia
albo HPV ujemna, oraz od 77-96% w określeniu typu wirusa w próbkach HPV dodatnich. Jest prawdopodobne, że rozbieżności byłyby
dużo większe, gdyby nie kontrolowano procesu pobierania tkanek, izolowania DNA oraz doboru enzymu restrykcyjnego.
Właściwe pobieranie materiału biologicznego
Dodatkowym czynnikiem wpływającym na dane o częstości występowania jest wybór metody pobierania materiału biologicznego do
badań. Ze względu na tropizm, jaki wirusy wykazują wobec zróżnicowanych keratynocytów, teoretycznie bardziej prawdopodobne
wydaje się wychwycenie komórek HPV dodatnich w rozmazie szyjkowym czy popłuczynach, aniżeli w preparacie biopsyjnym. Hallam i
wsp. (1989)
5
wykazali znaczne różnice w
wydajności" diagnostycznej materiału biologicznego uzyskanego od 100 kobiet, u których w trakcie badania kolposkopowego
jednocześnie wykonano abrazję i pobrano wycinki z szyjki, a następnie za pomocą metody dot-blot poszukiwano obecności wirusa.
Całkowity wpływ błędu - wynikającego z niewłaściwie dobranych metod pobierania materiału biologicznego - na ostateczne wyniki

trudno oszacować; dodatkowo komplikacją może być ulegające wahaniom zjawisko wydostawania się wirusów z komórek, na co
wskazywali De Villiers i wsp. (1987),
(6)
Pao i wsp. (1990),
(7)
oraz Reeves i wsp. (1990).
(8)
Obecne możliwości wykrywania infekcji HPV
Ostatnio do typowania HPV zaczęto używać metody PCR. W technice tej używając primerów (starterów) oligonukleotydowych oraz
polimerazy DNA uzyskuje się powielenie specyficznych sekwencji wirusowych, które mogą być następnie identyfikowane za pomocą
standardowych technik hybrydyzacyjnych. Może być ona wykorzystana zarówno w świeżym, jak i już wcześniej pobranym materiale
biopsyjnym, jak również w preparatach cytologicznych. Jest niewiarygodnie czuła: teoretycznie progiem wykrywalności jest 1 genom
wirusowy na 10
6
komórek. Pomimo zautomatyzowania całej metody i możliwości jednoczesnego badania większej liczby próbek,
interpretacja uzyskanych wyników jest trudna właśnie z powodu ogromnej czułości i możliwych zanieczyszczeń, powstałych w trakcie
całego procesu diagnostycznego.
(10)
Kolejnym krokiem naprzód było powstanie testów immunologicznych wykrywających zakażenie wirusem HPV. Nie wykazano istnienia
żadnej odpowiedzi immunologicznej wobec ostrego czy utajonego zakażenia wirusem HPV. W chwili obecnej istnieje wiele doniesień z
różnych laboratoriów opisujących występowanie przeciwciał przeciw białkom wirusa HPV typ 16. Jednak trudno teraz pokusić się o
określenie specyficzności tych metod.
ZWIĄZEK MIĘDZY WIRUSEM HPV A NOWOTWOREM SZYJKI MACICY
Charakterystykę cytomorfologiczną koilocytów przedstawił Ayre w 1949 roku, zaś Meisel i Fortin (1976)
(11)
połączyli fakt ich
występowania z infekcją wirusem HPV. Idąc za sugestią Hausena z 1976 r., że HPV jest czynnikiem etiologicznym raka szyjki macicy,
pojawiły się doniesienia na temat częstego współistnienia cytopatologicznych cech infekcji wirusem HPV z rakiem szyjki macicy.
Wykorzystując techniki hybrydyzacji DNA, w ciągu ostatnich 10 lat powstało wiele prac podejmujących temat częstości występowania
zakażeń z udziałem tego wirusa. Do połowy lat 80. wyłaniał się wzór występowania określonych typów wirusa HPV w różnych
chorobach szyjki. Po pierwsze, u kobiet z nowotworem szyjki, częściej niż u kobiet zdrowych, wykrywano obecność zakażenia wirusami
HPV 16 i 18, oraz że prawdopodobieństwo infekcji wzrastało w miarę pogłębiania się zmian dysplastycznych. Rzadko w chorobie
inwazyjnej stwierdzano obecność wirusów HPV 6 i HPV 11, natomiast często występowały one gdy nasilenie zmian dysplastycznych
było niewielkie. Inne typy HPV, to jest 31, 33 i 35 również łączono z chorobą inwazyjną.
W 1988 roku Munoz i Bosch
(12)
dokonali przeglądu prac dotyczących częstości występowania wirusa i chociaż uznali te wyniki za
zasadniczą część dowodu epidemiologicznego udziału HPV w rozwoju raka szyjki macicy, to jednocześnie krytykowali je za to, że
w
żadnym z nich nie spełniono kryteriów, jakie bierze się pod uwagę przy ustalaniu protokołu badań i przy analizie danych, a które
umożliwiają kontrolę nad wpływem czynników ubocznych, niejasnych i przypadkowych w ich interpretacji". W dodatku istnieje znaczna
liczba kobiet zainfekowanych wirusem, u których nie stwierdza się cytologicznych zmian w szyjce (patrz tabela 2). Munoz i Bosch
wskazali na potrzebę prospektywnych badań z udziałem grupy kontrolnej, wyodrębnieniem grup kohortowych oraz analizy korelacyjnej
w celu wyjaśnienia roli HPV w rozwoju nowotworów szyjki macicy.
Badania z użyciem grupy kontrolnej
Reeves i wsp. (1989)
13
donosząc badaniach na dużej liczbie kobiet z wyodrębnieniem grupy kontrolnej, przeprowadzonych w
Ameryce Południowej, gdzie nowotwory szyjki macicy występują w szczególnie dużym nasileniu. Grupa badana obejmowała 759
pacjentek z inwazyjnym rakiem szyjki macicy, w grupie kontrolnej dobranej pod względem wieku znajdowało się 1467 kobiet. U 62%
kobiet z inwazyjnym rakiem oraz u 32% w grupie kontrolnej za pomocą techniki hybrydyzacyjnej filter in situ (FISH) stwierdzono infekcję
wirusem HPV 16. Infekcja wirusami HPV 6 i HPV 11 także była związana z rakiem szyjki macicy (17% pacjentek badanych, 7% w grupie
kontrolnej). Po przeprowadzeniu analizy wielu zmiennych umożliwiających analizę charakterystyk statusu społecznego, nawyków
seksualnych oraz przeszłość położniczą, zakażenie wirusami HPV16 i HPV 18 pozostało istotnym czynnikiem ryzyka w rozwoju raka
szyjki. W trakcie tych badań stwierdzono również, że HPV 6/11 jest niezależnie związany z rakiem szyjki. Dużym zaskoczeniem było
odkrycie, że aktywność seksualna jest niezależnym czynnikiem ryzyka raka szyjki, bez związku z obecnością wirusowego DNA.
Przeprowadzone później dwa kolejne badania z grupą kontrolną wykazały istotną zależność pomiędzy infekcją HPV 16/18 a rakiem
szyjki. Jednak w obu przypadkach badaniami objęto małą liczbę chorych, zaś w jednym z nich dane na temat zakażenia wirusem HPV
były niekompletne, zarówno jeśli chodzi o grupę badaną, jak i o kontrolną (Schmauz i wsp., 1989
(14)
; Donnan i wsp., 1989
(15)
).
Murthy i wsp.
(16)
przeprowadzili badania porównawcze z grupą kontrolną dotyczące częstości infekcji HPV 16/18 używając techniki
hybrydyzacji in situ w utrwalonym materiale biopsyjnym uzyskanym od dwóch grup kobiet, które brały udział w prospektywnym badaniu
kohortowym (ryzyko = 5, 9, 95% przedział ufności = 2, 5-14, 1). Kobiety nie były dobrane pod względem czasu trwania małżeństwa,
który był jedynym niezależnym czynnikiem ryzyka progresji choroby, ani pod względem okresu obserwacji. Materiał biopsyjny, w którym
szukano obecności HPV, uzyskiwano bądź w momencie przerwania badań (progresja w kierunku GIN), bądź w momencie zakończenia
okresu badawczego.
Chociaż we wszystkich tych badaniach z obecnością grup kontrolnych wykazano związek pomiędzy infekcją wirusami HPV 16 i HPV
18 a rakiem szyjki macicy, mogą jednak istnieć inne niż prosty związek przyczynowy powody tego stanu rzeczy. Możliwe, że wirusowe
DNA można łatwiej identyfikować czy izolować z komórek zmienionych nowotworowo w porównaniu z komórkami normalnymi, albo że
ryzyko infekcji w przypadku raka jest większe. Ważne jest również, by realizując protokół badań wykluczyć obecność lub wpływ
czynników, które mogłyby zagmatwać obraz i niekorzystnie wpłynąć na końcowy rezultat badań. Nie pozostaje też bez wpływu na
końcowy wynik dobór właściwej metody przy pobieraniu materiału biologicznego, a także czułość techniki, którą stosujemy przy jego
badaniu.
Badania kohortowe
Uważa się, że badania kohortowe są jednym z najlepszych sposobów uzyskania dowodów na istnienie związku przyczynowego. W
większości protokołów obecność zakażenia wirusem HPV stwierdzono w oparciu o kryteria morfologiczne. W trzech ośrodkach (Nash i
wsp. 1987,
(17)
Mithchell i wsp. 1986,
(18)
Miesels & Morin, 1986
(19)
) badaniami objęto kobiety z cytologicznymi albo histopatologicznymi

dowodami infekcji HPV. Główną wadą tych badań jest to, że na skutek niedokładności kryteriów cytologicznych, wad celowanej biopsji,
trudności w interpretacji histologicznej, znaczna część kobiet w chwili rozpoczęcia badań miała prawdopodobnie nieinwazyjną postać
raka (CIN).
Wzorcowo fakt zakażenia wirusem HPV powinien być na początku potwierdzony za pomocą technik hybrydyzacji DNA. Campion i
wsp. (1986)
(20)
zastosowali technikę hybrydyzacji filter in situ (FISH) w preparatach cytologicznych pobranych od kobiet z CIN w trzech
kolejnych rozmazach. Po dwóch latach odsetek progresji do III stopnia CIN wynosił 56% w grupie 39 kobiet HPV 16 dodatnich wobec
20% z grupy 46 kobiet HPV 6 dodatnich. Wyniki tych badań
zdają się dowodzić roli HPV16 w progresji zmian dysplastycznych, jakkolwiek badane grupy kobiet dobrane były w sposób wysoce-
selektywny. Istnieje duże prawdopodobieństwo, że w momencie rozpoczynania badań u znacznej części badanych faktyczny stopień
nasilenia zmian dysplastycznych w obrębie szyjki macicy był większy niż to wynikało z oceny materiału cytologicznego czy biopsyjnego.
W niedawno przeprowadzonych badaniach w Birmingham stwierdzono, że u 82 spośród 345 kobiet (23, 8%), u których za pomocą pętli
diatermicznej usuwano strefę transformacji (rozpoznanie kolposkopowe), z cytologicznym rozpoznaniem umiarkowanej dyskariozy
komórek złuszczonych występował III stopień CIN. W świetle tego należy oceniać wyniki uzyskane przez Syrjanen i wsp. (1988),
(21)
które wykazywały istnienie związku pomiędzy zakażeniem wirusami H PV16/18 a progresją w kierunku bardziej zaawansowanych
zmian dysplastycznych. Jednak przy ocenie zmian wyjściowych posłużono się kryteriami cytologicznymi. Poza tym wielokrotne biopsje
przeprowadzane w miarę pogłębiania się zmian w obrębie szyjki mogły wpływać na naturalny bieg procesu chorobowego.
Tabela 2. Częstość występowania infekcji wirusem HPV 16 w materiale uzyskanym w
populacji zdrowych kobiet
Miejsce pozyskania
materiału
Metoda
wykrywania
infekcji
Liczba
Odsetek
HPV 16/18
dodatnich
Odsetek
HPV6/11
dodatnich
Odsetek ze
stwierdzoną
obecnością
DNA wirusa
HPV
Nowy Meksyk,
31
Poradnia ludzi
zdrowych
PCR
85
11%
/
41%
Kalifornia, Poradnia
Planowania Rodziny
PCR
32
0%
/
31%
Waszyngton,
Przychodnia
studencka
PCR
27
22%
/
44%
Taiwan,
7
normalne
kobiety"
PCR
102
8, 8%
29, 4%
42, 2%
Londyn, pacjenci
Poradni Planowania
Rodziny
36
PCR
140
84%
/
/
Grenlandia,
23
wybrane z rejestru
ludności
FISH
586
8, 8%
7, 5%
/
Dania, wybrane z
rejestru ludności
FISH
661
13%
6, 7%
/
Waszyngton,
studentki
24
podlegające
corocznym badaniom
Dot blot
545
7%
1, 0%
/
Bogota, Meksyk,
Panama,
13
Kostaryka,
FISH
1467
32%
7%
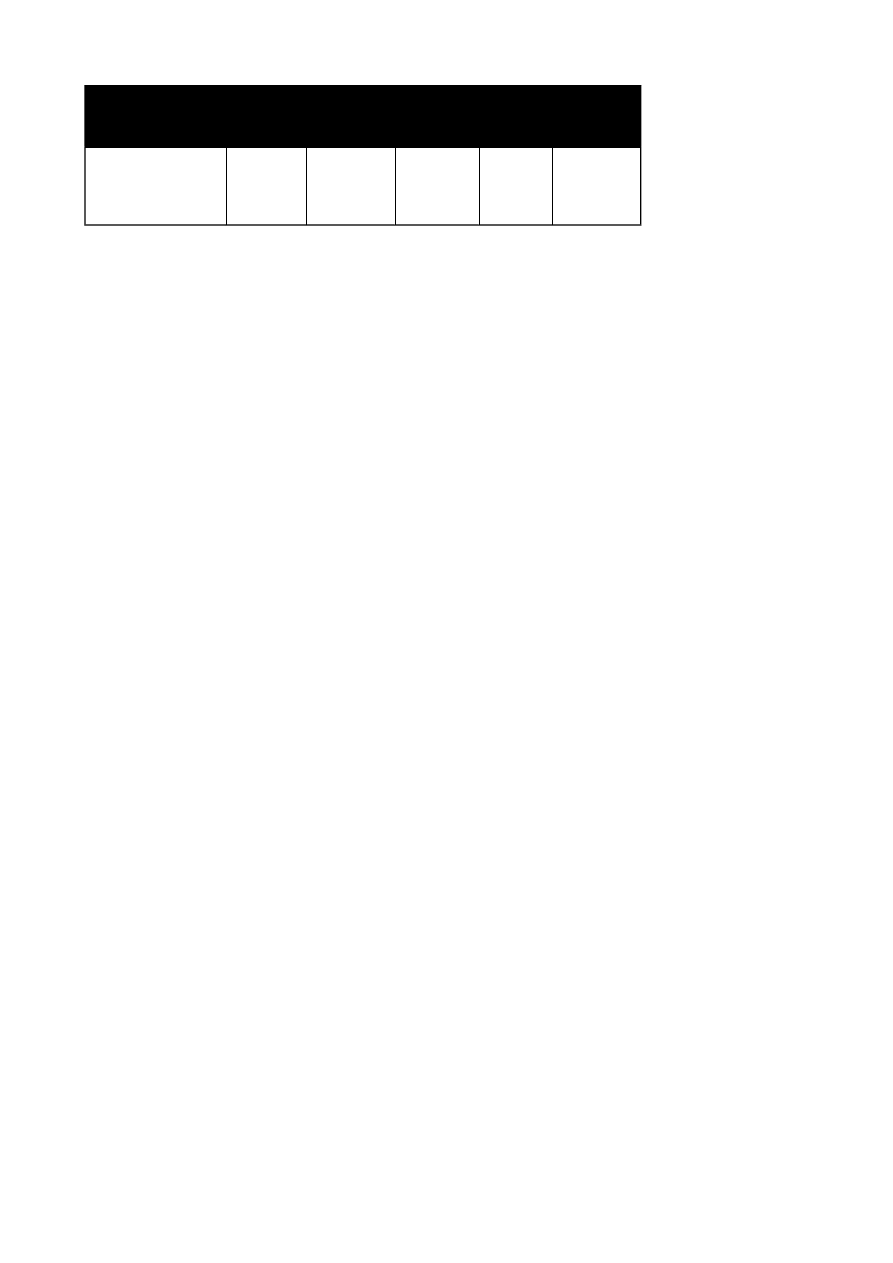
Tabela 2. Częstość występowania infekcji wirusem HPV 16 w materiale uzyskanym w
populacji zdrowych kobiet
losowo wybrany
szpital oraz badania
kontrolne
Hollingsworth
(22)
obserwował 325 kobiet, u których w obrazie cytologicznym i kolposkopowym nie stwierdzono żadnych odchyleń. Do
identyfikacji zakażenia wirusem HPV użyto metody FISH. W ciągu dwóch lat obserwacji u czterech spośród 164 kobiet HPV 16
pozytywnych (co stanowiło 2, 5%) rozwinęła się zaawansowana dysplazja w obrębie szyjki. Równocześnie u pięciu spośród 118 HPV-
16 negatywnych (co stanowiło 4, 2%) rozpoznano podobne zmiany. Wyniki te nie potwierdzają roli wirusa HPV 16 w rozwoju raka szyjki,
tym niemniej zmiany dotyczyły niewielu pacjentek, co odzwierciedla krótki okres obserwacji. Badacze wskazywali również na istniejącą
wśród pacjentek zmienność pod względem stopnia nasilenia zakażenia wirusem HPV.
Badania korelacyjne
W studiach przeprowadzonych przez Kjear i wsp. (1989)
23
porównywano rozpowszechnienie zakażenia specyficznymi typami wirusa
HPV w losowo dobranych grupach wyłonionych spośród dwóch populacji o odmiennym współczynniku zapadalności na raka szyjki
macicy. W Grenlandii współczynnik ten jest 5, 7 razy większy niż w Danii. Zarówno liczba stałych partnerów seksualnych
przypadających na jedną kobietę, jak i częstość występowania przeciwciał anty-HSV 2 były wyższe w populacji grenlandzkiej, także
wiek, w którym kobieta odbyła pierwszy stosunek (pozostający w korelacji z rozwojem raka szyjki macicy), był w tej grupie niższy.
Jednak oznaczając techniką hybrydyzacji FISH całkowitą liczbę zakażeń wirusami HPV 16/18, w populacji duńskiej uzyskano 13%, zaś
w grenlandzkiej 8, 8%. W poszczególnych grupach wiekowych wartość tego współczynnika w populacji grenlandzkiej stanowiła 67%
wartości uzyskanej w populacji duńskiej. Chociaż badania te poddano krytyce z powodu nierówności w intensywności badań
przesiewowych obowiązujących w obu krajach i zakłada się w nich istnienie związku pomiędzy bieżącą częstością występowania
zakażenia wirusem HPV a współczynnikiem zapadalności na raka szyjki macicy, to trudno nie zwrócić uwagi na uzyskane wyniki.
Kiviat i wsp. (1989)
(24)
porównywał 454 kobiety losowo wybrane spośród pacjentek poradni
W" z 545 studentkami college'u, które
zgłosiły się na coroczne badania. Tak jak przewidywano, tworząc charakterystykę seksualną obu grup, pacjentki poradni
W" miały
więcej partnerów seksualnych i niższy wiek, w którym odbyły pierwszy stosunek. Poza tym, w grupie tej 54% kobiet paliło tytoń,
podczas gdy w grupie studentek 8%. Po przebadaniu materiału szyjkowego przy użyciu metody FISH stwierdzono, że nie ma istotnych
różnic w częstości wykrywania ani dla wirusów HPV 6 i HPV 11 (3% wśród pacjentek poradni
W", 11% wśród studentek), ani dla HPV
16/18 (po 7% w każdej grupie). Autorzy sugerują, że współczynnik występowania byłby wyższy, gdyby użyto więcej niż jednej próbki od
jednej kobiety, ale nie wyjaśnia to podobieństwa w częstości występowania zakażenia wirusem HPV w obu grupach.
ZACHOWANIA SEKSUALNE A ZAKAŻENIA WIRUSEM HPV
Chociaż wyniki badań kohortowych oraz badań z użyciem grupy kontrolnej podtrzymują tezę, że wirus HPV jest czynnikiem
etiologicznym raka szyjki macicy, trudno wyjaśnić widoczny brak związku między zachowaniami seksualnymi, pozostającymi w korelacji
z rozwojem raka szyjki macicy, a obecnością genomu wirusa HPV. Dwie grupy badawcze próbowały to wyjaśnić. Yilla i wsp. (1989)
(25)
badali epidemiologiczną korelację zakażenia HPV16/18 oraz HPY6/11 u kobiet, które trafiły do Kliniki Planowania Rodziny oraz do
Instytutu Zdrowia Matki i Dziecka w dwóch brazylijskich metropoliach Recife i Sao Paulo. W Recife standaryzowany w grupach
wiekowych współczynnik zapadalności na raka szyjki macicy wynosił 96, 5 na milion kobiet. Częstość zakażenia wirusami HPV 6/11 i
HPV 16/18 była znacząco wyższa w Recife w porównaniu z Sao Paulo. Izolowane badania z użyciem grupy kontrolnej wykazały, że
czynnikami niezależnie związanymi z ryzykiem infekcji wirusami HPV 6/11 były praktyki stosunków analnych oraz obecna ciąża, i że
tylko jedna zmienna - częstość wizyt u ginekologa - była związana z infekcją wirusami HPV 16/18. Wczesny wiek, w którym kobieta
odbyła swój pierwszy stosunek i więcej niż pięciu partnerów seksualnych były związane, ale nieznacząco, z infekcją wirusem HPV.
Azocar
(26)
badał związek pomiędzy zakażeniem wirusem HPV a zachowaniami seksualnymi przez porównanie częstości wykrywania
genomu wirusa HPV u 46 kobiet wywodzących się z rdzennej grupy ludności, pozostających w monogamii i u 118 nie pozostających w
monogamii. Obecność wirusowego genomu stwierdzono u 35% kobiet z drugiej grupy (niemonogamicznej) używając techniki
hybrydyzacji dot blot: 11% miało odchylenia w badaniach cytologicznych, podczas gdy u żadnej z 42 kobiet monogamicznych nie
stwierdzono odchyleń w badaniu cytologicznym ani dowodu istnienia infekcji wirusem HPV.
Czynnik męski
W celu dalszej oceny związku pomiędzy nowotworem szyjki i zachowaniami seksualnymi a zakażeniem szyjki wirusem HPV, po nowe
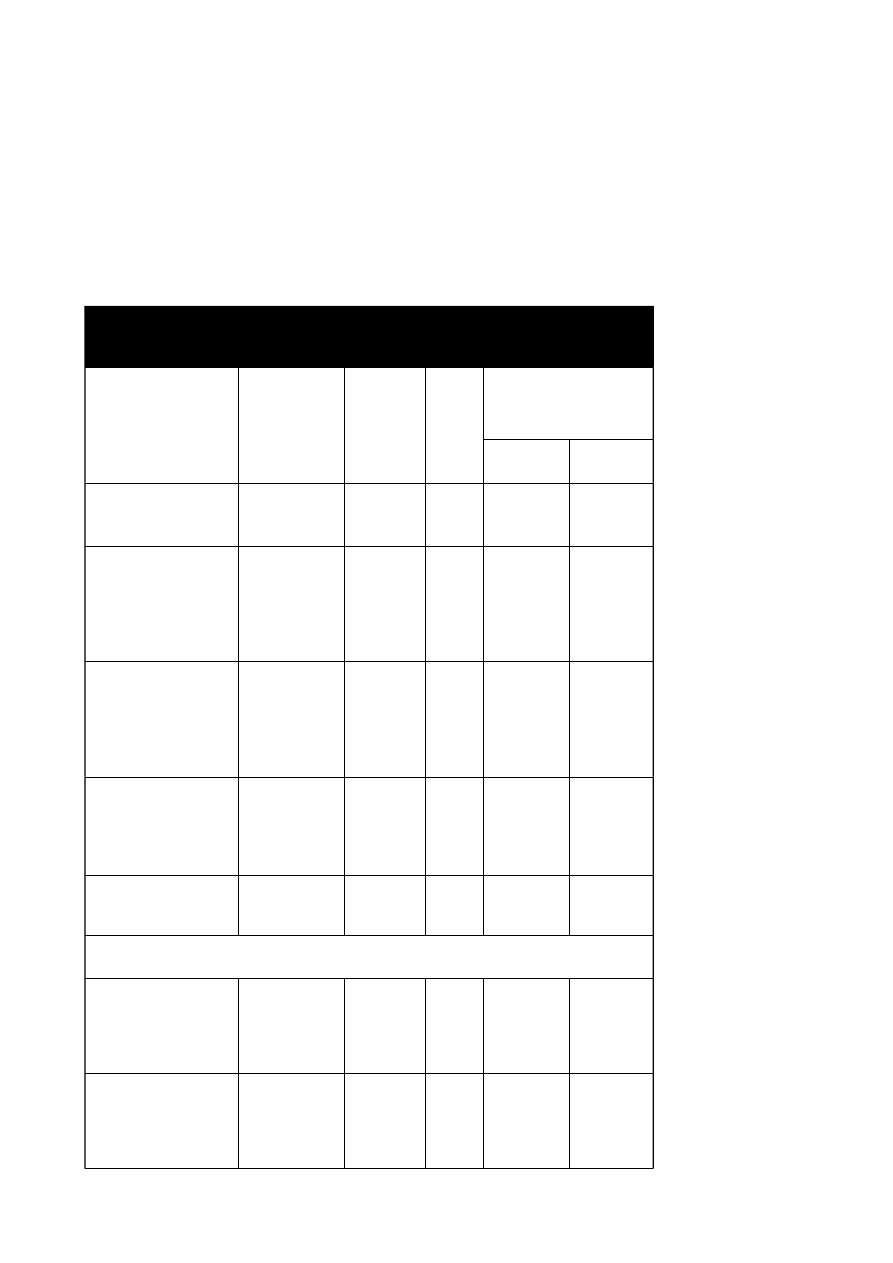
informacje zwrócono się do populacji męskiej. Kolposkopowe i histologiczne potwierdzenie infekcji penisa wirusem HPV było obecne u
53-75% partnerów kobiet z zakażeniem narządów płciowych, wywołanym tymże wirusem. Obecność wirusowego DNA stwierdzono
również wewnątrz tych zmian (patrz tabela 3).
Związek pomiędzy stosunkami pozamałżeńskimi a rozwojem raka szyjki macicy u żony jest dobrze znany. Niewielu badaczy szukało
wirusa HPV w męskiej grupie kontrolnej. Melchers i wsp.
(27)
zbadali za pomocą metody PCR mocz, pochodzący od 14 ochotników płci
męskiej, pracowników Wydziału Patologii i nie znaleźli tam obecności wirusa HPV. Brinton i wsp. (1989)
(28)
przeprowadzili badanie z
użyciem grupy kontrolnej, żyjących w monogamii mężów 204 pacjentek z rakiem oraz 485, również pozostających w monogamii mężów
kobiet bez raka, jako grupy kontrolnej. Znaczący wzrost ryzyka raka szyjki macicy występował wraz ze wzrostem liczby partnerów
seksualnych oraz niskim poziomem wykształcenia u mężów. Izolowana obecność HPV 6/ 11 albo HPV 16/18 w wymazach z penisa lub
cewki moczowej nie była związana ze wzrostem ryzyka rozwoju raka szyjki macicy u ich żon. Taki związek zaobserwowano u niewielkiej
liczby mężów z podwójną infekcją (ryzyko względne = 2, 6; 95% przedział ufności = 0, 9-6, 9). Badacze nie byli w stanie powiązać
zachowań seksualnych mężczyzn z obecnością wirusa HPV.
ZAKAŻENIA WIRUSEM HPV OD MATKI
Chociaż typy wirusa HPV związane z brodawkami (kłykcinami) narządów płciowych są często odmienne od tych, które wiąże się z
rozwojem raka szyjki macicy, wysunięto przypuszczenie, prawdopodobnie słuszne, że zakażenie narządów płciowych wywołane
wirusem HPV jest przenoszone drogą płciową. Jednak nie we wszystkich przypadkach może tak być. Wiele grup badawczych donosiło
o obecności DNA wirusa HPV 16 w szyjkowych lub pochwowych wymazach u młodych dziewic. Mechanizm tego zakażenia nie jest
poznany. Liczne badania epidemiologiczne i molekularne poparły hipotezę, że źródłem wirusów wywołujących młodzieńczą
brodawczakowatość układu oddechowego (JRP - juvenile respiratory papillomatosis) jest zakażenie dróg rodnych (Sedlacek i wsp.
1989)29 i że zakażenie ma miejsce w czasie porodu. Istnieje kilka opisów przypadków noworodków ze zmianami brodawkowatymi
(kłykcinami) w obrębie narządów płciowych bądź nabycia takich zmian w ciągu pierwszych kilku lat życia. Roman i Fife (1986)(30)
donoszą, że 4% napletków pochodzących od 70 nieselekcjonowanych męskich noworodków podlegających obrzezaniu, zawierało DNA
wirusa HPV. Zarówno młodzieńczą brodawczakowatość krtaniową, jak i dotyczącą narządów płciowych spotyka się rzadko i nie
wiadomo, jak często dochodzi do pionowego szerzenia się zakażenia. Istnieją dane mówiące o tym, że częstość wydzielania wirusa
HPV z szyjki wzrasta w okresie ciąży. Sedlacek i wsp. (29) wykazali obecność genomu wirusa HPV w aspiratach z jamy ustnej u 11
spośród 23 noworodków (47, 8%) urodzonych drogą pochwową z matek HPV dodatnich.
Tabela 3 - Częstość występowania DNA wirusa HPV w materiale uzyskanym od różnych
populacji mężczyzn
Badania populacji
mężczyzn
Technika
hybrydyzacji
Materiał Liczba
Częstość występowania
wirusowego DNA
HPV 16/18
HPV 6/11
Partnerzy kobiet DNA
32
HPV pozytywnych
FISH
Wymaz z
prącia
40
15(37, 5%)
14(35%)
Partnerzy kobiet z
dysplazją
33
lub
kłykcinami szyjki z
nieprawidłowościami w
obrazie kolposkopowym
Southern blot
Biopsja z
prącia
48***
12(25%)
9(18, 8%)
Mężczyźni z
kłykcinami
27
kończystymi
umiejscowionymi w
ujściu cewki moczowej
PGR
Mocz
17
/
1 5 (88%)
Partnerzy kobiet z
34
histologicznym
rozpoznaniem infekcji
wirusem HPV
FISH
Biopsja z
prącia
35
15(43%)
8 (25%)
Rak prącia
35
Southern blot
Biopsja z
prącia
53
26 (49%)
44 (9%)
Badania z udziałem grupy kontrolnej
Mężowie 28 pacjentek z
rakiem szyjki, żyjący w
monogamii.
Wymaz z
prącia i
cewki
moczo wej
147
22(15%)
19(13%) *
33
Mężowie kobiet
stanowiących grupę
kontrolną, żyjący w
monogamii
374
48(13%)
(9%)**

Tabela 3 - Częstość występowania DNA wirusa HPV w materiale uzyskanym od różnych
populacji mężczyzn
* spośród nich 8 miało także podwójną infekcję oboma typami wirusa ** spośród nich 9
miało także podwójną infekcję oboma typami wirusa **przetestowano dodatkowo 12 próbek,
ale ilość DNA była niewystarczająca
Genom wirusa HPV16 wyizolowano ostatnio ze zmian złośliwych innych narządów niż płciowe: rogówki, przełyku, okolicy
okołopaznokciowej, tkanki gruczołowej prostaty, oskrzeli. W tych przypadkach przeniesienie zakażenia drogą płciową było niemożliwe,
stąd nasuwa się oczywisty wniosek, że związek między zakażeniem wirusem HPV 16 a rozrostem nowotworowym nie odnosi się
wyłącznie do szyjki macicy.
ROZPOWSZECHNIENIE ZAKAŻENIA WIRUSEM HPV U ZDROWYCH
KOBIET
Liczne doniesienia mówiące o występowaniu wśród kobiet zdrowych, stanowiących grupę kontrolną w badaniach porównawczych,
znacznych wahań w liczbie pozytywnych wyników prób na obecność wirusa, niezmiernie utrudniły końcową interpretację wyników
badań epidemiologicznych. Chociaż uzyskiwane rozbieżności mogą odzwierciedlać wpływ czynników geograficznych, wartość
diagnostyczną badanego materiału biologicznego czy wreszcie czułość stosowanych technik hybrydyzacyjnych, to jednak dane
szacunkowe mówią, że prawdopodobnie od 30 do 40% dorosłych kobiet jest zakażonych wirusem HPV. Fakt znacznego
rozpowszechnienia infekcji wśród kobiet zdrowych został dowiedziony za pomocą metody PCR, którą
wykorzystano do wykazania obecności genomu wirusa HPV w materiale szyjkowym. Chociaż w trakcie procesu badawczego istniała
możliwość uzyskania zbyt wysokich wyników wynikających z przeniesienia, to jednak należało się spodziewać wykrycia tak znacznej
częstości występowania wirusa z powodu bardzo dużej czułości metody. Nie odkryto znaczenia zakażenia małą ilością wirusów, w czym
z pewnością pomogłoby istnienie ilościowej modyfikacji techniki PCR.
Tak znaczne rozpowszechnienie zakażenia wirusem HPV samo przez się nie wyklucza jego udziału w szyjkowej karcynogenezie.
Inne infekcje wirusowe np. wirusem Epstein Barra, zapalenia wątroby typu B, HTLV-1 ściśle są związane z rozwojem nowotworów.
Wszystkie te wirusy mają długi okres latencji - od pierwotnego zakażenia do rozwoju nowotworu upływa od 20 do 50 lat. Jest godne
podkreślenia, że w przeważającej części przypadków nigdy nie dojdzie do rozwoju określonego nowotworu.
Reasumując, chociaż wzrasta liczba eksperymentalnych dowodów potwierdzających, że zakażenie wirusem HPV odgrywa główną
rolę w rozwoju raka szyjki macicy, to wciąż jednak pozostaje wiele nieścisłości w dotychczas zebranych danych epidemiologicznych.
Wytłumaczeniem tego stanu rzeczy mogą być jeszcze nie sprecyzowane wady stosowanych metod identyfikacji wirusa. Daleko nam
również do pełnego poznania etapów rozwoju infekcji wirusem HPV i jej wpływu na komórki gospodarza.
powrót do listy numerów archiwalnych
powrót do strony głównej
Piśmiennictwo
1. de Villiers E. Hertogencity of the Human papillomavirus group. J of Virology 1989; 63: 11. 4898-4903
2. Lancaster WD. Norrild B. Diagnosis of HPV by DNA hybridizalion techniques. Human papiollomavirus and crevical cancer. IARC Scientitic Publications 1989 no 94
3. Caussy D.W. Daya D. Roth P, Reeves W. Rawls W. Evaluation of methods for detecting Human papillomavirus deoxyribonucleic sequences in clinical specimes. J Clin
Micro 1988; 26: 22. 2. 236-243
4. Brandsma J. Burk R. Lancaster WD, Pfister H. Schittman M. Intcr-laboratory variation as an explanation for varying prevalence estimates oh Human papillomavirus
infection. Int J Cancer 1989: 43: 260-262
5. Hallam N. Gibson P. Green J, Chamock M. Detection and typing of Human papillomavirus infection of the uterine cervix by dot blot hybridization. J of Med Virol 1989;
27: 317-321
6. de Villiers EM. Wagner D. Schneidcr A, Wesch H, MilkawH. Wchrendorf J, Papendick U, zur Hausen H. Human papillomavirus infections in women with and without
abnonnal cervical cytology. The Lancet 1987: Sept 26: 703-705
7. Pao CC. Lui C. Maa J, Lai C, Wu S. Soong Y. Detection of Human papillomaviruses in cervicovaginal cells using polymerase Chain reaction. The J of Infect Dis 1990;
161: 113-115
8. Reeves WC. Arosemena JR. Garcia M. Loo de Lao S, Cuevas M. Quiroz E, Caussy D, Rawls WE. Genital Human papillomavirus infection in Panama city prostitules.
The J of Infect Dis 1989; 160: 599-603
9. Young LS. Bevan IS. Johnson MA. Blomfield Pl. Bromodge T, Maitland NT, Woodman CB. The polymerase chain reaction: a new epidemiological tool for investigating
cervica Human papillomavirus infection. BMJ 1989; 298: 14-18
10. Kwok S. Higuchi R. Avoiding talse positives with PCR. Nature 1989; 339: 237-238 .
11. Meisels A. Fortin R. Condylomatous lesions of the cervix and vagina. Cytological patterns. Acta Cytol (Baltimore) 1976; 20: 505-509
12. Munoz N. Bosch X and Kalder JM. Does Humanpapilloma virus cause cervical cancer ? The stale of the epidemiological evidence. British J Cancer 1988; 57: 1-5
13. Reeves WC. Brinton LA. Garcia M. Brenes MM. Herrero R, Gaitin E. Tenorio F, De Britton RC and Rawls WE. Human papillomavirus infection and cervical cancer in
Latin America. The New Eng J of Med 1989; 320: 22. 1437-1441
14. Schmanz R. Okong P. De Villiers E-M, Dennin R, Brade L, Lwanga SK, Owor R. Multiple infection in cases of cervical cancer from a high-incidence area in tropical
Africa, Int J of Cancer 1989, 43: 805-809

15. Donnan SPB. Wong FWS. Ho SC. Clau EMC, Takashi K. Estve J. Reproductive and sexual risk factors in cervical cancer among Hong Kong Chinese. Int J Epid 1989;
18: l, 32-36
16. Murthy NS. Seligal A. Singh V. Satanarayana L. Grupta MM, Mitra AB, LuthraUK. Risk factors relalted to biological behaviour of precancerous lesions of the uterine
cervix. Brit J Cancer 1990; 61-5. 732-736
17. Nash JD. Burke TW and Hoskins WJ. Biologic course of cervical human papillomavirus infection. Obstet Gynaecol 1987; 69: 160-162
18. Mitchell H. Drake M and Medley G. Prospective evaluation of risk of cervical cancer after cytological evidence of human papillomavirus intection. Lancet 1986; 1:
573-575
19. Meisel., A and Morin C. Flat condylomata of the cervix: two variants with diflerent prognosis. In Peto R and zur Hausen H. (cds) 1986. Viral etiology of cervical cancer
(Banbury Report No 21). CSH Press. New York. pp 115-119
20. Campion MJ. McCance DJ. Cuzick J. Singer A. Progressive potential of mild cervical atypia: Prospective cytological colposcopic and virological study. Lancet 1986;
Aug 2 nd: 237-240
21. Syrjanan K. Mantyjarvi R, Saarikoski S, Vayrynen M, Syrjanan S, Parkkinen S, Kliskoski M. Saastamoinen J, Castren O. Factors associated with progression of
cervical human papillomavirus (HPV) infections into carcinoma in situ during long term prospective follow- up. Brit J of Obstet and Gynaecol 1988; 95: 1096-1102
22. Hollingsworth T(personnel communication) PhD Tnesis. Imperial Cancer Research Fund. London.
23. Kjaer SK, Dc Villiers E-M, Haugaard BJ, Christensen, Teisen C, Moller KA, Poll P. Jenson H. vestergaard BF. Lynge E and Jenson OM. Human Papillomavirus, herpes
simplex vims and cervical cancer incidence in Greenland and Denmark. A population based cross-sectional study Int J Cancer 1988; 41: 518-524
24. Kiviat NB, Koutsky LA, Paavonen JA, Galloway DA, Crithlow CW. Beckmann AM. McDougall JK, Peterson ML, Stevens CE, Lipinski CM and Holmes KK.
Prevalence of genital papillomavirus infection among women attending a college student health clinic or a sexually transmitted disease clinic. The J of Infect Dis
1989; 159: 2. 293-302
25. Villa LL, Franco ELF. Epidemiological correlates of cervical neoplasia and risk of Human papillomavirus infection in asymptomatic women in Brazil. J Nat Cancer
Inst 1989; 81: 3. 32- 340
26. Azocar J, Abad SMJ. Acosta H, Hernandez R, Gallegos M. Pifano E, Blanch R and Kramar A. Prevalence of cervical dysptasia and HPV infection according to sexual
behaviour. Int J Cancer 1990; 45: 662-625
27. Melchers WJG. Schiff E, Stolz E. Lindeman J, Ouint WGV. Human papillomavirus detection in urine samples from male patients by the polymerase chain reaction. J
Clin Micro 1989: 27: 1171-1174
28. Brinton LA, Reeves WC, Brenes MM. Herrero R, Gaitan E, Tenorio F. De Britton RC, Garcia M. Rawls WE. The male factor in the aetiology of cervical cancer among
sexually monogamous women. Int J Cancer 1989; 44: 199-203
29. Sedlacck TV. Lindheim S, Elder C. Hasly L. Woodland M. Ludomirsky A, Rando RF. Mecha-nism for human papillomavirus transmission at birth. Am J Obstet
Gynaecol 1989; 161: l, 55-ins of normal newborns.
30 . Roman A. Fife K. Human Papillomayirus DNA associated J Infect Dis 1986; 153: 855-861
31.Manos M, Lee K. Greer C, Waldman J, Kiyiat N, Holmes K. Looking for human papillomavirus type 16 by PCR. Lancet 1990; l: 734
32. Schneidcr A. Sawada E, Gissmann L, ShaK. Human Papillomavirus in women history of abnormal papanicolaou smears and Iheir partners. Obstet and Gynaecol 1987;
69: 4, 554-561 .
33. Barrasso R, De Brux J, Croissant O, Orth G. High prevalence of Papillomavirus-associated intraepithelial neoplasia in sexual partners of women with cervical
intraepithelial neoplasia. The New Eng J of Med 1987; 317: 15. 916-923
34. Selvey L, Buntine D, Kennedy L, Frazer M. Male partners of women with human papillo mavirus infection. The Med J of Australia 1989; 150: 479-481
35. McCance DJ, Kalachie A, Ashdown K, Andrade L, Menzies F, Smith P, Doll R. Human papillomavirus type 16 and 18 in carcinomas of the penis from Brazil. Int J
Cancer; 37: 55-59
36. Tidy J, Party GCN, Ward P, Coleman DV. Peto J. Malcolm ADB, Farrell P. High rates of Human papillomavirus type 16 infection in cytologically normal cervices. The
Lancet 1989: I: 434
37. Munoz N, Bosch FX, Jenson OM. Human Papillomavirus and Ccryical Cancer. IARC Scientific Publications 1989; No. 94
powrót do listy numerów archiwalnych
powrót do strony głównej
Wyszukiwarka
Podobne podstrony:
Rak Szyjki Macicy 4
Rak szyjki macicy, Pielęgniarstwo licencjat cm umk, III rok, Ginekologia i pielęgniarstwo ginekologi
RAK SZYJKI MACICY
PMK W04 rak szyjki macicy i jajnika V2
Rak szyjki macicy profilaktyka (ostatnia)
rak szyjki macicy popraw
Rak szyjki macicy Wikipedia, Fizjoterapia, . fizjoterapia
Rak szyjki macicy Medigo, Fizjoterapia, . fizjoterapia
6 Rak szyjki macicy
Rak szyjki macicy
PATOMORFOLOGIA 15. Rak szyjki macicy, wyklady pato morfo, wyklady
Rak szyjki macicy wykład
Rak szyjki macicy
Rak szyjki macicy
Rak szyjki macicy
Rak szyjki macicy (2)
Infekcja HPV a rak szyjki macicy
Rak szyjki macicy
więcej podobnych podstron